- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
Алкенами называются углеводороды, содержащие одну двойную углерод-углеродную связь.
1. Дегидрогалогенирование алкилгалогенидов (гл. 10):
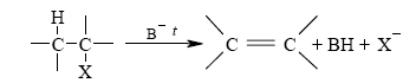
2. Дегидратация спиртов
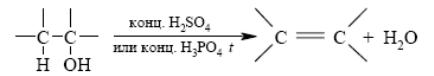
3. Дегалогенирование вицинальных дигалогенидов
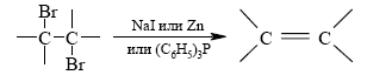
Элиминирование третичных аминов из гидроксидов тетраалкиламмония по А. Гофману
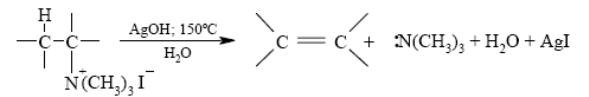
5. Дегидрирование алканов
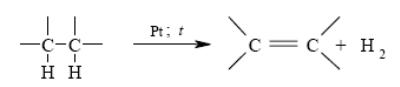
6. Стереоселективное восстановление алкинов до цис- и транс-алкенов
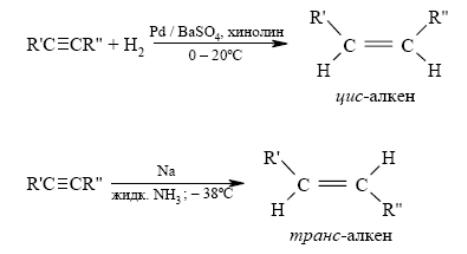
7. Реакция Г. Виттига

Взаимодействие с электрофильными реагентами: В результате взаимодействия электрофильного агента E+ с алкеном образуется карбокатион, обладающий высокой реакционной способностью. Карбокатион далее стабилизируется за счет быстрого присоединения нуклеофильного агента Nu-:
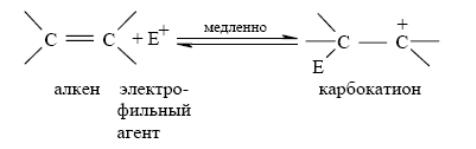
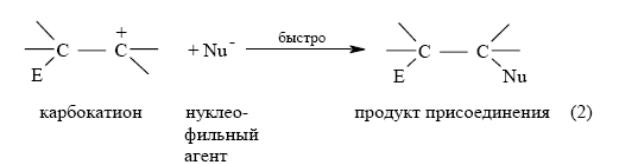
Электрофильное присоединение к двойной связи в классификации механизмов органических реакций имеет символ AdE (Addition Electrophilic) и в зависимости от числа реагирующих молекул обозначается как AdE2(бимолекулярная реакция) или AdE3 (тримолекулярная реакция).
Примеры: Присоединение галоенов. (Брома)В первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда.
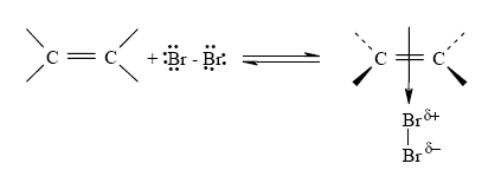
Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br – Br (или Cl – Cl), и пустая p-орбиталь sp2-гибридизованного атома углерода перекрывается с орбиталью «неподеленной пары» электронов атома галогена, образуя циклический ион бромония (или хлорония):
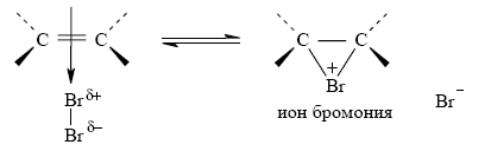
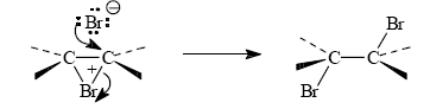
В последней, третьей, стадии анион брома как нуклеофильный агент атакут один из атомов углерода бромониевого иона. Нуклеофильная атака галогенид-иона приводит к раскрытию трехчленного цикла образованию вицинального дигалогенида (vic – рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение
SN 2 у атома углерода, где уходящей группой является Br.
Присоединение галогеноводородов: Анти-присоединение и второй порядок реакции по галогеноводороду согласуется с механизмом, в котором алкен взаимодействует с двумя молекулами галогеноводорода, одна из которых выполняет функцию электрофильного, а другая – нуклеофильного агента:
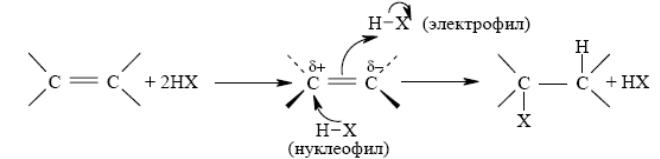
Морковников сформулировал эмпирическое правило, согласно которому несимметричные алкены присоединяют HX таким путем, что преимущественно образуется продукт, в котором H присоединяется к наименее замещенному, а X – к наиболее замещенному концу двойной связи. Обычно правило Морковникова объясняют различием в стабильности двух альтернативных карбкатионов.
Билет №7
1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
Координационная связь – это связь в комплексных соединениях, в которых один или несколько атомов образуют большее число связей, чем допускает их максимальная валентность. Различают двухцентровые (донорно-акцепторные) и многоцентровые комплексные связи. К первому типу связей относятся те, которые можно формально описать как передачу пары электронов от донорного атома (в данном случае он является лигандом L) к акцепторному (акцептор или комплексообразователь). Пара электронов лиганда переходит на свободную орбиталь акцептора (если случай d-элементов, то происходит переход пары электронов на d-орбиталь атома металла). Такие связи способны образовывать атомы переходных и непереходных элементов, но наиболее характерными они будут для переходных элементов. Природа связи, образованной по донорно-акцепоторному механизму не отличается от природы ковалентной связи (полярной).
Помимо донорно-акцепторного механизма существует и дативный механизм образования связи в комплексных соединениях. Если в качестве лиганда выступает атом, у которого есть свободные d или f орбитали, то очень большая вероятность того, что электроны с электронных оболочек будут переходить на электронные оболочки лиганда. В этом случае будет наблюдаться перекрывния электронных оболочек.
Теория строения комплексных соединений возникла из попыток ответить на вопрос, почему многие устойчивые молекулы способны присоединяться к комплексообразователю.
Для объяснения образования и свойств комплексных соединений в настоящее время применяют ряд теорий, в том числе теорию валентных связей. Образование комплексов теория валентных связей относит за счет донорно-акцепторного взаимодействия комплексообразователя и лигандов. Так, образование тетраэдрического иона [BeF4]2" можно объяснить следующим образом:
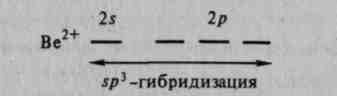
Ион Ве2+, имеющий свободные 2s- и 2p-орбитали, является акцептором четырех электронных пар, предоставляемых фторид-ионами:
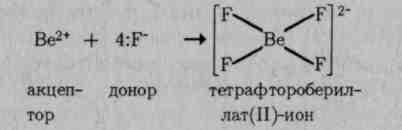
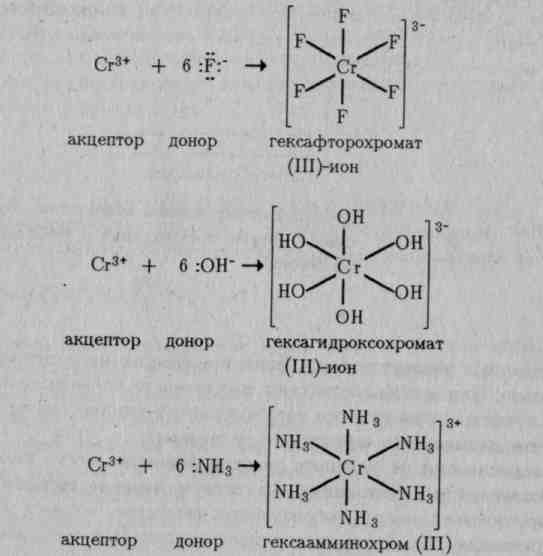
Тетраэдрическое строение комплексного иона [BeF4]2+ обусловлено sр3-гибридизацией валентных орбиталей бериллия. Таким же образом можно показать, что при взаимодействии иона Сг3+ с молекулами воды образуется октаэдрический комплексный ион
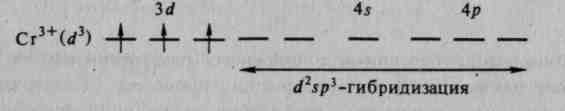
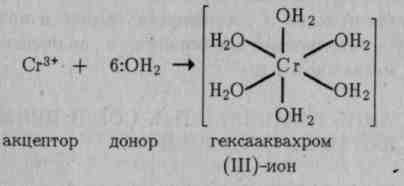
Октаэдрические комплексы образуются также при взаимодействии иона Сг3+ с фторид-, гидроксид- и другими лигандами: