
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
Длина связи – межъядерное расстояние между химически связанными атомами.
Валентный угол- угол между воображаемыми линиями, проходящими через химически связанные атомы.
Энергия связи – количество энергии, затрачиваемое на ее разрыв.
Порядок связи – согласно теории МО порядок связи оценивается полуразностью числа связывающих и разрыхляющих электронов.
Поляризуемость связи – мера возможности поляризации при действии внешнего поля.
Полярность связи – степень смещения электронной плотности между взимодействующими атомами за счет различий в ЭО элементов.
Диполи – полярные молекулы.
Длина диполя – расстояние между центрами тяжести положительного и отрицательного зарядов.
Дипольный момент – произведение длины диполя на величину электрического заряда (дипольный момент молекулы – векторная сумма моментов всех связей и несвязывающих электронных пар в молекуле.)
Билет №6.
1. Трактовка ионной связи на основе электростатических представлений.
Природа ионной связи объясняется с позиций электростатического взаимодействия. Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эта способность оценивается величинами энергий ионизации и сродства к электрону. Простые анионы легче образуют р-элементы 7-й группы. Простые катионы – щелочные и щелочноземельные металлы. Ионная связь возникает за счет электростатической силы притяжения между катионом и анионом. Соединения состоящие из простых ионов немногочисленны. Они образуются при взаимодействии щелочно- и щелочноземельных металлов с галогенами. Однако и в этом случае электронная плотность между ионами не равна нулю. Поэтому можно лишь говорить о преимущественном проявлении ионной связи.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью. Вследствии этого каждый ион окружен максимальным числом ионов противоположного знака. Однако из за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной ориентации ионов. Подобная координация достигается в соответствующих кристаллических решетках. Т.о. в обычных условиях ионные соединения – кристаллические вещества. И для ионных соединений понятие простых двухионных молекул теряет смысл.
Существует эмпирическое правило Фаянса: Связь будет преимущественно ионной ечли заряды образующихся ионов невелики. (Хлорид натрия – ионная, хлорид алюминия – ковалентная).
Степень ионности связи = экспериментально определяемый дипольный момент / дипольный момент, рассчитанный в предположении идеальной ионной связи.
2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
Сущность метода атомной эмиссии заключается в измерении интенсивности характеристического излучения возбуждённых атомов. Для получения спектра эмиссии частицам анализируемого вещества необходимо придать дополнительную энергию. С этой целью пробу при спектральном анализе вводят в зону высокой температуры, где она нагревается и испаряется, а попавшие в газовую фазу молекулы диссоциируют на атомы, которые при столкновении с электронами переходят в возбужденное состояние. В возбужденном состоянии атомы могут находиться очень недолго (10-7 – 10-8 сек). Самопроизвольно возвращаясь в нормальное состояние они испускают избыток энергии в виде квантов света. В практике атомно-эмиссионного спектрального анализа в качестве источников возбуждения спектров применяют пламя, электрические дуги постоянного и переменного тока, низко- и высоковольтную конденсированную искру, низковольтный импульсный разряд, различные формы тлеющего разряда. В последние годы начинают широко использовать также различные виды высокочастотных разрядов - источник индуктивно-связанной высокочастотной плазмы (ИСП), микроволновой разряд и др. Принципиальная схема атомно-эмисионного спектрометра состоит из: Источник возбуждения спектра, монохроматор, детектор, усилитель, устройство обработки и вывода сигнала. Для проведения качественного анализа достаточно получить линию в спектре соответствующую линии испускания определяемого элемента. Для количественного анализа пользуются градуиировочными характеристиками, измеряя интенсивности излучения стандартных растворов.
ААС: Метод основан на резонансном поглощении света свободными атомами, возникающем при пропускании пучка света через слой атомного пара. Селективно поглощая свет на частоте резонансного перехода, атомы переходят из основного состояния в возбужденное. Частота поглощаемого света определяется из соотношения: h=E1-E0.
Интенсивность проходящего пучка света на этой частоте экспоненциально убывает по закону Бугера-Ламберта:
I=I0exp(-kl)
k- коэффициент поглощения света; l - толщина поглощающего слоя
При практических измерениях обычно пользуются значением оптической плотности поглощения
A=lg(I0/I)=kllge=0.4343kl.
Для получения поглощающего слоя используют различные типы атомизации: пламенную, атомизацию в графитовой печи, искровой разряд и др. Для определения ртути используется метод холодного пара. В качестве источников света могут использоваться люминесцентные лампы, лампы с СВЧ возбуждением, лампы с полым катодом. Баллон (I) лампы с полым катодом сделан из молибденового стекла и снабжен (при работе в УФ области) кварцевым окном, пропускающим УФ излучение. Внутри баллона помещен катод , имеющий форму полого цилиндра (иногда закрытого с одной стороны) с отверстием диаметром 2-З мм, изготовленный из того металла для определения которого предназначена лампа, или из сплава, содержащего этот элемент и анод . Баллон заполнен аргоном или, чаще, неоном при пониженном давлении. К электродам лампы через впаянные в баллон проводники подводят постоянное напряжение 200-300 В. При этом в лампе возникает тлеющий разряд, локализующийся внутри катода. Пары металла из которого изготовлен катод поступают в плазму разряда вследствие катодного распыления и испарения. В основном за счет соударения с электронами в плазме происходит возбуждение свечения. Ширина линий элементов излучаемых лампами с полым катодом достаточно мала, что имеет очень важное значение для AАА. Существует несколько типов приборов для ААА. Так, в однолучевом варианте, свет от лампы с полым катодом
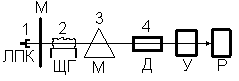
(ЛПК) проходит через пламя щелевой горелки (ЩГ), в которое впрыскивается мелкодисперсный аэрозоль и попадает через монохроматор (М) на детектор (Д). Сигнал от детектора усиливается и регистрируется. Чтобы отсечь излучение пламени свечение лампы с полым катодом модулируют либо механически (модулятором М), либо электрически, питая лампу с полым катодом переменным током, а усилитель сигнала фотоумножителя (У) настраивают на частоту модулятора.
Аналитический сигнал в данном случае – это доля прошедшего света. Он логарифмически связан с концентрацией, поэтому можно осуществить количественный анализ. Обычно он выполняется методом градуировочного графика, который строится непосредственно перед анализом или сразу после анализа раствора с неизвестной концентрацией.
В методе атомизации в графитовой печи можно изменять температурную программу что позволяет производить оптимизацию параметром атомизации. Предел обнаружения этого метода на порядок ниже чем пламенного.
Молекулярная фотометрия: Фотометрический, или молекулярный абсорбционный анализ – анализ по поглощению света молекулами анализируемого вещества и сложными ионами.
В фотометрическом анализе используется ближняя УФ, видимая и ближняя ИК области спектра электромагнитного излучения.
По используемому оборудованию фотометрию делят на три раздела:
визуальная фотометрия
фотоэлектроколориметрия
спектрофотометрия.
Приборы в фотометрии состоят из пяти основных узлов:
стабильного источника излучения
монохроматора – устройства, позволяющего выделить определенную длину волны излучения
кюветы или пробирки
детектора или преобразователя энергии излучения в электрический сигнал
индикатора сигнала.
Основные факты, позволяющие связать спектр поглощения (цвет) вещества с его строением, были установлены еще в XIX веке. В 1876 Витт пришел к заключению, что цветность органических соединений связана с присутствием в них определенных групп и связей, таких как азо (-N=N-), виниленовой (-СН=СН-), азометиновой (-СН=N-), нитро (NO2), нитрозо (-N=0), карбонильной (=С=О) и др. Эти группы Витт назвал хромофорами. Другие группы, которые в результате взаимодействия с хромофорами углубляют цвет соединения (приводят к батохромному смещению), а также придают им способность фиксироваться на тканях, он назвал ауксохромами. К ним относятся группы ОН, 0R, NH2, NHR, NR2 (где R - алифатический радикал – СН3, C2H5 и др.). хромофором называют группу атомов, которые при введении в насыщенный углеводород образуют соединения, имеющие избирательное поглощение в области 200 - 1000 нм. Закон Бугера-Ламберта-Бера устанавливает линейную связь между оптической плотностью А и концентрацией вещества С в растворе
А = Cl,
где С выражена в моль/л, l в см.
В случае строгого выполнения этого закона, определив коэффициент экстинкции при длине волны по эталонному раствору со строго известной концентрацией, можно рассчитать содержание этого вещества в анализируемых образцах. Это так называемый метод стандарта или эталона. Подавляющее большинство веществ (99 % всех соединений в фотометрии) переводят в окрашенные соединения с помощью тех или иных химических реакций.
Для этой цели применяют целый ряд различных типов химических реакций. Для водных растворов это прежде всего реакции:
комплексообразования,
окисления-восстановления, но очень редко, хромат-бихромат-ионы
органические реакции различных типов,
экстракционно-фотометрические реакции.
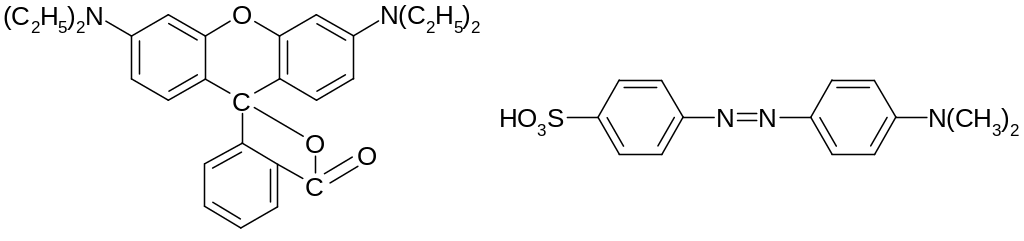
Родамин С Формула метилового оранжевого
Катионов красителей, которые могут применяться для этой задачи, и для определения других гидрофобных анионов, весьма много: метиленовый фиолетовый, кристаллический фиолетовый, бриллиантовый зелёный, фуксин, эозины и ещё большое количество. Все они относятся к двум группам структур: это диарилметановые красители (их представитель метиленовый голубой) и триарилметановые красители.
С катионными красителями, кроме алкилсульфатов, определяют широкую гамму металлов, образующих гидрофобные анионные комплексы: это Au(Hal)4; Ta(Hal)4; BF4; Hg(Hal)3; Cd(Hal)4; Zn(CNS)4; Co(CNS)4, германий образует пергалоидные комплексы.
