
- •Пояснювальна записка
- •Список літератури:
- •План занять з “Аналітичної хімії” (II частина)
- •Метод нейтралізації;
- •Метод окислення – відновлення, який в свою чергу
- •Метод осадження;
- •Методи оксидиметрії.
- •Так як в умові задачі дається титр, а його формула
- •Метод йодометрії.
- •Метод осадження.
- •Метод комплексонометрії
- •1). Речовина повинна бути хімічно чиста;
- •2). Склад її повинен строго відповідати формулі;
- •3). Речовина не повинна взаємодіяти з оксигеном, двоокисом карбону та водяними парами повітря.
- •Розрахунки в об’ємному аналізі. Під час об’ємно - аналітичних визначень найчастіше розраховують одну з 3 –х величин:
- •Масу розчиненої речовини можна визначити за титром, якщо відомий об’єм:
- •А тепер, знаючи Сn СаСо3 можна визначити Сn Тр.Б.
- •I.Організаційна частина.
- •II. Вивчення нового матеріалу.
- •Стандартний
- •Робочий
- •Використовуемо формулу
- •Запитання для самоконтролю
- •В). Нормальна
- •Фронтальний опит.
- •Використана література
I.Організаційна частина.
II. Вивчення нового матеріалу.
1.Титрування.
2.Одиниці виміру концентрації розчинів.
3.Еталон в об’емному аналізі.
4.Метод ( як робиться ).
III. Закріплення:
IV .Рішення задач.
Приливання одного розчину до другого із мірної посуди бюретки.
а) % концентрації ( кількість грамів речовини в 100 г. розчину ).
б) Молярна ( См ) ( кількість молей розчинної речовини в 1 л. Розчину ).
M в 1 л. = См х М ( формула маси речовини в 1 л. Розчину через молярну
концентрацію ).
в) Нормальна ( Сп ) (кількість грамів – еквівалентів розчинної речовини в
1 л. розчину ).
Евівалент – це та кількість речовини , яка вступае в реакцію ( з 1 вагою
частиною водню або 8 ваговими частинами кисню.) Всі речовини вступають в реакцію лише в еквівалентних кількостях.
![]() ;
;
![]() ;
;
![]()
М в 1 л. = Сп х Е
Т – титр – кількість грамів речовини містить в 1 мл. розчину.
![]() ;
Тстанд./аналіз
;
Тстанд./аналіз
![]()
М в любому об’емі
В якості еталону в об’емному аналізі використовуються розчини які називаються:
Стандартний
Титрований це одне і те саме
Робочий
Це розчини, концентрація ( Сп ) яких відома і як правило виражена нормальністю.
HCl + NaOH = NaCl + H2O
HCl – 1л. 1н. розчину містить 36,5г.
NaOH – 1л. н. розчину містить – 40г.
Коли об’еми рівні, то і нормальності однакові, а якщо об’еми різні, то і нормальності зворотно пропорціональні. За V і Сп одного розчину судимо про Сп другого розчину, який вступив з першимв реакцію.
![]() ;
;
Ця залежність між V та Сп реагуючихи речовин ввійшла в науку під назвою закону пропорціональності.
Звідси:
Сп досліджуваного
![]() - це математичний вираз закону
пропорціональності.
- це математичний вираз закону
пропорціональності.
Залежність міжV I Сп існує тільке для нормальної концентроції. Стандартні розчини готують двома способами:
1.Із фіксаналів;
2. по вірно розрахованій наважці, взятій на аналітичних терезах.
Наприклад: потрібно приготувати 750 мл. 0,14 н. розчину щавелевої кислоти.
Використовуемо формулу
Як робиться ? ( метод )
Титрування ( метод нейтралізації ).
Наприклад:
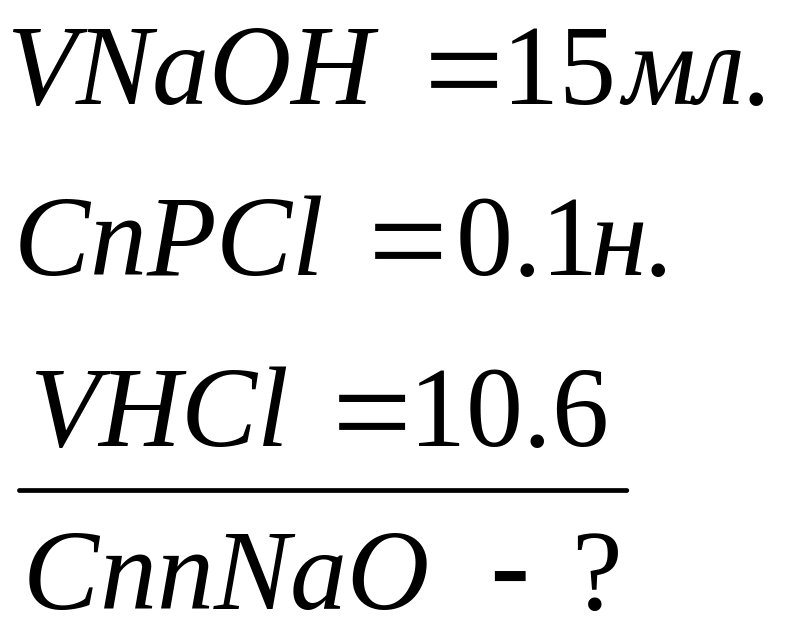
![]() ;
;
В об’ємному аналізі 3 учасники:
1.досліджуванний розчин;
2.стандартний розчин;
3.Індикатор (необхідний для установлення точки еквівалентності ).
Об’ємний аналіз ділиться на слідуючі методи:
1.нейтралізації
2.осадження
3.комплексонометрії
4.перманганатометрії
5.йодометрії.
Закріплення.
1.Чому концентрація стандартного розчину завжди виражена нормальністю ?
2.Ви взяли 10 мл. досліджуваного розчину,відтитрували його 10 мл. стандартного розчину, що ви можете сказати про нормальність аналізуемого розчину ? ( концентрація однакова ), а якщо 10 мл. досліджуваного розчину відтитрували 20 мл. стандартного ?
Задачі: Ю.Н. Жванко та інші.
стор. 94 приклад 1.
стор. 95 контрольне запитання № 8,№ 7,№ 9
Задача: 6 г. NaOH розчинили в 1 л. розчину, яка нормальність одержаного
розчину ?
Задача: 6 г. NaOH розчинили в 750 мл. розчину, визначте Сп ?
Задача: Розрахувати титр 0,05 н. HCl
Сп HCl = 0.05
