
- •Пояснювальна записка
- •Список літератури:
- •План занять з “Аналітичної хімії” (II частина)
- •Метод нейтралізації;
- •Метод окислення – відновлення, який в свою чергу
- •Метод осадження;
- •Методи оксидиметрії.
- •Так як в умові задачі дається титр, а його формула
- •Метод йодометрії.
- •Метод осадження.
- •Метод комплексонометрії
- •1). Речовина повинна бути хімічно чиста;
- •2). Склад її повинен строго відповідати формулі;
- •3). Речовина не повинна взаємодіяти з оксигеном, двоокисом карбону та водяними парами повітря.
- •Розрахунки в об’ємному аналізі. Під час об’ємно - аналітичних визначень найчастіше розраховують одну з 3 –х величин:
- •Масу розчиненої речовини можна визначити за титром, якщо відомий об’єм:
- •А тепер, знаючи Сn СаСо3 можна визначити Сn Тр.Б.
- •I.Організаційна частина.
- •II. Вивчення нового матеріалу.
- •Стандартний
- •Робочий
- •Використовуемо формулу
- •Запитання для самоконтролю
- •В). Нормальна
- •Фронтальний опит.
- •Використана література
Метод нейтралізації;
Метод окислення – відновлення, який в свою чергу
підрозділяється на метод перманганатометрії та йодометрії;
Метод осадження;
Метод комплексонометрії.
Метод нейтралізації.
В основі методу лежить реакція взаємодії між іонами Н+ (що зумовлюють кисле середовище) та ОН- (що зумовлюють лужне середовище). Метод застосовується для визначення кислот, основ та солей, (які взаємодіють з основами або кислотами, такі як Na2CO3, NH4Cℓ, Na2B2О7 та інші.). Для визначення кислот використовують титровані розчини лугів – NaOH або КОН, для визначення основ – розчини кислот - НСℓ; H2SO4; H2C2O4;
Любе об’ємно-аналітичне визначення складається з слідуючих операцій:
Приготування стандартного розчину;
Вибір індикатора;
Встановлення титру та нормальності стандартного розчину;
Титрування досліджуваного розчину стандартним розчином;
5. Розрахунки результатів аналізу.
В методі нейтралізації в якості індикаторів використовують:
Фенолфталеїн;
Метиловий оранжевий;
Таблиця 1.
1.Фенолфталеїн |
Кисле середовище |
Нейтральне середовище |
Лужне середовище |
Безбарвний |
Безбарвний |
Від рожевого до малинового |
|
2. Метиловий-оранжевий
|
Рожевий |
Оранжевий |
Жовтий |
3.Лакмус
|
Рожевий |
Фіолетовий |
Синій |
Методи оксидиметрії.
а). перманганатометрія – це метод об'ємного аналізу, в якому в якості стандартного розчину використовують розчин КМnО4. Перманганат калію являється сильним окислювачем, особливо в кислому середовищі і здатен окислювати багато речовин. Для того, щоб зрозуміти чому це так, необхідно згадати будову атому мангану та пояснити, що з ним відбувається, коли він знаходиться в складі КМnО4 в різних середовищах розчинів.
Найкраще це йому вдається в кислому середовищі, він збирає найбільшу кількість електронів аж 5.
Mnº +25) ) ) ) 1S22S22P63S23P64S23d5
2 8 13 2






 1S2
2S2 2Р6
3S2
3Р6
3d5
4Р6
1S2
2S2 2Р6
3S2
3Р6
3d5
4Р6


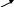 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑
4S2
↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑
4S2
↑↓
В період хімічного збудження відбувається розпарювання 4S2 електронів, так як є вільні орбіталі Р, d, ƒ, таким чином манган має 7 неспарених електронів на 3 –ому та 4-ому рівнях, які він легко може віддати іншим елементам, відновлюючи їх, а сам окислюється до останньої межі:
+7
Наприклад в сполуці КМnО4 де манган має окислювальне число +7.
Схаменувшись, що віддав всі свої неспарені електрони, манган стає
сильним агресором, тобто окислювачем і намагається повернути їх собі.
Наприклад:
-2 +7 +2
5Н2S + 2KMnO4 + 3H2SO4→5Sº+2MnSO4+K2SO4+8H2O;
 +7
+7
Mn + 5е- = Mn+2 2 окислювач
S-2 – 2e- = S0 10 5 відновник
В нейтральному середовищі манган приєднує 3 електрони.
+7 +4 +4 +6
2KMnO4 + 3К2SO3 + 5Н2O→2Mn(OH)4+3К2SO4 + 2КОН
Mn+7 + 3 е- = Mn+4 2 окислювач
S+4 – 2e- = S+6 6 3 відновник
В лужному середовищі манган приєднує лише 1 електрон.
+4 +7 +6 +6
Na2SO3+2KMnO4+2KOH→Na2SO4 + 2К2MnO4 + Н2О;
M n+7 + е- = Mn+6 2 окислювач
S +4 – 2e- = S +6 2 1 відновник
Це дуже важливо знати, тому що є такі задачі, в яких еквівалент KMnO4 треба визначити залежно від середовища, в якому відбувається реакція.
Наприклад:
Задача. ТKMnO4= 0,002980. Знайти нормальну концентрацію розчину для реакцій, в яких перманганат калію перетворюється:
а). в МnO2; б).MnSO4;
Дано:
 ТKMnO4=
0,002980.
ТKMnO4=
0,002980.
Знайти Сn KMnO4 в реакціях:
а) перетворюється на МnO2;
б).перетворюється на МnSO4;
+7 +3е +4
а). KMnO4 → MnO2 +7
процес відновлення, але Mn являється окислювачем.
Знаходимо молярну масу KMnO4 .
М (KMnO4) = 158 г.
Еквівалент окислювача дорівнює молярній масі поділеній на кількість прийнятих електронів.
Екв.
KMnO4
=![]()
