
- •Лекція №14 Естери
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами
- •Ліпіди (жири)
- •Класифікація
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
Лекція №14 Естери
ЕСТЕРИ (СКЛАДНІ ЕФІРИ) – складаються із залишку карбонової кислоти. |
Загальна формула СnH2nO2
– або
![]() ,
де
,
де
![]() залишок
кислоти,
залишок
кислоти,
![]() - залишок спирту.
- залишок спирту.
Номенклатура
Естери можна розглядати як похідні кислот, в яких атом гідрогену заміщений на радикал.
Назву естеру записують одним словом:
• естери, утворені мінеральними кислотами
![]() -
етилнітрАТ
-
етилнітрАТ
• естери, утворені спиртами та карбоновими кислотами
![]() - метилетанОАТ (метилацетат, метиловий
естер оцтової кислоти)
- метилетанОАТ (метилацетат, метиловий
естер оцтової кислоти)
Види ізомерії
Ізомерія карбонового скелету.
С4Н8О2
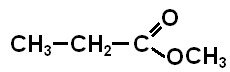
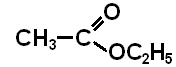
Метилпропаноат
(метиловий естер пропанової кислоти)
Етилпропаноат
(етиловий естер етанової кислоти)
Міжкласова ізомерія (з карбоновими кислотами).
С4Н8О2 |
|
|
|
Метилпропаноат (метиловий естер пропанової кислоти) |
Бутанова кислота
|
Фізичні властивості
Естери нижчих карбонових кислот та спиртів – леткі рідини, мають приємний фруктовий запах, малорозчинні у воді, добре розчинні в органічних розчинниках, легкозаймисті, на повітрі горять з утворенням СО2 і Н2О. Між молекулами естерів відсутній водневий зв'язок.
Наприклад, метилпентаноат має запах вишень, метилетаноат – рому,
етилпентаноат – бананів, бутилетаноат – абрикосів,
бутилбутаноат – ананасів, ізопентилетаноат – яблук.
Естери вищих карбонових кислот та спиртів – високомолекулярні речовини. Наприклад, бджолиний віск складається з мірицилпальмітату С15Н31СООС31Н63.
Поширення в природі. Містяться у квітах, фруктах, ягодах, визначають їх специфічний запах. Бджолиний віск переважно складається із складних ефірів вищих жирних кислот і високомолекулярних одноатомних спиртів.
Одержання
Реакція ЕСТЕРИФІКАЦІЇ – кислота + спирт.
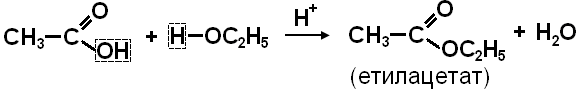
Хімічні властивості
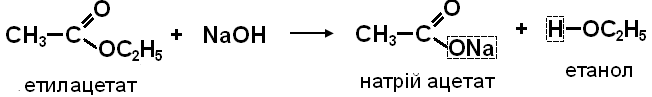
1. ГІДРОЛІЗ (в кислому середовищі) або ОМИЛЕННЯ (в лужному середовищі). Ця реакція є зворотною щодо реакції ЕСТЕРИФІКАЦІЇ.
Гідроліз у кислому середовищі оборотний.
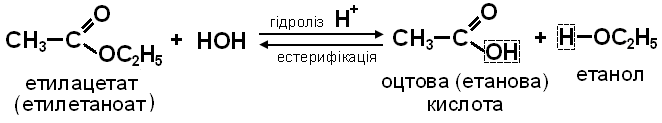
У лужному середовищі утворюється сіль і гідроліз стає необоротним.
2. ГІДРУВАННЯ - взаємодія з воднем:
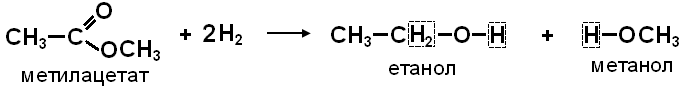
Застосування
1. Як розчинник для лаків і фарб.
2. Для виготовлення штучних фруктових есенцій та ароматизаторів.
3. У виробництві парфумів.
4. У виробництві СМЗ і вибухових речовин.
Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами
Між різними класами органічних сполук існує генетичний зв’язок. Це означає, що із одної органічної сполуки можна отримати іншу і т.д.
Знання взаємних перетворень речовин має величезне практичне значення, оскільки ці перетворення лежать в основі різноманітних синтезів, які можна вести цілеспрямовано, передбачивши продукти реакції і спрямовуючи ці реакції в потрібний бік.
Насичений вуглеводень |
|
Ненасичений вуглеводень |
|
Спирт |
|
Альдегід |
|
Карбонова кислота |
Наприклад,
одержання ненасиченого вуглеводню із насиченого (реакцією дегідрування):
СН3 - СН3 СН2 = СН2 + Н2
одержання спирту із ненасиченого вуглеводню (реакцією гідратації):
СН2 = СН2 + Н2О СН3 – СН2 – ОН
одержання альдегіду при окисненні спирту (реакцією окиснення):
СН3 – СН2
– ОН + СuO ¾t®
![]() + Н2О
+ Cu
+ Н2О
+ Cu
одержання карбонової кислоти окисненням альдегіду (реакцією окиснення):
![]()
При використанні каталізаторів можливі зворотні реакції:
карбонова кислота ¾® спирт ¾® ненасичений вуглеводень ¾® насичений вуглеводень
Насичені вуглеводні можна одержати з допомогою синтезу із неорганічних речовин – вуглецю і водню:
С + 2Н2 ¾t, Ni® CH4
Органічні речовини можна також окиснити до неорганічних речовин – вуглекислого газу та води (СО2 і Н2О). Це означає, що між органічними і неорганічними речовинами також існує генетичний зв’язок.
