
- •Степин б. Д
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Глава 10
- •Глава 11
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 1
- •1.1. Стекло
- •1.2. Керамика, керметы, графит и асбест
- •1.3. Полимерные материалы
- •1.4. Металлы
- •1.5. Материалы для фильтрования
- •1.6. Резина и каучуки (пробки и шланги)
- •1.7. Смазки, замазки и уплотняющие средства
- •1.8. Вода
- •1.9. Ртуть
- •1.10. Монтажные приспособления, крепежные изделия и амортизаторы
- •Глава 2
- •2.1. Химические стаканы, колбы и реторты
- •2.2. Колокола, колпаки, склянки и пробирки
- •2.3. Промывалки, эксикаторы и сосуды Дьюара
- •2.4. Краны, зажимы, клапаны, затворы каплеуловители
- •2.5. Сифоны, переходные трубки, алоюки, шлифы, стеклянные трубки и капилляры
- •2.6. Делительные и капельные воронки, ампулы и бюксы
- •2.7. Холодильники
- •2.8. Ступки, чашки, тигли, лодочки и шпатели
- •2.9. Очистка и сушка химической посуды
- •Глава 3
- •3.1. Технохимические весы
- •3.2. Аналитические весы
- •3.3. Гидростатические весы
- •3.4. Газовые и торзионные (крутильные) весы
- •3.5. Специальные весы
- •3.6. Весовая комната
- •Глава 4
- •4.1. Мерные цилиндры, мензурки и другая мерная посуда
- •4.2. Мерные колбы и пикнометры
- •4.3. Пипетки
- •4.4. Бюретки
- •4.6. Определение плотности жидких и твердых веществ
- •Глава 5
- •5.1. Ртутные термометры
- •5.2. Газовые тензиметрические термометры
- •5.3. Паровые и жидкостные манометрические термометры
- •5.4. Термометры сопротивления
- •5.5. Термисторы
- •5.6. Термопары
- •5.7. Пирометры
- •5.8. Конусы Зегера (керамические пироскопы)
- •5.9. Регулирование температуры
- •5.10. Термостаты
- •5.11. Криостаты
- •Глава 6
- •6.4. Инфракрасные излучатели
- •6.6 Электропечи
- •6.7. Индукционные печи
- •6.8. Высокочастотные диэлектрические нагреватели
- •6.9. Газовые печи
- •6.10. Сушильные шкафы
- •6.11. Средства и приборы для охлаждения
- •6.12. Теплоизоляция
- •Глава 7
- •7.1. Измельчение
- •7.2. Высушивание и прокаливание порошков
- •7.3. Просеивание сухих порошков
- •7.4. Смешивание порошков
- •7.5. Хранение
- •7.6. Возгонка (сублимация) и десублимация
- •7.8. Определение температуры плавления
- •7.9. Измерение степени влажности
- •Глава 8
- •8.2. Перекачивание жидкости
- •8.3. Удаление влаги и растворенных газов из органических жидкостей
- •8.4. Перегонка жидкостей (дистилляция)
- •8.5. Молекулярная перегонка
- •8.6. Элементарная техника жидкостной экстракции
- •8.7. Определение температур кипения жидкостей
- •8.8. Капиллярные вискозиметры
- •8.9. Хранение жидкостей
- •Глава 9
- •9.1. Растворение.
- •9.2. Перемешивание
- •9.3. Выпаривание и концентрирование растворов
- •9.5. Промывание осадков
- •9.6. Кристаллизация веществ из растворов
- •9.7. Кристаллизация вещества из расплава
- •9.8. Выращивание монокристаллов
- •9.9. Экстракция примесей из смеси твердых фаз
- •9.10. Определение молярной массы вещества-неэлектролита
- •Глава10. Эксперименты с газами
- •10.1. Приборы для получения газов
- •10.2. Приборы для реакций газов с твердыми веществами
- •10.3. Очистка и осушка газов
- •10.4. Измерение давления газа
- •2 • 104 Па (150 торр).
- •10.5. Измерение давления пара вещества
- •10.6. Регулирование давления
- •10.7. Измерение расхода газа
- •10.8. Получение вакуума и избыточного давления
- •10.9. Ловушки для конденсации газов
- •10.10. Хранение газов
- •10.11. Измерение плотности и объема газов
- •10.12. Определение влажности газов
- •Глава 11. Электрохимические исследования и синтезы
- •11.2. Химические источники тока и электроды
- •11.3. Измерения водородного показателя
- •11.4. Электролиз
- •11.5. Электрический разряд в газах
- •11.6. Электродиализ
- •Глава 12
- •12.2. Автоклавы
- •12.3. Компрессоры
- •Глава 13
- •13.1. Микрососуды, микропипетки и пластинки
- •13.2. Градуированные микропипетки, микробюретки и микромерные колбы
- •13.3. Нагревание
- •13.4. Перемешивание и измельчение
- •13.5. Растворение, выпаривание и высушивание
- •13.6. Фильтрование
- •13.7. Перегонка и возгонка
- •13.8. Экстракция
- •13.9. Определение температур плавления и кипения
- •13.10. Определение плотности
- •Глава 14
- •14.1. Источники света
- •14.2. Жидкостные, стеклянные и интерференционные светофильтры
- •14.3. Фотохимические реакторы
10.11. Измерение плотности и объема газов
Плотность
газа В(![]() ,
г/л) определяют взвешиванием
,
г/л) определяют взвешиванием ![]() )
небольшой стеклянной колбочки
известного объема с газом (рис. 274,f)
или газового пикнометра (см. рис. 77),
применяя формулу
)
небольшой стеклянной колбочки
известного объема с газом (рис. 274,f)
или газового пикнометра (см. рис. 77),
применяя формулу
![]() =
= ![]() /V
/V
Где V- объем колбочки (5 - 20 мл) или пикнометра.
Колбочку взвешивают дважды: сначала вакуумированную, а затем наполненную исследуемым газом. По разности значений двух полученных масс узнают массу газа , г. При заполнении колбочки газом измеряют его давление (см. разд. 10.4), а при взвешивании - температуру окружающей среды, которую принимают за температуру газа в колбочке. Найденные значения и Т газа дают возможность вычислить плотность газа при нормальных условиях (0 °С; ≈0,1 МПа).
Для уменьшения поправки на потерю массы колбочки с газом в воздухе при ее взвешивании (см. разд. 3.2) в качестве тары на другом плече коромысла весов располагают запаянную колбочку точно, такого же объема. Поверхность этой колбочки обрабатывают (очищают) каждый раз точно так же, как и взвешиваемой с газом.
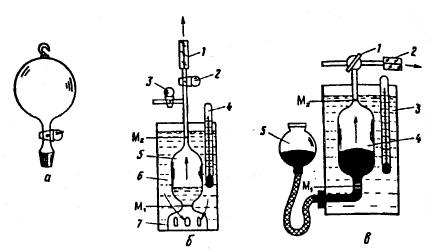
Рис. 274. Приборы для опрелсления плотности газа: колбочка (f) и жидкостной (б) и ртутный (в) эффузиометры
В процессе вакуумирования (см. разд. 10.8) колбочку немного нагревают, оставляя подключенной к вакуумной системе в течение нескольких часов, поскольку остатки воздуха и влаги удаляются с трудом. У вакуумированной колбочки может измениться объем из-за сжатия стенок атмосферным давлением. Погрешность определения плотности легких газов от такого сжатия может достигать 1%. В отдельных случаях для газа определяют и относительную плотность d^, т. е. отношение плотности данного газа рр к плотности другого газа,- выбранного в качестве стандартного ро, взятого при тех же температуре и давлении:
dB = B/0 = MB/M0
где MB и M0 - соответственно молярные массы исследуемого газа В и стандартного, например воздуха или водорода, г/моль.
Для водорода M0 = 2,016 г/моль, поэтому
dB = MB/2,016
Из этого соотношения можно определить молярную массу газа, если принять его за идеальный.
Быстрым методом определения плотности газа является метод измерения продолжительности его истечения из малого отверстия под давлением, которая пропорциональна скорости истечения. Если плотность воздуха стандартного газа в нормальных условиях (0 0С, 0,1 МПа) равна 1,2928 г/л, то
B
= 1.2928![]() /
/![]()
где τB и τ0 - время истечения газа В и воздуха соответственно.
Измерение плотности газа этим методом проводят при помощи эффузиометра (рис. 274,б) - широкого цилиндра 6 высотой около 400 мм, внутри которого находится сосуд 5 с основанием 7, снабженным отверстиями для входа и выхода жидкости. На сосуде 5 нанесены две метки М1 и М2 для отсчета объема газа, время истечения которого наблюдают. Кран 3 служит для впуска газа, а кран 2 - для выпуска через капилляр 1. Термометром 4 контролируют температуру газа.
Определение плотности газа по скорости его истечения выполняют следующим образом. Наполняют цилиндр 6 жидкостью, в которой газ почти нерастворим, чтобы был заполнен и сосуд 5 выше метки М2- Затем через кран 3 жидкость выдавливают из сосуда 5 исследуемым газом ниже метки М1, причем вся жидкость должна остаться в цилиндре. После этого, закрыв кран 3, открывают кран 2 и дают выйти излишку газа через капилляр 1. Как только жидкость достигнет метки М1, включают секундомер. Жидкость, вытесняя газ, постепенно поднимается до метки М2- В момент касания мениска жидкости метки М2 секундомер выключают. Опыт повторяют 2-3 раза. Аналогичные операции проводят и с воздухом, тщательно промыв им сосуд 5 от остатков исследуемого газа. Разные наблюдения длительности истечения газа не должны различаться более чем на 0,2 - 0,3 с.
Если для исследуемого газа .нельзя подобрать жидкость, в которой он был бы малорастворим, применяют ртутный эффузиометр (рис. 274,в). Он состоит из стеклянного сосуда 4 с трехховым краном 1 и уравнительного сосуда 5, наполненного ртутью. Сосуд 4 находится в стеклянном сосуде 3, выполняющем функции термостата. Через кран1 в сосуд 4 вводят газ, вытесняя ртуть ниже метки M1. Выпускают исследуемый газ или воздух через капилляр 2, подняв уравнительный сосуд 5. Более чувствительными приборами для определения плотности газов являются газовый ареометр Штока (рис. 275,а) и газовые весы (см. рис. 71).
Шток Альфред (1876-1946) - немецкий химик-неорганик и аналитик.
В ареометре Штока один конец кварцевой трубки раздут в тонкостенный шар. 1 диаметром 30 - 35 мм, наполненный возком, а другой оттянут в волосок 7 Внутрь трубки плотно давлен небольшой железный стержень 3. Острием 4 трубка с шаром опирается на кварцевую или агатовую опору. Трубка с шаром помешены в кварцевый сосуд 5 с пришлифованной круглой пробкой.

Рис. 275. Ареометр Штока (а) и схема установки (б)
Вне сосуда расположен соленоид 6 с железным сердечников. При помощи тока различной силы, протекающего через соленоид, выравнивают положение коромысла с шаром так, чтобы волосок 7 указывал точно на индикатор нуля 8. За положением волоска наблюдают при помощи зрительной трубы или микроскопа.
Ареометр Штока приваривают к трубке 2 для устранения каких-либо вибраций.
Шар с трубкой находятся в равновесии при данной плотности окружающего их газа. Если в сосуде 5 один газ заменить на другой при постоянном давлении, то равновесие нарушится из-за изменения плотности газа. Для его восстановления необходимо либо притянуть стержень 3 электромагнитом 6 вниз при понижении плотности газа, либо дать ему подняться вверх при увеличении плотности. Сила тока, протекающего через соленоид, при достижении равновесия прямо пропорциональна изменению плотности.
Прибор градуируют по газам известной плотности. Точность ареометра Штока 0,01 - 0,1%, чувствительность порядка 10-7 г, диапазон измерений от 0 до 4 г/л.
 Установка
с ареометром Штока. Ареометр
Штока 1 (рис-275,б) присоединяют к вакуумной
системе так, что он висит на трубке 2
как на пружине. Колено
3 трубки
2 погружено
в сосуд Дьюара 4 с
охлаждающей смесью
(см. разд. 6.11), позволяющей поддерживать
температуру не выше -80 °С для конденсации
пара ртути, если для создания вакуума
в ареометре используют диффузионный
ртутный насос (см. разд. 262,о). Кран 5
соединяет ареометр
с колбой, содержащей иесследуемый газ.
Ловушка (см. разд. 10.9) защищает диффузионный
насос от воздействИ исследуемого газа,
а приспособление 7 служит для точной
регулировки давления (см. разд. 10.6). Вся
система через трубку 8 соединена с
диффузионным насосом.
Установка
с ареометром Штока. Ареометр
Штока 1 (рис-275,б) присоединяют к вакуумной
системе так, что он висит на трубке 2
как на пружине. Колено
3 трубки
2 погружено
в сосуд Дьюара 4 с
охлаждающей смесью
(см. разд. 6.11), позволяющей поддерживать
температуру не выше -80 °С для конденсации
пара ртути, если для создания вакуума
в ареометре используют диффузионный
ртутный насос (см. разд. 262,о). Кран 5
соединяет ареометр
с колбой, содержащей иесследуемый газ.
Ловушка (см. разд. 10.9) защищает диффузионный
насос от воздействИ исследуемого газа,
а приспособление 7 служит для точной
регулировки давления (см. разд. 10.6). Вся
система через трубку 8 соединена с
диффузионным насосом.
Рис 276. Прибор для измерения объема газа
Объем газа измеряют при помощи калиброванных газовых бюреток (см. рис. 84) с термостатируемой водяной рубашкой. Во избежание поправок на капиллярные явления газовую 3 и компенсационную 5 бюретки подбирают одинакового диаметра и располагают в термостатируемой рубашке 4 рядом (рис. 276). В качестве запирающих жидкостей применяют ртуть, глицерин и другие жидкости, плохо растворяющие исследуемый газ.
Оперируют этим прибором следующим образом. Сначала заполняют бюретки жидкостью до уровня выше крана 2, поднимая сосуд 6. Затем газовую бюретку соединяют с источником газа и вводят его, опуская сосуд 6, после чего кран 2 закрывают. Для уравнивания давления газа, находящегося в бюретке 3, с атмосферным давлением сосуд 6 подносят вплотную к бюретке и устанавливают на такой высоте, чтобы мениски ртути в компенсационной 5 и газовой 3 бюретках были на одном уровне. Поскольку компенсационная бюретка сообщается с атмосферой (ее верхний конец открыт), при таком положении менисков давление газа в газовой бюретке будет равно атмосферному.
Одновременно измеряют атмосферное давление по барометру (см. разд. 10.4) и температуру воды в рубашке 4 при помощи термометра 1.
Найденный объем газа приводят к нормальным условиям (О °С; 0,1 МПа), используя уравнение для идеального газа:
V0 = 273,16Vp/760(273,16 + τ) = Vp [0,3594/(273,16 + τ)],
где V0 и V - приведенный к нормальным условиям объем (л) газа и измеренный объем газа при температуре t (°С) соответственно; р - атмосферное давление в момент измерения объема газа, торр.
Если газ содержит пары воды или находился перед измерением объема в сосуде над водой или водным раствором, то его обьем приводят к нормальным условиям с учетом давления пара воды р1, при температуре опыта (см. табл. 37):
V0 = 273,16 V(p-p1)/760(273,16 + t) = V(p-p1)[0,3594/(273,16+t].
Уравнения применяют в том случае, если атмосферное давление при измерении объема газа было сравнительно близко к 760 торр. Давление реального газа всегда меньше, чем у идеального, из-за взаимодействия молекул. Поэтому в найденное значение объёма газа вводят поправку на неидеальность газа, взятую из специальных справочников.
