
- •17. Энергия Гиббса (изобарно- изотермический потенциал ), стандартное значение энергии Гиббса.
- •Вопрос 26
- •Вопрос 28
- •37. Распространение элементов в земной коре и организмах. Биогенные элементы. Классификация элементов.
- •38.Общая характеристика элементов 7 группы.
- •39.Галогены. Физические и химические свойства. Биологическая роль.
- •40. Сравнительная характеристика водородных соединений галогенов.
- •41.Кислородные соединения галогенов.
- •42. Общая характеристика 6 группы.
- •43.Халькогены. Физические и химические свойства. Биологическая роль.
- •44.Сравнительная характеристика водородных соединений халькогенов.
- •45. Кислородные соединения халькогенов. Серная кислота, ее свойства.
- •46. Общая характеристика элементов 5 группы. Биологическая роль.
- •47. Водородные соединения элементов 5 группы. Аммиак . Строение молекулы.
- •Соединения железа (II)
- •Соединения железа (III)
- •Соединения железа (VI)
- •Биологическое значение железа
- •61. Марганец. Распространение в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации.
- •Биологическая роль и физиологическое действие
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Бактерицидность
- •64. Цинк. Распространение в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации.
- •21.Способы выражения концентрации веществ
- •23.Факторы, влияющие на скорость хим. Реакции. Законы действия масс.
- •27.Автопротолиз воды, pH, кислотно-основные сопряженные пары.
46. Общая характеристика элементов 5 группы. Биологическая роль.
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2s22p3; P – 3s23p3; As – 4s24p3; Sb – 5s25p3; Bi – 6s26p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5, которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
47. Водородные соединения элементов 5 группы. Аммиак . Строение молекулы.
Физические и химические свойства. Соли аммония.
Аммиак
Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3 ? Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
Химические свойства:
1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4;
3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О;
4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2? + 6Н2О;
5) кислородом воздуха NH3 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4NH3 + 5О2 = 4NО? + 6Н2О;
6) при замещении водорода на металлы образуются амиды: Na + NH3 = NaNH2 + 1/2 Н2;
7) водород в NH3 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промышленности до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или фиксации атмосферного азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
Соли аммония
Соли аммония – сложные вещества, включающие катионы аммония NH4+и кислотные остатки.
Физические свойства: соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства: аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди:
Соли аммония имеют ионную решетку и обладают всеми свойствами типичных солей:
1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:
2) подвергаются гидролизу (соль слабого основания и сильной кислоты):
среда кислая, рН<7, лакмус красный;
3) вступают в обменную реакцию с кислотами и солями:
4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса;
5) разлагаются при нагревании:
Получение: NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O.
Применение: соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь.
Строение молекулы аммиака

Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
48. Оксиды и кислоты азота. Свойства концентрированной и разбавленной азотной кислоты. Термическое разложение нитратов. Оксиды азота. В оксидах азота степень его окисления меняется от 1+ до 5+. Оксиды N2O и NO—- бесцветные газы, оксид азота (IV) NO2 — бурый газ, получивший в промышленности название “лисий хвост”. Оксид азота (III) N2O3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.
Оксиды N2O и NO не реагируют c водой и щелочами, тогда как N2O3 и N2O5, являясь ангидридами, при взаимодействии с водой дают соответствующие кислоты:
![]()
Азотистая кислота. HNO2 неустойчива, тогда как ее соли нитриты, устойчивы.
Оксид азота (IV) NO2 легко подвергается димеризации, уже при незначительном охлаждении образуя жидкость желто-зеленого цвета:
![]()
Оксид азота NO2 при растворении в воде обратимо диспропорционирует:
![]()
Поскольку образующаяся азотистая кислота неустойчива, то при нагревании реакция идет по-другому:
![]()
Если диоксид азота NO2 растворяют в воде в присутствии кислорода, то получают только азотную кислоту:
![]()
Последнюю реакцию используют в промышленности для получения азотной кислоты.
Азотная кислота. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Химические свойства. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:
![]()
Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NO3- , имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ:

Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее HNO3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NO2; если HNO3разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.
Чтобы восстановление HNO3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.
Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NO2):

Азотная кислота окисляет при нагревании даже кремний:
![]()
Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.
Если же взять смесь азотной и плавиковой кислот, то при нагревании происходит полное растворение образца кремния:
![]()
С помощью концентрированной HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
![]()
Действие царской водки объясняется тем, что концентрированная HNO3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.
Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород, например:
![]()
Вторую группу составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла,NO2 и кислород:

Третью группу составляют нитраты наиболее тяжелых металлов, разлагающиеся до свободного металла, NO2 и кислорода:
![]()
Четвертую группу составляет нитрат аммония.
![]()
Азотистая кислота. HNО2 принадлежит к слабым кислотам (К = 610-4 при 25 °С), она лишь немного сильнее уксусной. Азотистая кислота неустойчива и известна только в разбавленных растворах, в которых осуществляется равновесие
![]()
Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду:
![]()
Применение. Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
49. Общая характеристика элементов 4 группы. Подгруппа титана — химические элементы 4-й группы периодической таблицы химических элементов (поустаревшей классификации — элементы побочной подгруппы IV группы)[1]. По номенклатуре ИЮПАКподгруппа титана содержит в себетитан, цирконий, гафний и резерфордий.
Первые три элемента данной подгруппы находятся в природе в заметных количествах. Они относятся ктугоплавким металлам. Последний представитель — резерфордий —радиоактивный элемент. У него нет стабильных изотопов. Его физические и химические свойства не изучены.
]Химические свойства
22 |
Титан |
Ti 47,867 |
|
3d24s2 |
|
40 |
Цирконий |
Zr 91,224 |
|
4d25s2 |
|
72 |
Гафний |
Hf 178,49 |
|
4f145d26s2 |
|
104 |
Резерфордий |
Rf 261 |
|
5f146d27s2 |
|
|
Большинство химических свойств было изучено только для первых трех элементов данной подгруппы. Химия резерфордия еще не изучена для того, что бы утверждать, что он в целом похож на элементы этой подгруппы. При воздействии кислорода происходит образованиеоксидной пленки на поверхности металла. Диоксид титана, диоксид циркония и диоксид гафнияявляются твёрдыми кристаллическими веществами с высокой температурой плавления и инертностью по отношению к кислотам[2].
Как четырехвалентные элементы образуют различные неорганические соединения, как правило встепени окисления +4. Были получены данные, говорящие об их устойчивости к щелочам. С галогенами образуют соответствующие тетрагалогениды с общей формулой MHal4 (где М: Ti, Zr и Hf). При более высоких температурах реагируют с кислородом, азотом, углеродом, бором, кремнием и серой. Вероятно из-за лантаноидного сжатия, гафний и цирконий имеют практически одинаковые ионные радиусы. Ионный радиус Zr+4 составляет 79 пм, а Hf+4 78 пм[2][3].
Сходство ионных радиусов приводит к образованию схожих по своим свойствам химических соединений[3]. Химия гафния настолько схожа с химией циркония, что их можно различить лишь по физическим свойствам. Основными различиями между двумя элементами следует считать температуру плавления и кипения и растворимость в растворителях[2].
Физические свойства
Свойства элементов 4-ой группы |
||||
Наименование |
Титан |
Цирконий |
Гафний |
Резерфордий |
Температура плавления |
1941 K (1668 °C) |
2130 K (1857 °C) |
2506 K (2233 °C) |
? |
Температура кипения |
3560 K (3287 °C) |
4682 K (4409 °C) |
4876 K (4603 °C) |
? |
Плотность |
4,507 г·см−3 |
6,511 г·см−3 |
13,31 г·см−3 |
? |
Цвет |
серебристо-металлический |
серебристо-белый |
серебристо-серый |
? |
Атомный радиус |
140 пм |
155 пм |
155 пм |
? |
Получение
Производство данных металлов трудно в связи с их реакционной способностью. Образование нитридов, карбидов и оксидов не позволяет получать годные к применению металлы. Этого можно избежать, применяя процесс Кролла (англ.). Оксиды (MO2) реагируют с углем и хлором, образуя тетрахлориды металлов (MCl4). Затем соли реагируют с магнием, в результате чего получаются очищенные металлы и хлорид магния:
MO2 + C(кокс) + Cl2 → MCl4 + 2Mg → M + 2MgCl2
Дальнейшая очистка получается химическим переносом (англ.). В закрытой камере металл реагирует с иодом при температуре 500 °C, образуя иодид металла. Затем на вольфрамовой нитисоль разогревается до 2000 °C для расщепления вещества на металл и иод[2][9]:
![]()
![]()
Нахождение в природе
Нахождение в природе элементов данной группы уменьшается с увеличением атомной массы. Титан является седьмым по распространению элементов на Земле. Его распространенность примерно равна 6320 частей на миллион, в то время как у циркония 162, а у гафния всего 3[10].
Минералами титана являются анатаз и рутил, циркония — циркон, гафний может находится в незначительном количестве в цирконе. Самыми большими странами-добытчиками являются Австралия, Северная Африка и Канада[11][12][13][14].
В организмах
Элементы данной группы не участвуют в биохимических процессах живых организмов[15]. Химические соединения с этими элементами в большинстве случаев нерастворимы. Титан является одним из немногих d-элементов с неясной биологической ролью в организме. Радиоактивность резерфордия делает его токсичным для живых организмов.
Применение
Титан и его сплавы находят свое применение там, где требуются коррозионная стойкость, тугоплавкость и легкость материала. Гафний и цирконий применяются в ядерных реакторах. Гафний имеет высокое сечение захвата тепловых нейтронов, в то время как цирконий — наоборот. Из-за этого свойства цирконий в виде сплавов применяется в качестве облицовки ядерных стержней (ТВЭЛ) в ядерных реакторах[16], в то время как гафний применяется вуправляющих стержнях ядерного реактора[17][18].
Малые количества гафния[19] и циркония применяются в сплавах обоих элементов для улучшения их свойств[20].
Опасность применения
Титан не является токсичным в любых для человеческого организма дозах[15]. Мелкодисперсный цирконий вызывает раздражение при попадании на кожу, при попадании в глаза может потребоваться медицинская помощь[21]. В США ПДК циркония в рабочих помещениях составляет 5 мг/м³, а короткосрочное содержание не более 10 мг/м³[22]. О токсикологических свойствах гафния известно немного[23]. Подгру́ппа углеро́да — химические элементы 14-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы IV группы)[1]. В группу входят углерод С, кремний Si, германий Ge, олово Sn исвинец Pb[2]. В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева.Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств. Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так

В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали,то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками). В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной.Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Степень окисления -4 в последовательности C – Pb становится все менее характерной. Свойства элементов подгруппы углерода
Свойства |
С |
Si |
Ge |
Sn |
Pb |
1. Порядковый номер |
6 |
14 |
32 |
50 |
82 |
2. Валентные электроны |
2s22p2 |
3s23р2 |
4s24р2 |
5s25р2 |
6s26р2 |
3. Энергия ионизации атома, эВ |
11,3 |
8,2 |
7,9 |
7,3 |
7,4 |
4. Относительная электроотрицательность |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
5. Степень окисления в соединениях |
+4, +2, -4 |
+4, +2, -4 |
+4, -4 |
+4, +2, -4 |
+4, +2, -4 |
6. Радиус атома, нм |
0,077 |
0,134 |
0,139 |
0,158 |
0,175 |
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения - формулы RН4.Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RН4: СН4 - прочное вещество, а PbH4в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус, т. е.неметаллические свойства ослабевают, а металлические усиливаются. Химические свойства углерода и кремния. Графит и кремний — типичные восстановители . При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен)и кремний образуют диоксиды: С + О2 = СО2, Si + О2 = SiO2, при недостатке кислорода можно получить монооксиды CO или SiO: 2С + О2 = 2СО, 2Si + O2 = 2SiO, которые образуются также при нагревании простых веществ с их диоксидами: С + СО2 = 2СО, Si + SiO2 = 2SiO. Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором, давая СCl4 и SiCl4.При более сильном нагревании углерод и кремний реагируют с серой и азотом: 4С + S8 = 4СS2, 2С + N2 = С2N2, 4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу: Si + С = SiC. Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод: С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О, 3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: 3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О. Кроме того, кремний растворяется в водных растворах щелочей: Si + 2NaОН + Н2О = Na2SiO3 + Н2↑. Графит часто используют для восстановления малоактивных металлов из их оксидов: СuО + С = Сu + СО↑. При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды СаО + 3С = СаС2 + СО↑, 2Аl2О3 + 9С = Аl4С3 + 6СО↑ или силициды 2МgО + 3Si = Мg2Si + 2SiO. Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей Са + 2С = СаС2, 2Mg + Si = Мg2Si. Оксид углерода (II) и оксид кремния (II)
Оба оксида получают неполным окислением простых веществ или по реакциям: С + СО2 = 2СО, Si + SiO2 = 2SiO. Они оба не реагируют при обычных условиях ни с кислотами, ни со щелочами. Оксид кремния (II) мало доступен и очень редко используется, в отличие от угарного газа СО, на свойствах которого мы остановимся ниже.
Оксид углерода (II) – ядовитый газ без цвета и запаха, горит голубоватым пламенем, легче воздуха, температура кипения 81,63 К, температура плавления 68,03 К, плохо растворим в воде (2,3 объема СО на 100 объемов H2O при 293 К).
Оксид СО принято считать несолеобразующим, однако при пропускании его в расплав щелочи при высоком давлении непосредственно образуется соль в результате протекания окислительно-восстановительной реакции:
СО + КОН = НСООК.
Отсюда формально можно считать СО ангидридом муравьиной кислоты, что подтверждается обезвоживанием муравьиной кислоты:
![]() (*)
(*)
Следует, однако, обратить внимание, что в рассмотренных выше реакциях меняется степень окисления углерода +4 в муравьиной кислоте и в ее соли и +2 - в оксиде углерода(II) и эти реакции являются фактически окислительно-восстановительными. В то время как в реакциях соединения, характерных для "классических" солеобразующих оксидов, степень окисления элементов никогда не меняется, например:
СаО + СО2 = СаСО3.
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
![]()
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
На воздухе СО горит голубоватым пламенем:
2СО + O2 = 2СO2 .
При нагревании он восстанавливает металлы из их оксидов:
FеО + СО = Fе + СО2↑.
В присутствии катализатора или под действием облучения СО окисляется хлором, образуя ядовитый газ фосген:
СО + Сl2 = СОСl2.
При взаимодействии с парами воды идет обратимая реакция с образованием СО2 и водорода:
СО
+ Н2О ![]() СО2 + Н2,
СО2 + Н2,
при нагревании с водородом при повышенном давлении образуется метиловый спирт:
СО + 2Н2 СН3ОН.
Со многими металлами СО образует летучие карбонилы:
Ni + 4СО = Ni(СО)4 .
В природе оксид углерода (II) практически не встречается. В лаборатории его обычно получают обезвоживанием муравьиной кислоты по реакции (*).
Оксид углерода (II) может быть также получен при восстановлении оксида углерода (IV) углеродом или металлами:
![]()
Оксид углерода (IV), Угольная кислота и ее соли
Оксид углерода (IV) (диоксид углерода, углекислый газ) - газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха. Он растворим в воде (88 объемов СО2 в 100 объемах Н2О при 20°С). При обычных давлениях твердый диоксид углерода переходит в газообразное состояние (сублимируется), минуя жидкое состояние. При обычной температуре под давлением 60 атм переходит в жидкость.
При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации в воздухе до 3% у человека наблюдается учащенное дыхание, более 10% - потеря сознания и даже смерть.
Оксид углерода (IV) является ангидридом угольной кислоты Н2СО3 и обладает всеми свойствами кислотных оксидов.
При растворении СО2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:
![]()
Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой (K1 = 4∙10-7, К2 = 5∙10-11 при 25 °С). Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли -карбонаты и кислые - гидрокарбонаты. Качественная реакция на эти соли - действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
СО32-+ 2Н+ Н2СО3 Н2О + СО2↑,
НСО3- + Н+ Н2СО3 Н2О + СО2↑.
При пропускании выделяющегося СО2 в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
СаСО3 |
+ |
H2O |
+ |
CO2 |
= |
Са(НСО3)2 |
взвесь в воде |
|
|
избыток |
|
|
|
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду:
2NаНСО3 = Nа2СО3 + Н2О + СО2↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
МgСО3 = МgО + СО2↑.
Из солей угольной кислоты наибольшее практическое значение имеет сода; известны различные кристаллогидраты соды Nа2СО3∙10Н2О, Nа2СО3.7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называют кристаллической содой. При прокаливании получают безводную, иликальцинированную соду Nа2СО3. Широко используется также питьевая сода NаНСО3. Из других солей важное значение имеют К2СО3 и СаСО3.
Основные количества соды получают получают по аммиачному способу, часто его называют также методом Сольвэ.
Суть метода заключается в насыщении концентрированного раствора поваренной соли (точнее, насыщенного раствора NаСl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NН3 + СО2 + Н2О = NН4НСО3,
NН4НСО3 + NаСl = NаНСО3↓ + NН4Сl.
Питьевая сода NaНСО3 - нерастворима в холодном насыщенном растворе и ее отделяют фильтрованием. При прокаливании NаНСО3 получают кальцинированную соду; выделяющийся при этом СО2 вновь используют в производстве:
2NаНСО3 = Na2СО3 + СО3 + Н2О.
Нагревая раствор, содержащий хлорид аммония с известью, выделяют обратно аммиак:
2NН4Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2О.
Таким образом, при аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО3 нельзя получить по методу Сольвэ, так как он основан на малой растворимости кислой соли NаНСO3 в насыщенном растворе, тогда как КНСО3 (в отличие отNаНСО3) хорошо растворим в таких растворах. Реакция
КСl + NН4НСО3 КНСО3 + NН4Сl
будет полностью обратимой (ни один из продуктов не удается выделить из сферы реакции в индивидуальном виде). Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
КОН + СО2 = КНСО3,
КНСО3 + КОН = К2СО3 + Н2О.
Производство соды является одним из крупнейших среди производств неорганических веществ; в настоящее время ее мировое производство составляет десятки млн. тонн.
Оксид кремния SiO2 - твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита.
При обычных температурах устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения:
![]()
Кремнезем всех модификаций в виде мономера не существует; он всегда полимерен и «построен» из тетраэдров [SiO4], образующих очень прочную атомную решетку
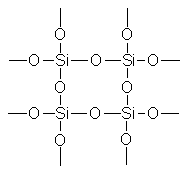
Каждый атом кремния в кристаллах (SiO2)n тетраэдрически окружен четырьмя атомами кислорода, каждый из которых является мостиковым. Через общий атом кислорода тетраэдры [SiO4] под разными углами связываются друг с другом, образуя непрерывную трехмерную решетку; взаимное расположение тетраэдров [SiO4] в пространстве определяет ту или иную модификацию кремнезема.
В различных модификациях кремнезема прочность связей неодинакова. Это влияет на величину углов Si-О-Si и расстояний Si-О, например угол связи Si-О-Si в различных модификациях кремнезема изменяется от 120 до 180°. Переходы кварц-тридимит-кристобалит сопровождаются разрывом и преобразованием связей, что может происходить только при высоких температурах.
Кварц. Нередко встречается в природе в форме чрезвычайно хорошо образованных кристаллов, иногда значительной величины. Кристаллы образованы из тетраэдров, расположенных винтообразно вокруг центральной оси, в виде спирали. В одном и том же кристалле направление спирали может быть противоположным. Такие кристаллы являются оптическими изомерами. Они вращают плоскость поляризации света, причем могут быть как право-, так и левовращающими. Те и другие кристаллы отличаются как предмет от своего зеркального изображения.
Кварц используется в различных областях науки и техники, и его кристаллы часто выращиваются искусственно. Некоторые разновидности кварца носят особые названия. Прозрачные бесцветные кристаллы называют горным хрусталем. Встречаются и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист), темно-коричневый (дымчатый топаз), зеленый (хризопраз) и др. Мелкокристаллическая модификация кварца с примесями других веществ называется халцедоном. Разновидностями халцедона являются агат, яшма и др. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Тридимит встречается в вулканических породах, однако в очень небольших количествах. Известен тридимит и метеоритного происхождения. Кристобалит в природе иногда встречается в виде мелких кристаллов, включенных в лаву, подобно тридимиту. Тридимит и кристобалит обладают более «рыхлой» структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца равна 2,32; 2,26 и 2,65 г/см3 соответственно. Расплав кремнезема при медленном охлаждении легко образует аморфное кварцевое стекло. Кремнезем в виде стекла встречается и в природе. Плотность аморфного стекла равна 2,20 г/см3 - ниже, чем у всех кристаллических модификаций. Кварцевое стекло имеет незначительный температурный коэффициент расширения, поэтому из него готовят лабораторную посуду, устойчивую к резким изменениям температуры. Все модификации кремнезема в воде практически нерастворимы (при температуре 25 °С растворимость кварца составляет 7, кристобалита - 12, тридимита - 16, кварцевого стекла - 83 мг/л). Поэтому при обычных условиях на них действуют лишь растворы щелочей и плавиковая кислота: SiO2 + 2КОН = К2SiO3 + Н2О, (1) SiO2 + 4НF = SiF4↑ + 2Н2О. (2) Последняя реакция используется при «травлении» стекла. Приставленый диоксид кремния реагирует с основными оксидами, щелочами (реакция (1)) и карбонатами с образованием силикатов: SiO2 + СаО = СaSiO3, (3) SiO2 + Na2СО3 = Nа2SiO3 + СО2. (4) Реакции (3) и (4) лежат в основе промышленного получения различных стекол, а также цемента. Так, состав обычного стекла (например, оконного, для изготовления посуды) выражается формулой Na2О.СаО.6SiO2. Такое стекло получают сплавлением смеси соды, песка и известняка. Процесс проводят при температуре ~1400 °С до полного удаления газов:Na2СО3 + СаСО3 + 6SiO2 = Nа2О.СаО.6SiO2 + 2СО2↑. Для получения специальных сортов стекла - огнеупорного, «небьющегося» - при варке добавляют оксиды бария, свинца, бора. Для получения цветных стекол вносят также различные добавки, например добавка оксида кобальта Со2О3 дает синий цвет, оксида хрома Сr2О3 - зеленый, двуоксида марганца МnО2 - розовый. Оксид SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой хSiO2∙yН2O, где х и у - целые числа: 1) х = 1, у = 1: SiO2.Н2О, т.е. Н2SiO3 - метакремниевая кислота; 1) х = 1, y = 2: SiO2.2Н2О, т.е. ортокремниевая кислота; 1) x = 2, у = 1: 2SiO2.Н2О, т.е. Н2Si2O5 – двуметакремниевая кислота. Кислоты, молекулы которых содержат более одной молекулы SiO2, относятся к поликремниевым. Самая простая из кремниевых кислот - Н2SiO3, которую часто называют просто кремниевой, а ее соли - силикатами. Из силикатов в воде растворимы только силикаты натрия и калия, остальные силикаты - тугоплавкие, нерастворимые в воде вещества. Растворы силикатов мутнеют при стоянии на воздухе, так как находящийся в нем СО2 вытесняет кремниевую кислоту из ее солей (Н2SiO3 слабее угольной кислоты; константа диссоциации Н2SiO3 по первой ступени равна К1 = 2,2.10-10). Н2SiO3 практически нерастворима в воде - это свойство используют как качественную реакцию для обнаружения силикат-ионов: Na2SiO3 + СО2 + Н2О = Nа2СО3 + Н2SiO3↓. Получают силикаты сплавлением SiO2 со щелочами или карбонатами. Концентрированные растворы силикатов натрия и калия называют жидким стеклом, они имеют сильнощелочную реакцию вследствии того, что сильно гидролизованы: К2SiO3 + Н2О 2КОН + Н2SiO3↓.
Жидкое стекло используют, например, для изготовления клея, водонепроницаемых тканей. Цемент очень широко используется в строительстве как вяжущий материал, который при смешивании с водой затвердевает. Обычно цемент получают в больших вращающихся печах, где производят обжиг и размол различных силикатов (при температуре -1000 °С). Различают несколько типов цементов, однако условно можно выделить два типа цементов по принципу их «свертывания» - обычный цемент и портландский цемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция за счет углекислого газа воздуха: СаО.SiO2 + СО2 + Н2О = СаСО3↓ + Н2SiO3↓. При схватывании портландского цемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов: Са3SiO5 + Н2О = Са2SiO4 + Са(ОН)2, Са2SiO4 + 4Н2О = Са2SiO4.4Н2O↓.58. Щелочные металлы. Распространенность в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации.Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы)[1]: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
![]()
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрывгораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
![]()
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
![]()
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
![]()
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
![]()
![]()
![]()
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
![]()
![]()
![]()
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
![]()
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
![]()
![]()
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов,фосфидов, карбидов и силицидов:
![]()
![]()
![]()
![]()
![]()
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
![]()
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
![]()
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
![]()
![]()
В природе встречаются только соединения щелочных металлов. Натрий и калий являются постоянными составными частями многих силикатов. Из отдельных минералов натрия важнейший — поваренная соль (NaCl) входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи каменной соли (Соликамск, Артемьевск, Илецк и т. д.). Верхние слои подобных залежей иногда содержат скопления солей калия в виде пластов сильвинита (mKCl·nNaCl), карналита (KCl·MgCl2·6H2O) и др., служащие основным источником получения соединений этого элемента. Имеющих промышленное значение природных скоплений калийных солей известно лишь немного. Важнейшее из них является Соликамское месторождение. Природные залежи легкорастворимых солей на территории России образовались в результате постепенного усыхания внутренних морей, покрывавших в минувшие эпохи большую часть Европы и Западной Сибири. По запасам калия Соликамское месторождение превосходит все месторождения других стран мира, вместе взятые. Среднее содержание калия (по общепринятому расчёту на К2О) в сильвинитных пластах составляет около 15 %, в карналитовых — около 12 %. В составляющих продолжение Соликамских мощных соляных залежей Березниковского района попадаются пласты сильвинита с содержанием до 35 % К2О, а калийные месторождения южного Урала характеризуются значительным содержанием сернокислых солей (минералы каинит — KCl·MgSO4·3H2O, полигалит — K2SO4·MgSO4·2CaSO4·2H2O и др).
В противоположность калийным залежам природные источники получения солей натрия (моря, солёные озёра, каменная соль) имеются во многих странах. Мировой океан содержит 4·1015 т NaCl (а из каждой тысячи тонн морской воды практически получается около 1,3 т соли). Интересна громадная мощность некоторых месторождений каменной соли. Так, в Илецке ее непрерывный пласт разведан на глубину в полтора километра, причем никаких признаков приближения его нижней границы обнаружено не было.
Каменная соль непроницаема для не растворяющих ее жидкостей и сжатых газов. Пробурив отверстие в толщу ее месторождения и размыв (путем нагнетания воды и откачки раствора) достаточно большой свободный объём, можно затем использовать его в качестве подземного хранилища газа, нефти и т. д.
Следы NaCl (от 10-8 до 10-5 г/л) постоянно содержатся в атмосфере. Они попадают туда при испарении брызг морской воды. Было вычислено, что только с поверхности моря в атмосферу поступает несколько тысяч тонн соли за сутки. У 30 % взятых на высоте 1500 м облачных капель с радиусом > 5 мк ядра (с массой 10-1210-13 г) оказались состоящими в основном из NaCl. Частицы соли были обнаружены также в кристаллах снега.
Для лития известен ряд минералов, но скопления их редки. Рубидий и цезий встречается почти исключительно в виде примесей к калию. Следы франция всегда содержатся в урановых рудах.
Натрий у животных сосредоточен преимущественно в тканевых соках (лимфе крови), а калий — в самих тканях. Особенно богаты калием некоторые внутренние органы — печень, селезёнка и др. В целом взрослые животные организмы содержат обычно несколько больше калия, чем натрия (по массе). Напротив, в зародышах животных натрия гораздо больше, чем калия, причем соотношение между обоими элементами приближается к характерному для морской воды. Это можно рассматривать как непосредственное доказательство происхождения наземных животных из морских организмов.
В организме взрослого человека имеется приблизительно 5 л крови, которая содержит около 0,6 % NaCl. Ежедневное выделение хлористого натрия с мочой составляет обычно около 15 г. Он выделяется из организма также с потом (который содержит около 0,5 % NaCl). При усиленном потоотделении (в горячих цехах и т. д.) для утоления жажды рекомендуется газированная воды, содержащая 0,5 % NaCl. Напротив, при гипертонии (повышенном кровяном давлении) рекомендуется ограничивать потребление поваренной соли.
Опытами на собаках было установлено, что при перегреве организма естественное равновесие между Na• и K• нарушается и возникает “калиевый голод”. Это указывает на целесообразность подсаливая потребляемой при усиленном потоотделении воды не просто поваренной солью, а смесью NaCl и KСl (вероятно, в соотношении около 10:1).
59. общая характеристика d-элементов Понятие переходный элемент обычно используется в упрощенном смысле для обозначения любого из d- или f-элементов. Эти элементы действительно занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. Согласно более строгому определению, переходными называются элементы с валентными d- или f-электронами. d-элементы называют главными переходными элементами. Они характеризуются внутренней застройкой d-орбиталей, так как s-орбиталь их внешней оболочки заполнена уже до заполнения d-орбитали. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Здесь следует отметить две аномалии: хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра). Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы). Физические свойства. d-элементы в целом характеризуются высокими температурами плавления и кипения. Их твердость и высокие температуры плавления и кипения объясняются прочными металлическими связями в этих элементах. Наличие прочной металлической связи обусловлено способностью d-элементов поставлять на образование связи электроны не только из внешней, но и из предшествующей ей внутренней подоболочки. Например, металлы первого переходного ряда используют для образования связей одновременно 3d- и 4s-электроны.
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду. d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Металлы с заполненной s-оболочкой обладают меньшей электропроводностью. Например, медь, серебро золото, обладающие внешней электронной конфигурацией d10s1, проводят электрический ток лучше, чем цинк, кадмий и ртуть, обладающие конфигурацией d10s2. Хром, молибден и вольфрам, имеющие конфигурацию d5s1, характеризуются более высокой электропроводностью по сравнению с марганцем, технецием и рением, имеющим конфигурацию d5s2.
Химические свойства
Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям. Стандартные окислительно-восстановительные потенциалы всех металлов первого переходного ряда за исключением меди (и серебра во втором переходном ряду) в системах М2+/М отрицательны. Согласно этим отрицательным значениям, металлы первого переходного ряда должны располагаться в электрохимическом ряду напряжений выше водорода. Поэтому они должны вытеснять водород из минеральных кислот и образовывать водные растворы, содержащие ионы этих металлов. Однако некоторые из них реагируют с кислотами медленно, потому что на поверхности металла образуется защитный слой оксида. Это объясняет пассивность таких металлов, как хром, в коррозионных средах.
60. Железо. Распространение в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации. Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символомFe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место послеалюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец,никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si,Al[2]). Считается так же, что железо составляет бо́льшую часть земного ядра.
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениямиэлектроотрицательности.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
