
- •17. Энергия Гиббса (изобарно- изотермический потенциал ), стандартное значение энергии Гиббса.
- •Вопрос 26
- •Вопрос 28
- •37. Распространение элементов в земной коре и организмах. Биогенные элементы. Классификация элементов.
- •38.Общая характеристика элементов 7 группы.
- •39.Галогены. Физические и химические свойства. Биологическая роль.
- •40. Сравнительная характеристика водородных соединений галогенов.
- •41.Кислородные соединения галогенов.
- •42. Общая характеристика 6 группы.
- •43.Халькогены. Физические и химические свойства. Биологическая роль.
- •44.Сравнительная характеристика водородных соединений халькогенов.
- •45. Кислородные соединения халькогенов. Серная кислота, ее свойства.
- •46. Общая характеристика элементов 5 группы. Биологическая роль.
- •47. Водородные соединения элементов 5 группы. Аммиак . Строение молекулы.
- •Соединения железа (II)
- •Соединения железа (III)
- •Соединения железа (VI)
- •Биологическое значение железа
- •61. Марганец. Распространение в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации.
- •Биологическая роль и физиологическое действие
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Бактерицидность
- •64. Цинк. Распространение в природе. Физические и химические свойства. Биологическая роль. Применение в медицине и фармации.
- •21.Способы выражения концентрации веществ
- •23.Факторы, влияющие на скорость хим. Реакции. Законы действия масс.
- •27.Автопротолиз воды, pH, кислотно-основные сопряженные пары.
1.Основные понятия химии-атом , молекула, вещество. Относительная атомная и молекулярная масса. Моль. Молекулярная масса. Атом-частица вещества, состоящая из положительно заряженных частиц и отрицательно заряженных электронов. Молекула-наименьшая частичка вещества, обладающая его химическими св-вами. Моль- такое количество вещ-ва, которое содержит столько атомов, сколько содержится в 12г изотопа углерода 12(Nавагадро=6.02*10^23 1/моль). ВЕЩЕСТВО- вид материи, к-рая обладает массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. АТОМНАЯ МАССА- относит. значение массы атома, выраженное в атомных единицах массы. АТОМНАЯ ЕДИНИЦА МАССЫ (а.е.м.), равна 1/12 массы нуклида 12С; 1 а.е.м. = (1,6605655 ±0,0000086)*10-27 кг. МОЛЕКУЛЯРНАЯ МАССА, сумма масс атомов, входящих в состав данной молекулы; Относительная молекулярная масса - отношение средней массы молекулы вещества к 1/12 массы атома углерода-12. Молярная масса вещества (M) - масса одного моля этого вещества. По величине она равна относительной молекулярной массе Mr (для веществ атомного строения - относительной атомной массе Ar).
2. Основные классы химических соединений и связь между ними. Оксиды - это бинарные соединения, содержащие кислород в степени окисления минус 2. Оксиды делятся на кислотные(образованные атомами неМе),основными(Ме)и амфотерными. По растворимости:1)растворимые (щел,щел-зем Ме, кислотные) 2)нерастворимые(оксиды d- элементов) По способности образовывать к-ты или основания :1)солеобразующее оксиды 2)несолеобразующие(безразличные) Способы получения: 1)окисление простых в-в 2Cu+O2=2CuO (спонтан) S+O2=SO2(горение) 2)Горение сложных в-в C2H5OH+O2=2CO2+3H2O 3)Термическое разложение солей CaCO3=(t)CaO+CO2 4)термическое разложение оснований Fe(OH)3=(t)Fe2O3+H2O 5)действие кислот на соли HCl+Na2CO3=NACl+CO2+H2O 6)действие кислот на Ме Cu+H2SO4к=СuSO4+SO2+H2O Химические св-ва оксидов: 1)вз-е с простыми в-вами CuO+H2(t)=Cu+H2O feo+c=fe+co 2)кислотные и основные оксиды взаимодействуют между собой Na2O+SO3=Na2SO4 3)кислотные и основные оксиды вз-ют с амфотерными Na2O+ZnO=(t)Na2ZnO2 N2O5+ZnO=Zn(NO3)2 4)кислотные оксиды реагируют со щелочами,а основные с кислотами SO2+NaOH=Na2SO3 2MgO+Hcl=MgCl2+H2O
Основания Основания-соединения, содержащие в качестве катиона ионы ме, а в качестве аниона- одну или несколько гидроксогрупп Основания образованы щелочными и щел-зем Ме ,хорошо растворяются в воде, являются сильными электролитами и называются щелочами Способы получения оснований: 1)растворение щел и щел-зем Ме в воде Li+H2O=LiOH+H2 2)растворение оксидов щел и щел-зем ме в воде K2O+H2O=KOH 3)действие щелочей на соответствующие соли Feso4+naoh=fe(OH)2+Na2SO4 CrCl3+KOH=Cr(OH)3+KCl Fe(OH)2+O2+H2O=Fe(OH)3. Химические св-ва оснований: 1)основания реагируют с простыми в-вами NaOH+Cl2=NaClO+H2O ; 2)основания реагируютс кислотными и амфотерными оксидами NaOH+P2O5=NA3PO4+H2O KOH+ZNO=t K2ZNO2+H2O 3)основания реагируют с кислотами naoh+hcl=nacl+h2o 4)реагируют с солями naoh+nahso4=na2so4+h2o Naoh+cuohcl=cu(oh)2+nacl
Кислоты Кислоты-соединения,содержащие в качестве катиона ионы водорода,а в качестве аниона-кислотные остатки. По кол-ву атомов водорода,к-ты бывают: 1)одноосновные,2)двуосновные,3)трехосновные По способности к диссоциации:1)сильные(hcl,h2so4,hno3,hclo) 2)слабые(угольные,все органические,сернистая) Способы получеия к-т: 1)прямой синтез с последующим растворением h2+cl2=2hcl+вода 2)растворение кислотных оксидов So2+h2o=h2so3 No2+h2o=hno2+hno3 3)действие к-т на соли Nano2+h2so4=hno2+na2so4 Химические св-ва к-т: 1)реагируют с простыми в-вами Zn+H2SO4p=ZnSO4+H2 Zn+H2SO4k=ZnSO4+SO2+H2O 2)реагируют с основными и амфотреными оксидами MgO+H2SO4=MgSO4+H2O Fe2O3+Hcl=FeCl3+H2O 3)реагируют с основаниями H2SO4+LiOH=Li2SO4+H2O 4)реагируют с солями(всеми) Na1SO4+H2SO4=NaHSO4 CuOHCl+Hcl=CuCl2H2O Na2HPO4+H3PO4=NaH2PO4
СОЛИ Соли-соединения, состоящие из ионов метталоа и кислотных остатков Кислые соли являются продуктом неполного замещения водорода в кислоте Na2HPO4 Основные соли-продукт неполного замещения гидроксогрупп на кислотный остаток CuOHCl Способы получения солей: 1)взаимодействие Me и неМе :Fe+S=FeS 2)взаимодействие оксидов между собой 3)взаимодействие кислотных оксидов с основаниями, основных с кислотами 4) взаимодействие оснований с кислотами 5)взаимодействие солей между собой Химические св-ва солей: 1)взаимодействуют с металлами: Ме1+соль1=Ме2+соль2 причем Ме1 более активней Ме2 2)растворы солей взаимодействуют со щелочами. р-ция возможна, если новая соль или новое основание выпадет в осадок 3)соли взаимодействуют с кислотами с образованием новой более слабой кислоты или нерастворимой соли 4)соли реагируют между собой, если одна из солей выпадет в осадок 5)основные соли взаимодействуют с кислотами с образованием средних солей и воды: CuOHCl+Hcl=CuCl2+H2O 6)кислые соли взаимодействуют со щелочами с образованием средних солей и воды: NaHSO3+NAOH=Na2SO3+H2O
Между классами неорганических соединений, а также простыми веществами существует возможность взаимного перехода. Так, простое вещество металл в результате реакции с кислородом может превратиться в основный оксид; основный оксид с водой может образовывать основание, а основание при взаимодействии с кислотой превращается в соль. Аналогично из простого вещества неметалла можно получить кислотный оксид, из него при взаимодействии с водой кислоту, а из нее при реакции с основанием соль. Можно осуществить и обратный последовательный переход от соли к простому веществу. Связь между классами неорганических соединений, основанную на получении веществ одного класса из веществ другого, называют генетической.
3.Понятие о химической реакции. Реагенты и продукты. Классификация химических реакций. Химическая реакция- явление, при котором одни вещества превращаются в другие, при этом атомы, входящие в состав этих веществ не меняются. Реагент- химическое вещество, превращающееся в другое в ходе химической реакции. Продукт- вещество, образовавшееся в ходе химической реакции. Классификация химических реакций: 1. По числу реагентов и продуктов: 1) реакция замещения (между простыми и сложными веществами), при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе: 2AgNO3+Zn=Zn(NO3)2+2Ag 2) реакция разложения, при которых из одного вещества образуются 2 или несколько других веществ: (CuOH)2CO3= нагр 2CuO + CO2+H2O 3) реакция обмена (между сложными веществами), при которых их составные части обмениваются местами: K2SO4+BaCl2=BaSO4+2KCl 4) реакция соединения, при которой из двух или нескольких веществ образуется одно новое: 2Al+3Br2=2AlBr3 2. По признаку выделения тепла: 1) экзотермические: H2+Cl2=2HCl+Q 2) эндотермические: N2+O2=2NO-Q 3. По степени однородности: 1) гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидкость) 2) гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:CO3(твердое) + 2HCl(раств.) → Cl2(раств.) + CO2(газ) + H2O(жидкость) 3) гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака:NH3(газ) + HCl(газ) → NH4Cl(твердое) 4) гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:N2(газ) + 3H2(газ) → 2 NH3(газ) (катализатор Pt) 4. По признаку обратимости: 1) обратимые N2+H2=2NH3 2) необратимые: а) выпадает осадок: BaCl2+H2SO4=BaSO4+ 2HCl б) образование малодиссоциирующего соединения: NaOH+Hcl=NaCl+H2O в) с выделением большого количества тепла: Mg+O2=2MgO 4. Стехиометрические законы химии. Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. На основании стехиометрических законов проводят расчеты количества веществ, вступающих в химическую реакцию и образующихся в результате ее протекания, устанавливаются химические формулы на основе данных химического анализа. В химии используются следующие стехиометрические законы: закон сохранения массы, закон постоянства состава вещества, закон эквивалентов, закон кратных отношений. Закон сохранения массы: Масса веществ,вступивших в реакцию, равна массе получившихся веществ. Закон сохранения энергии: Энергия не исчезает и не берется из ниоткуда. Она лишь переходит из одного вида в другой. Закон постоянства состава: Соотношение между массами элементов, входящий в состав данного соединения постоянный и не зависит от способа получения.(искл тяжелая вода) Закон кратных соотношений: Если 2 элемента образуют между собой несколько химических соединений, то массы этих элементов относятся между собой как небольшие целые числа. Закон объемных соотношений: Объемы реагирующих газов относятся между собой как небольшие целые числа. Закон Авогадро: В равных объёмах газов, взятых при одинаковых условиях, содержится одно и то же число молекул. Следствие. При одинаковых условиях,1 моль любого газа занимает один и тот же объем. (ну: температура=0С, давление=101325Па) Правило относительной плотности: Если объем 1=объему2, то по закону Авагадро N1=N2 D=M1/M2 Объединённый газовый закон: pV=const; V/T=const ; pV/T=p0V0/T0 Уравнение Менделеева- Клапейрона: pV=mRT/M Закон парциальных давлений Дальтона: Давление смеси газов, не вступающих между собой в химическое взаимодействие, равно сумме парциальных давлений, составляющих смеси. Закон Генри-Сеченова: При увеличении давления ,растворимость газов в жидкостях увеличивается. Закон эквивалентов: Эквивалентные количества всех веществ, участвующих в реакции, одинаковы: nA+nB=nC+nD 5. Ядро как динамическая система протонов и нейтронов. Ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относится атом. Ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином) и связанным с ним магнитным моментом. Количество протонов в ядре называется его зарядовым числом — это число равно порядковому номеру элемента, к которому относится атом в таблице Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом . Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом () и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами. Число протонов в ядре определяет непосредственно его электрический заряд, у изотопов одинаковое количество протонов, но разное количество нейтронов. Ядерные свойства изотопов элемента в отличие от химических, могут различаться чрезвычайно резко. Из-за разницы в числе нейтронов изотопы элемента имеют разную массу , которая является важной характеристикой ядра. В ядерной физике массу ядер принято измерять в атомных единицах массы (а. е. м.), за одну а. е. м. принимают 1/12 часть массы нуклида 12C.
6.Строение одноэлектронного атома. Квантовые числа. Электрон - элементарная частица, обладающая наименьшим существующим в природе зарядом (1,602*10-19 Кл). Резерфорд в 1911г. предложил следующую схему строения атома, получившую название ядерной модели атома. Атом состоит из положительно заряженного ядра ,в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Квантовые числа - числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы (атомное ядро, атом, молекулу) и отдельные элементарные частицы. Главное квантовое число определяет возможные энергетические состояния электрона, которое может принимать значения n=1.2.3 и тд. Наименьшей энергией электрон обладает при n=1, с увеличением главного квантового числа энергия электрона возрастает. Главное квантовое число определяет размеры электронного облака. Для того, чтобы увеличить размеры электронного облака, нужно часть его удалить на большое расстояние от ядра. БОльшим размерам электронного облака соответствует более высокая энергия электрона, следовательно, большее значение главного квантового числа. Орбитальное квантовое число l определяет форму электронного облака. Оно может принимать значения от 0 до n-1. Данному значению главного квантового числа соответствует n различных возможных значений орбитального квантового числа. Магнитное квантовое число m определяет ориентацию электронного облака в пространстве. Магнитное квантовое число может принимать значения от l до минус l. Спиновое квантовое число s определяет направление движения электронов в пространстве. Может принимать только 2 значения: ½ и – ½ Четыре квантовых числа n,l,m,s полностью определяют состояние электрона в атоме. 7. Принципы заполнения многоэлектронных атомов. Закономерность заполнения электронных оболочек атомов определяется: 1)принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином). 2) принцип наименьшей энергии: заполнение электронных подуровней происходит от уровня с меньшей энергией к уровню с большей энергией. 3) правила Клечковского: а) заполнение электронных орбиталей происходит в порядке увеличения суммы главного и орбитальных чисел б) при равных значениях суммы m+l происходит заполнение той орбитали, где значение n меньше. При заполнении атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом Гунда: При заполнении электронами одного подуровня, сумма их спиновых чисел дожна быть максимальной. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. 8.Основные характеристики химической связи: длина связи, энергия связи, валентный угол. Основные типы химической связи. Химическая связь – взаимодействие между атомами, приводящее к общему понижению энергии системы. Длина связи- расстояние между центрами атомов, которые образуют связь. Чем короче длина связи, тем прочнее связь. Энергия связи- количество энергии, которое выделяется при образовании связи или затрачивается на ее разрушение. Энергия связи является показателем прочности молекулы. Валентный угол- угол между линиями, соединяющими центры атомов. Электроотрицательность – способность атома притягивать или отдавать электроны. Химическая связь может быть: 1) ковалентная связь образуется между атомами, электроотрицательность которых отличается незначительно . При образовании ковалентной связи происходит перекрывание облаков электронов, имеющих антипараллельные спины. Область перекрывания облаков -это область высокого отрицательного заряда, который притягивает положительно заряженные ядра атомов. Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной. Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. 2) Металлическая связь-между всеми положительно заряженными ионами свободными электронами в кристаллической решетке металлов называется металлической связью. Атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ- металлов. Простые вещества, которые при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути). В кристаллах металлов часть их находится в ионизированном состоянии. В узлах кристаллической решетки находятся положительные ионы и атомы металлов,а между узлами – электроны. Эти электроны являются общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке. Поэтому электроны, которые находятся в кристаллической решетке металлов, называются электронным газом. 3) ионная связь возникает между атомами, электроотрицательность которых значительно отличается, при этом электрон полностью переходит к более электроотрицательному атому. По своим свойствам ионная связь отличается от ковалентной. Силы электростатического взаимодействия направлены от данного иона во все сторон. Поэтому данный ион может притягивать ионы противоположного знака в любом направлении. Этим обусловлены ненаправленность и ненасыщаемость ионной связи. В кристаллической решетки ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным зарядом .9. Полярность связи. Дипольный момент. Электроотрицательность элементов. Степень окисления. Координационное число. Ковалентность атома. Полярность химической связи- характеристика химической связи, показывающая перераспределение электронной плотности в пространстве вблизи ядер по сравнению с исходным распределением этой плотности в нейтральных атомах, образующих данную связь. Количественной мерой полярности связи служат так называемые эффективные заряды на атомах: разность между зарядом электронов, сосредоточенным в некоторой области пространства (порядка атомных размеров) вблизи ядра, и зарядом ядра. Эта мера приближённая, поскольку выделить в молекулах области, относящиеся к отдельным атомам и отдельным связям (если их несколько), однозначно нельзя. Связи строго неполярны лишь в двухатомных гомоядерных молекулах, в остальных случаях они в той или иной степени полярны. Обычно ковалентные связи слабо полярны, ионные связи сильно полярны. Полярность связи иногда указывают символами зарядов у атомов (например, Н+δ — Cl-δ, где δ — некоторая доля элементарного заряда). Дипольный момент-это количественная характеристика полярности связей и молекул . Дипольный момент µ равен произвдению заряда δ на длину диполя l. Чем больше дипольный момент, тем больше полярность связи и молекулы. Дипольный момент- векторная величина. Вектор дипольного момента направлен от центра положительного заряда к центру отрицательного заряда. Диполь- электронейтральная система, в которой центы положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга. Электроотрицательность – это способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле. Степень окисления- это условный заряд, который возник бы на атоме, при условии полного перехода электронов от менее электроотрицательного элемента к более электроотрицательному. Координационное число — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле. В химии понятие координационного числа появилось с развитием химии комплексных соединений. Под ним подразумевается число лигандов(атомов, молекул, ионов), которые образуют первую координационную (внутреннюю) сферу комплексообразователя[1]. Например, в комплексной соли гексацианоферрате(III)калия K3[Fe(CN)6] координационное число иона Fe3+ равно 6. Понятие координационного числа применяется и для характеристики центрального атома в молекулах, преимущественно для тех случаев, когда число химических связанных ближайших атомов не равно численному значению валентности. Например, в молекуле азотной кислоты формальная валентность центрального атома азота равна 4, степень окисления - +5, а координационое число - 3. Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным. В кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом. Вале́нтность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов Ковалентность — мера способности атома к образованию ковалентных химических связей, возникающих за счёт двух электронов (по одному от каждого атома) и имеющих малополярный характер.
10.Понятие о молекулярных орбиталях. Насыщаемость, направленность, поляризуемость ковалентной связи. Типы молекулярных орбиталей. МОЛЕКУЛЯРНАЯ ОРБИТАЛЬ - - электронное облако, образующееся при слиянии внешних электронных оболочек атомов (атомных орбиталей) при образовании между ними химической связи. Молекулярные орбитали образуются при слиянии двух или нескольких атомных орбиталей. Число молекулярных орбиталей всегда равно числу взаимодействующих атомных орбиталей. Все валентные электроны связывающихся атомов располагаются на вновь образованных молекулярных орбиталях. Существуют молекулярные орбитали трех типов: связывающие, несвязывающие и разрыхляющие (антисвязывающие) орбитали. Связывающие орбитали. Они образуются в результате перекрывания (наложения) атомных орбиталей двух соседних атомов. Несвязывающие орбитали. Устойчивый октет электронов во внешней оболочке атома кислорода легко достигается путем обобществления двух из шести внешних электронов кислорода с другими атомами. При этом остальные четыре электрона не принимают участия в образовании связей. Эти четыре электрона составляют две неподеленные (т.е. необобществленные) пары Разрыхляющие орбитали. Каждая связывающая а- или я-орбиталь состоит из двух перекрывающихся атомных орбиталей. Электроны на таких орбиталях связывают атомы в молекулу. Но электроны могут находиться и на других орбиталях, где они способствуют разъединению молекулы. Подобные орбитали называются разрыхляющими (электроны на них «разрыхляют» химическую связь в молекуле). Разрыхляющая орбиталь имеет более высокую энергию, чем соответствующая (однотипная с ней) связывающая орбиталь. Поэтому на разрыхляющих орбиталях могут находиться только возбужденные электроны. А так как связывающие электроны в молекулах обычно находятся в основном (невозбужденном) состоянии, разрыхляющие орбитали заселяются электронами в последнюю очередь. Свойства ковалентной связи: прочность, полярность, насыщаемость, направленность, гибридизация, кратность 1. Прочность ковалентной связи — это свойства характер длинной связи (межъядерное пространство) и энергии энергией связи. 2. Полярность ковалентной связи. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью. Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью. 3. Насыщаемость ковалентной связи — это способность атома участвовать только в определенном числе ковалентной связи, насыщаемость характеризует валентностью атома. Количественные меры валентности являются число не спаренных электронов у атома в основном и в возбужденном состоянии. 4. Направленность ковалентной связи. Наиболее прочные ковалентной связи образуются в направлении максимального перекрывания атомных орбиталей, то есть мерой направленности служит валентный угол. 5. Гибридизация ковалентной связи — при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp2, sp3 —гибридизация. sp — форма молекулы линейная (угол 1800), sp2 — форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028). 6. Кратность ковалентной связи или делоколизация связи — Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществленной электронной парой. такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например О2; N2; C12. Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Такая ковалентная связь называется полярной. Донорно-акцепторный механизм. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
11. Межмолекулярное взаимодействие. Когда вещество находится в жидком или твердом состояниях, расстояние между частицами вещества малы и силы взаимодействия между ними велики. Эти силы удерживают частицы жидкости или твердого тела около друг друга. Поэтому вещества в конденсированном состоянии имеют постоянный при данной температуре объем. Силы, удерживающие частицы твердого или жидкого тела около друг друга имеют электростатическую природу. Если вещество построено из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью. Если вещество –металл, то часть электронов его атомов становятся общими для всех атомов. Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического напряжения. В веществах с молекулярной структурой имеет место межмолекулярное взаимодействие. Силы межмолекулярного взаимодействия слабее ковалентных сил, но проявляются на бОльших расстояниях. В основе их лежит электростатическое взаимодействие диполей. Если вещество состоит из полярных молекул, то в конденсированном состоянии соседние молекулярные диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствии чего наблюдается их взаимное притяжение. Такой вид называется ориентационным взаимодействием. С ростом температуры, ориентационный эффект ослабевает. В случае веществ, состоящих из неполярных, но способных к поляризации молекул, наблюдается возникновение наведенных или индуцированных диполей. Причина их пявления состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. В результате происходит взаимное притяжение молекул друг к другу. Движение электронов в атомах, а также колебание ядер вызывают появление мгновенных диполей. Мгновенные диполи возникают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными противоположного знака, что приводит к их притяжению. Это явление называется дисперсным взаимодействием. Оно обуславливает переход благородных газов в жидкое состояние. Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества. Чем больше полярность молекул, тем больше ориентационные силы. Чем больше деформируемость, тем слабее связаны внешние электроны атомов, то есть чем эти атомы крупнее, тем значительней дисперсионные силы. Таким образом в ряду однотипных веществ, дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ.
1![]()
![]()
![]() 2.
Понятие о системе. Параметры системы
и функции состояния системы.
Система
в химии-
часть пространства, заполненная
веществом или смесью веществ и
отграниченная от окружающей среды
реальной или воображаемой границей.
Отдельные
части системы, имеющие одинаковые
физические свойства, однородный
химический состав и обладающие
поверхностью раздела, называются
фазами. Число фаз в системе может быть
разным.
Системы
бывают:
1)открытые
(в этих системах меняется поток вещества
и поток энергии)- клетка;
2)закрытые
( есть поток энергии, нет потока вещества)
–сосуд с водой;
3)изолированные (
отсутствуют потоки энергии и потоки
вещества)- идеальный термос.
Состояние
системы- совокупность ее физических и
химических свойств.
Состояние
системы бывают:
1)
равновесное(система находится в
равновесии, если отсутствуют потоки
веществаи энергии)
2)стационарное
(свойства системы не меняются, потоки
энергии и вещества есть.)
3)динамическое
(свойства меняются, потоки вещества и
энергии меняются)
Охарактеризовать
состояние системы можно
параметрами:
1)экстенсивные (зависят
от количества
вещества:объем,масса,теплоемкость,количество
энергии)
2)интенсивные (не зависят
от количества вещества:
плотность,температура,давление,
концентрация)
Переход системы из
одного состояния в другое называется
термодинамическим процессом:
1)изотермический
(Т= const)
2)изобарный
(p=const)
3)изохорный
(V=
const)
4)
адиабатный (E=const)
Функции
состояния
Функции состояния- это
такие параметры системы, изменения
которых зависят только от начального
и конечного состояния, но не зависят
от путей перехода.
Измерить функции
состояния нельзя, но можно измерить ее
изменение
∆U-
изменение внутренней энергии
∆H-
этальпия
∆S-
энтрапия
∆G-
изобарно-изотермический потенциал(энергия
Гиббса)
2.
Понятие о системе. Параметры системы
и функции состояния системы.
Система
в химии-
часть пространства, заполненная
веществом или смесью веществ и
отграниченная от окружающей среды
реальной или воображаемой границей.
Отдельные
части системы, имеющие одинаковые
физические свойства, однородный
химический состав и обладающие
поверхностью раздела, называются
фазами. Число фаз в системе может быть
разным.
Системы
бывают:
1)открытые
(в этих системах меняется поток вещества
и поток энергии)- клетка;
2)закрытые
( есть поток энергии, нет потока вещества)
–сосуд с водой;
3)изолированные (
отсутствуют потоки энергии и потоки
вещества)- идеальный термос.
Состояние
системы- совокупность ее физических и
химических свойств.
Состояние
системы бывают:
1)
равновесное(система находится в
равновесии, если отсутствуют потоки
веществаи энергии)
2)стационарное
(свойства системы не меняются, потоки
энергии и вещества есть.)
3)динамическое
(свойства меняются, потоки вещества и
энергии меняются)
Охарактеризовать
состояние системы можно
параметрами:
1)экстенсивные (зависят
от количества
вещества:объем,масса,теплоемкость,количество
энергии)
2)интенсивные (не зависят
от количества вещества:
плотность,температура,давление,
концентрация)
Переход системы из
одного состояния в другое называется
термодинамическим процессом:
1)изотермический
(Т= const)
2)изобарный
(p=const)
3)изохорный
(V=
const)
4)
адиабатный (E=const)
Функции
состояния
Функции состояния- это
такие параметры системы, изменения
которых зависят только от начального
и конечного состояния, но не зависят
от путей перехода.
Измерить функции
состояния нельзя, но можно измерить ее
изменение
∆U-
изменение внутренней энергии
∆H-
этальпия
∆S-
энтрапия
∆G-
изобарно-изотермический потенциал(энергия
Гиббса)
13. Изобарный и изохорный процессы. Первый закон термодинамики. Изобарный процесс— термодинамический процесс, происходящий в системе при постоянном давлении и массе идеального газа. Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе
. Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV. Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV. Изохорический или изохорный процесс — это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
Изменение внутренней энергии идеального газа можно найти по формуле:,
![]()
Первый закон термодинамики Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил при изобарном процессе
![]()
при изохорном процессе (A = 0)
при изотермическом процессе (ΔU = 0)
![]()
![]() Здесь
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при постоянном
объёме,
— молярная
теплоёмкость при постоянном
объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
1![]() 6.
Закон Гесса. Второй закон термодинамики.
Закон
Гесса —
основной закон термохимии,
который формулируется следующим
образом: *Тепловой
эффект химической реакции,
проводимой в изобарно-изотермических
или изохорно-изотермических условиях,
зависит только от вида и состояния
исходных веществ и продуктов реакции
и не зависит от пути её протекания.
Иными словами, количество
теплоты,
выделяющееся или поглощающееся при
каком-либо процессе, всегда одно и то
же, независимо от того, протекает ли
данное химическое
превращение
в одну или в несколько стадий (при
условии, что температура,
давление
и агрегатные
состояния
веществ одинаковы). Например, окисление
глюкозы
в организме осуществляется по очень
сложному многостадийному механизму,
однако суммарный тепловой эффект всех
стадий данного процесса равен теплоте
сгорания глюкозы.
Согласно закону Гесса, тепловые эффекты
всех этих реакций связаны следующим
соотношением:
6.
Закон Гесса. Второй закон термодинамики.
Закон
Гесса —
основной закон термохимии,
который формулируется следующим
образом: *Тепловой
эффект химической реакции,
проводимой в изобарно-изотермических
или изохорно-изотермических условиях,
зависит только от вида и состояния
исходных веществ и продуктов реакции
и не зависит от пути её протекания.
Иными словами, количество
теплоты,
выделяющееся или поглощающееся при
каком-либо процессе, всегда одно и то
же, независимо от того, протекает ли
данное химическое
превращение
в одну или в несколько стадий (при
условии, что температура,
давление
и агрегатные
состояния
веществ одинаковы). Например, окисление
глюкозы
в организме осуществляется по очень
сложному многостадийному механизму,
однако суммарный тепловой эффект всех
стадий данного процесса равен теплоте
сгорания глюкозы.
Согласно закону Гесса, тепловые эффекты
всех этих реакций связаны следующим
соотношением:
Δ![]() H1
= ΔH2
+ ΔH3
= ΔH4
+ ΔH5
+ ΔH6
Закон открыт русским
химиком Г. И. Гессом
в 1840 г.;
он является частным случаем первого
начала термодинамики
применительно к химическим реакциям.
Практическое значение закона Гесса
состоит в том, что он позволяет
рассчитывать тепловые эффекты самых
разнообразных химических процессов;
для этого обычно используют ряд следствий
из него. Следствия
из закона Гесса
*Тепловой
эффект прямой реакции равен по величине
и противоположен по знаку тепловому
эффекту обратной реакции (закон
Лавуазье —
Лапласа).
*Тепловой
эффект химической реакции равен разности
сумм теплот
образования
(ΔHf)
продуктов реакции и исходных веществ,
умноженных на стехиометрические
коэффициенты (ν): *Тепловой
эффект химической реакции равен разности
сумм теплот
сгорания
(ΔHc)
исходных веществ и продуктов реакции,
умноженных на стехиометрические
коэффициенты (ν): Таким
образом, пользуясь табличными значениями
теплот
образования
или сгорания веществ, можно рассчитать
теплоту реакции, не прибегая к
эксперименту. Табличные величины теплот
образования и сгорания веществ обычно
относятся к т. н. стандартным
условиям.
Для расчёта теплоты процесса, протекающего
при иных условиях, необходимо использовать
и другие законы термохимии, например,
закон
Кирхгофа,
описывающий зависимость теплового
эффекта реакции от температуры.
H1
= ΔH2
+ ΔH3
= ΔH4
+ ΔH5
+ ΔH6
Закон открыт русским
химиком Г. И. Гессом
в 1840 г.;
он является частным случаем первого
начала термодинамики
применительно к химическим реакциям.
Практическое значение закона Гесса
состоит в том, что он позволяет
рассчитывать тепловые эффекты самых
разнообразных химических процессов;
для этого обычно используют ряд следствий
из него. Следствия
из закона Гесса
*Тепловой
эффект прямой реакции равен по величине
и противоположен по знаку тепловому
эффекту обратной реакции (закон
Лавуазье —
Лапласа).
*Тепловой
эффект химической реакции равен разности
сумм теплот
образования
(ΔHf)
продуктов реакции и исходных веществ,
умноженных на стехиометрические
коэффициенты (ν): *Тепловой
эффект химической реакции равен разности
сумм теплот
сгорания
(ΔHc)
исходных веществ и продуктов реакции,
умноженных на стехиометрические
коэффициенты (ν): Таким
образом, пользуясь табличными значениями
теплот
образования
или сгорания веществ, можно рассчитать
теплоту реакции, не прибегая к
эксперименту. Табличные величины теплот
образования и сгорания веществ обычно
относятся к т. н. стандартным
условиям.
Для расчёта теплоты процесса, протекающего
при иных условиях, необходимо использовать
и другие законы термохимии, например,
закон
Кирхгофа,
описывающий зависимость теплового
эффекта реакции от температуры.
*Если
начальное и конечное состояния химической
реакции (реакций) совпадают, то ее (их)
тепловой эффект равен нулю.
*2-й
закон — второе
начало термодинамики:
Второй закон термодинамики исключает
возможность создания вечного
двигателя
второго рода. Имеется несколько
различных, но в то же время эквивалентных
ф![]() ормулировок
этого закона. *1 —
Постулат Клаузиуса.
Процесс, при котором не происходит
других изменений, кроме передачи теплоты
от горячего тела к холодному, является
необратимым, то есть теплота не может
перейти от холодного тела к горячему
без каких-либо других изменений в
системе. Это явление называют рассеиванием
или диссипацией энергии.
*Приведем
второе начало термодинамики в
аксиоматической формулировке Рудольфа
Юлиуса Клаузиуса
(1865): Для любой квазиравновесной
термодинамической системы существует
однозначная функция термодинамического
состояния S
= S(T,x,N),
называемая энтропией, такая, что ее
полный дифференциал dS
= δQ
/ T.
[1]
*2 —
Постулат Кельвина.
Процесс, при котором работа переходит
в теплоту без каких-либо других изменений
в системе, является необратимым, то
есть невозможно превратить в работу
всю теплоту, взятую от источника с
однородной температурой, не проводя
других изменений в системе.
ормулировок
этого закона. *1 —
Постулат Клаузиуса.
Процесс, при котором не происходит
других изменений, кроме передачи теплоты
от горячего тела к холодному, является
необратимым, то есть теплота не может
перейти от холодного тела к горячему
без каких-либо других изменений в
системе. Это явление называют рассеиванием
или диссипацией энергии.
*Приведем
второе начало термодинамики в
аксиоматической формулировке Рудольфа
Юлиуса Клаузиуса
(1865): Для любой квазиравновесной
термодинамической системы существует
однозначная функция термодинамического
состояния S
= S(T,x,N),
называемая энтропией, такая, что ее
полный дифференциал dS
= δQ
/ T.
[1]
*2 —
Постулат Кельвина.
Процесс, при котором работа переходит
в теплоту без каких-либо других изменений
в системе, является необратимым, то
есть невозможно превратить в работу
всю теплоту, взятую от источника с
однородной температурой, не проводя
других изменений в системе.
17. Энергия Гиббса (изобарно- изотермический потенциал ), стандартное значение энергии Гиббса.
|
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
В химических процессах одновременно действуют два противоположных фактора — энтропийный (TΔS) и энтальпийный (ΔH). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
Из этого выражения следует, что
![]()
, то есть некоторое количество теплоты расходуется на увеличение энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG < 0 процесс может протекать, при ΔG > 0 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства ΔG < 0 (по кинетическим причинам).
Существует
полезное соотношение, связывающее
изменение свободной э![]() нергии
Гиббса
нергии
Гиббса
в ходе химической реакции с её константой равновесия К :
![]()
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где k1 — константа скорости прямой реакции, k_1 — константа скорости обратной реакции.
24. Признаки обратимых и необратимых реакций. Критерии равновесия. Константа равновесия. Принцип Ле-Шателье. 1. Реакцию называют обратимой, если её направление зависит от концентраций веществ — участников реакции. Например N2 + 3H2 = 2NH3 при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении равновесия химического, система содержит как исходные вещества, так и продукты реакции.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
K = K1/K2 = ([C] c [D] d) / ([A] a [B] b)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Смещение химического равновесия.
1. Иземенение концентрации реаг. В-в
Увеличение конц исх в-в сдвигает вправо
Увеличение продуктов сместит равновесие влево
2. Давление (только для газов)
Увеличение давл. Смещает равновесие в сторону в-в занимающих меньший объём.
Уменьшение давл смещает равновесие в сторону в-в занимающих больший объём
3. Температура.
Для экзотермических р-ий повыш. Т смещает влево
Для эндотермических повышение Т смещает вправо.
Катализаторы не оказывают влияние на хим. Равновесие, а лишь ускоряет его наступление
Принцип Ле-Шателье если на систему находящуюся в состоянии динамического равновесия, оказать какое-либо воздействие, то преимущественно получается та реакция которая препятствует этому воздействию
N2+O2↔NO+ ∆H
↑[N2]→ ↑t◦→
↓[O2]← ↓ t◦←
↑[NO] ← ↑p-
25 Теория электролитической диссоциации ТЭД
Положения ТЭД
При растворении электролиты расспадаются на заряженные частицы –ионы
“+” частицы движутся к катоду (“-”) и называются катионамы
“-” частицы движутся к аноду(“+”) и называются анионами
Процесс электролитич. Диссоциации обратим
КА↔К-н+ + А-н-
К-д- А-д+
Константа диссоциации Кд=[К+] * [А-]/[KA]
α(Степень дисс)= Nдисс/Nобщ
α>0.3 (30%),то сильный электролит
α<0,03(3%), то слабый электролит(слабые к-ты, нераств-е основания и соли)
0,03<α<0,3, то средний электролит (ортофосфорная к-та)
α зависит от концентрации р-ра/
Закон разбавлеие Оствальда.
Начальная концентрация в-ваc[KA], степ.дисс –α
Кд=Сα * Сα/С-Сα= С2* α2/С(1- α ) = α2*С/1-α
Для слабых электролитов:
Кд= α2*С/1-α
α=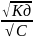
При разбавлении р-ра степень дисс возрастает
1фактор - природа вещества
2 фактор - концентрация
3фактор – температура
CuCl2↔ Cu2+ = 2Cl-
Добавление одноимённых ионов смещает равновесие дисс-ии влево
Механизм ЭД
1сл) Ковалентная полярная связь
1этап)-сольватация(гидратация)
∆H1<0
2 этап) поляризация
∆H=0
3этап) гидратная оболочка
Гидротированные ионы Н+aq и Cl-aq
2сл) Ионная связь
1эт) гидратация ∆H1<0
2эт) ионизация ∆H2>0
3cл)газы
1эт)сольватация
Повышение темп. Ухудшает растворимость
4сл) диссоциация воды
H2O↔H+ +OH-
Кд=[H+]*[OH-]/H2O
Kд=1,6*10-16
Кд[H2O]=Kw=10-14
Kw=[H+]*[OH-]=10-14 ионное произведение воды
[H+]=[OH-]=10-7
pH=-lg[H+]
pH=-lg[10-7]=7
