
- •Тверской государственный технический университет
- •Электродвижущие силы. Теоретическая часть.
- •Скачок потенциала на границе металл/раствор.
- •Гальванический элемент
- •Токообразующая реакция. Уравнение нернста.
- •Вычисление термодинамических параметров токообразующей реакции.
- •Электродные потенциалы.
- •Классификация обратимых электродов.
- •Измерение электродвижущих сил.
- •Ионометрия.
- •Потенциометрическое титрование.
- •Лабораторная работа № 25. Измерение температурного коэффициента э.Д.С. Гальванического элемента и расчет термодинамических величин.
- •Теоретическое обоснование.
- •Порядок выполнения работы.
Измерение электродвижущих сил.
Компенсационный метод. Для измерения равновесной величины э. д. с. гальванического элемента необходимо, чтобы потенциалобразующий процесс совершался бесконечно медленно, следовательно, элемент должен работать при бесконечно малой силе тока. Это условие выполняется при измерении э. д. с. компенсационным методом, который основан на том, что исследуемый элемент последовательно включается против внешнего источника тока (А), так что ток от используемого гальванического элемента компенсируется встречным постоянным током от внешнего источника (А). Электродвижущую силу источника тока в свою очередь сравнивают с э. д. с. эталонного элемента (W), которая известна.
В качестве эталона обычно применяют стандартный элемент, э. д. с. которого постоянна во времени и мало изменяется с температурой. Принципиальная схема компенсационной установки показана на рисунке 4.
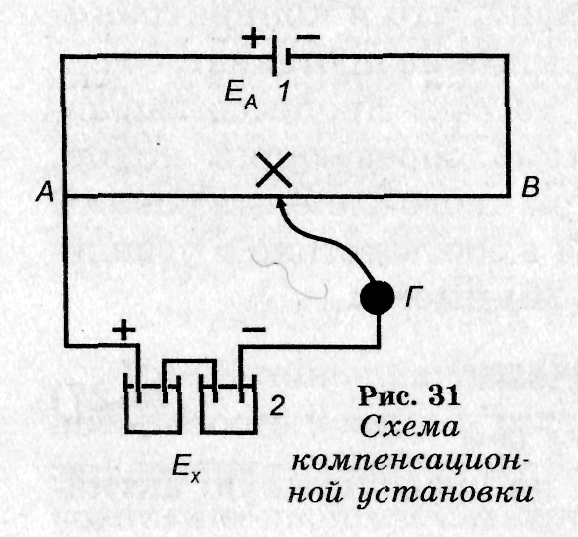
В настоящее время для измерения э. д. с. применяют высокоомные потенциометры различных конструкции, содержащие все элементы компенсационной установки. Измерение э. д. с. компенсационным методом при помощи потенциометров дает весьма точные результаты при измерениях электродных потенциалов или опытном определении неизвестной э. д. с. Но этот метод неприменим, если внутреннее сопротивление элемента велико, например, у гальванических цепей со стеклянным электродом, в этом случае пользуются некомпенсационным методом.
Значения электродвижущей силы гальванического элемента определяют непосредственно на чувствительных вольтметрах постоянного тока с сопротивлением от 108 до 109 Ом и отсчетом до 1 мВ. Через такой вольтметр течет очень маленький ток, поэтому измеренная э. д. с. практически не отличается от измеренной на компенсационной установке.
Для измерений э. д. с. некомпенсационным методом применяют ламповые потенциометры, ламповые милливольтметры, рН-метры и ионометры различных конструкций. Шкалы приборов отградуированы в милливольтах или единицах рН. Метод используют для потенциометрического титрования и в ионометрии.
При измерениях э. д. с. электрохимических цепей некомпенсационным методом надо учитывать, что проходящий через элемент ток более 10-5 А вызывает концентрационную и химическую поляризацию и измеренная э. д. с. меньше равновесного значения.
Ионометрия.
Измерение э. д. с широко применяют в лабораторной практике для определения содержания в растворах катионов Н+ (рН-метрия) или других ионов.
Для определения рН раствора потенциометрическим методом составляют гальванический элемент из индикаторного электрода, потенциал которого зависит от рН (электрода, обладающего водородной функцией), и электрода сравнения с устойчивым известным потенциалом, в качестве которого чаще всего используют хлорсеребряный электрод.
Индикаторными могут быть водородный, хингидронный, стеклянный и некоторые другие электроды.
Водородный электрод: (Pt)H2,г|H+. Водородный электрод состоит из колоколообразного стеклянного сосуда, в который вмонтирована стеклянная трубка с платинированной платиновой пластинкой (см. рис. 29), адсорбирующей водород. Колокол помещают в сосуд с раствором электролита, содержащего ионы Н+, так, чтобы платиновая пластинка была погружена в раствор не полностью. Верхняя часть пластинки после насыщения водородом должна находиться в газовой фазе, а нижняя в растворе. Через отросток на стеклянной трубке подают очищенный Н2.
Водород пропускают со скоростью 1-2 пузырька в секунду до измерения э. д. с. в течение 20 мин, при повторных измерениях 5-10 мин, при измерениях водород должен поступать непрерывно.
Электродный процесс на водородном электроде:
![]()
Потенциал водородного электрода в общем случае определяется выражением:
![]()
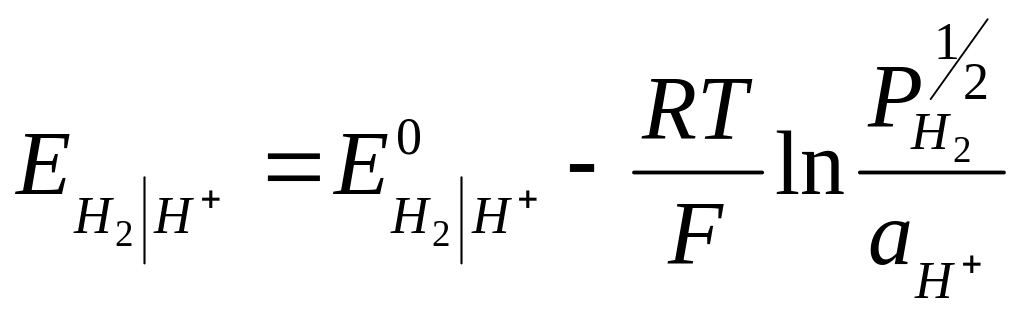 (28)
(28)
Так как измерения с водородным электродом проводятся при давлении водорода, равном 1 атм., а нормальный электродный потенциал водородного электрода Е°н2|н+ при всех температурах принимается равным нулю, то
![]() (29)
(29)
Хингидронный электрод. Хингидронный электрод относится к окислительно-восстановительным электродам и представляет собой гладкую платиновую пластинку, погруженную в раствор, содержащий ионы Н+ и небольшое количество кристаллов хингидрона (С6Н4)2О2(ОН)2.
Хингидрон распадается в растворе на эквивалентные количества хинона С4Н4О2 и гидрохинона С6Н4(ОН)2. Гидрохинон, являясь слабой двухосновной кислотой, диссоциирует с образованием аниона С6Н4О22-, который при окислении переходит в хинон. Суммарная потенциалобразующая реакция на таком электроде может быть выражена уравнением:
С6Н4О2 + 2Н+ + 2е -» С6Н4(ОН)2.
Потенциал хингидронного электрода определяется выражением:
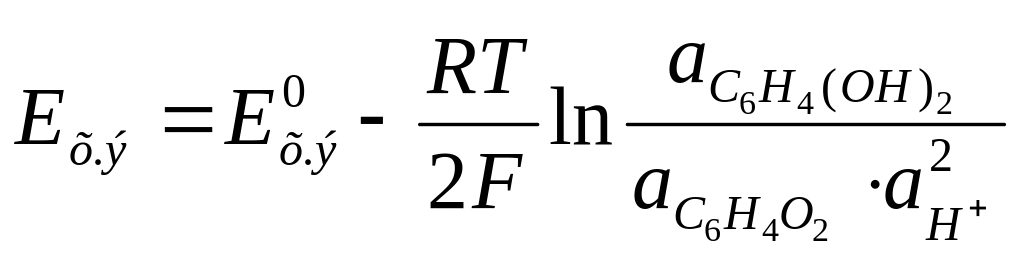 (30)
(30)
В кислых растворах степень диссоциации гидрохинона ничтожно мала и поэтому активности хинона и гидрохинона можно считать равными, и тогда потенциал хингидронного электрода зависит только от активности ионов Н+ в растворе:
![]() (31)
(31)
