
- •Тверской государственный технический университет
- •Электродвижущие силы. Теоретическая часть.
- •Скачок потенциала на границе металл/раствор.
- •Гальванический элемент
- •Токообразующая реакция. Уравнение нернста.
- •Вычисление термодинамических параметров токообразующей реакции.
- •Электродные потенциалы.
- •Классификация обратимых электродов.
- •Измерение электродвижущих сил.
- •Ионометрия.
- •Потенциометрическое титрование.
- •Лабораторная работа № 25. Измерение температурного коэффициента э.Д.С. Гальванического элемента и расчет термодинамических величин.
- •Теоретическое обоснование.
- •Порядок выполнения работы.
Гальванический элемент
Устройство, которое позволяет получить электрическую работу за счет энергии химической реакции, называют гальваническим элементом.
Гальванический элемент состоит из двух электродов, представляющих собой систему из электронного проводника (обычно металла) и раствора одного или нескольких электролитов, находящегося с ним в контакте. На границе фаз такой системы по причинам, указанным выше, существует скачок потенциала.
Гальванический элемент, изображенный на рисунке 1, состоит из электрода I рода (слева) и редокс-электрода (справа).
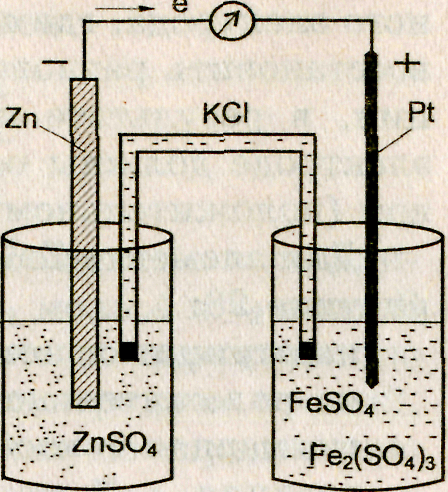
Рис.1 Схема гальванического элемента
Разность потенциалов на концах разомкнутого гальванического элемента называется его электродвижущей силой (э. д. с.)
Электродвижущая сила гальванического элемента (Е) слагается из скачков потенциала на границах фаз.
Схематически гальванический элемент записывается так: слева указывается материал более отрицательного электрода, затем примыкающий к нему раствор, причем твердая фаза отделяется от раствора одной вертикальной чертой. Далее указывается двумя вертикальными чертами солевой мостик, раствор более положительного электрода и, наконец, металл, из которого сделан этот электрод (раствор от металла отделяется одной вертикальной чертой).
Токообразующая реакция. Уравнение нернста.
В разомкнутом обратимом гальваническом элементе на фазовых границах образуется двойной электрический слой и устанавливается равновесие, которому соответствует равновесный скачок потенциала. Однако если замкнуть электроды проводником I рода (соединить металлической проволокой), равновесие нарушается.
Действительно, так как электрические потенциалы на концах электродов неодинаковы, электроны с более отрицательного электрода перемещаются на правый. Это нарушает равновесие в двойном электрическом слое отрицательного электрода, на котором окажется меньше электронов, чем нужно для равновесия, и положительного электрода, где окажется больше электронов. Чтобы восстановить равновесие, на границах фаз пойдут реакции, в результате которых на левом (отрицательном) электроде должны освобождаться электроны, а на правом (положительном) поглощаться.
Для элемента Zn|Zn2+||Fe2+, Fe3+|Pt, изображенного на рисунке 1:
на отрицательном электроде: Zn - 2е → Zn2+ |l
на положительном электроде: Fe3+ + е → Fe2+ |2
суммарная токообразующая
реакция Zn + 2Fe3+→ Zn2+ + 2Fe2+
Таким образом, за счет химической реакции:
Zn + 2Fe3+→ Zn2+ + 2Fe2+ или Zn + 2FeCl3 → ZnCl2 + 2FeCl2
электроны непрерывно движутся по проволоке, соединяющей электроды, т. е. совершается электрическая работа.
Реакция, за счет которой в гальваническом элементе совершается электрическая работа, называется потенциалобразующей (или токообразующей).
Электродвижущие силы обратимых гальванических элементов можно рассчитать по уравнению Нернста, которое легко вывести, если применить к электрохимической системе закон термодинамики.
Пусть в гальваническом элементе протекает токообразующая реакция:
v1A+ v2B → v3C+ v4D,
за счет которой совершается электрическая работа (Аэл). Согласно второму закону термодинамики, если в системе при Р, Т = const, кроме работы расширения, совершается электрическая работа, то при равновесии изменение свободной энергии системы (∆G) и Аал связаны соотношением:
∆G = -Аэл, (1)
т. е. электрическая работа, произведенная элементом в условиях равновесия, равна убыли свободной энергии системы в процессе токообразующей реакции.
Если в электродных реакциях на правом и левом электродах участвуют по п электронов:
v1A + пе→ v3C |l
v2B – пе → v4D |l
____________________
v1A+ v2B →v3C + v4D,
тогда электрическая работа, совершающаяся в гальваническом элементе при превращении v1 моль А и моль v2 В в моль v3 С и в моль v4 D, есть работа по перемещению nF кулонов электричества с левого электрода на правый, разность потенциалов между которыми по определению равна электродвижущей силе элемента Е, т. е.
Аэл = qE = nFE. (2)
Учитывая (1), получаем:
AG = -nFE. (3)
Согласно уравнению изотермы химической реакции, убыль свободной энергии системы (AG) при протекании токообразующей реакции v1 A + v2 B →v3C + v4D определяется выражением:
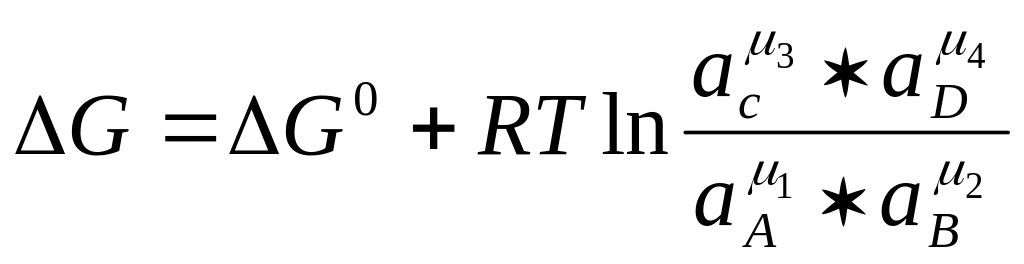 ,
(4)
,
(4)
где аА, ав, ac, aD — активности участников реакции.
Сравнивая (3) и (4), легко получить уравнение Нернста, позволяющее рассчитать э. д. с. Гальванического элемента:
![]() ,
(5)
,
(5)
где Е° =
![]() стандартная
электродвижущая сила элемента.
стандартная
электродвижущая сила элемента.
