
- •Тверской государственный технический университет
- •Электродвижущие силы. Теоретическая часть.
- •Скачок потенциала на границе металл/раствор.
- •Гальванический элемент
- •Токообразующая реакция. Уравнение нернста.
- •Вычисление термодинамических параметров токообразующей реакции.
- •Электродные потенциалы.
- •Классификация обратимых электродов.
- •Измерение электродвижущих сил.
- •Ионометрия.
- •Потенциометрическое титрование.
- •Лабораторная работа № 25. Измерение температурного коэффициента э.Д.С. Гальванического элемента и расчет термодинамических величин.
- •Теоретическое обоснование.
- •Порядок выполнения работы.
Классификация обратимых электродов.
По свойствам веществ, участвующих в потенциалопределяющих процессах, принята следующая классификация электродов: электроды первого и второго рода, газовые, окислительно-восстановительные (редокс-электроды) и ионообменные.
Электроды первого рода. К ним относятся в первую очередь металлические электроды, обратимые относительно катионов (в том числе амальгамные), и неметаллические, обратимые относительно анионов.
Уравнение токообразующей реакции на электродах, обратимых относительно катионов Ме|Мега+:
Меn+ + ne ↔ Me.
Электродный потенциал по водородной шкале согласно (14) и с учетом того, что активность твердого вещества при данной температуре постоянна и равна 1,
![]() .
(17)
.
(17)
Амальгамные электроды состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла Меn+|Ме, Hg. С использованием амальгамы удалось сконструировать обратимые электроды на основе щелочных металлов, которые не способны сосуществовать с водными растворами.
Для неметаллических электродов, обратимых относительно аниона: А|Аn- (например, Se|Se2-), уравнение токообразующего процесса:
А + пе ↔Аn-.
Следовательно, в соответствии с (15) и с учетом того, что аД = 1, выражение для электродного потенциала:
![]() .
(18)
.
(18)
К электродам первого рода относят также некоторые газовые электроды, состоящие из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого элемента. Металл в газовых электродах необходим для создания электронопроводящего контакта между газом и раствором, но должен быть инертен по отношению к потенциалопределяющим веществам. Примером такого электрода является водородный электрод (Pt)H2|H+, представленный на рисунке 2. Водородный электрод применяется в лабораторной практике в качестве эталона при измерении рН и стандартизации буферных растворов. Как уже отмечалось, относительно нормального водородного электрода, потенциал которого условно принят равным нулю, установлены стандартные потенциалы других электродов.
Электроды второго рода. Электроды II рода представляют собой металл, покрытый слоем труднорастворимого соединения этого металла (соли, оксида, гидроксида) и погруженный в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла:
Аn-|МеА, Me.
В токообразующей реакции на таком электроде принимают участие как катионы, так и анионы. Электрохимический процесс
Меn+ + пе ↔Me
сопровождается химической реакцией:
МеА ↔ Меп+ + Аn-.
Следовательно, суммарное уравнение токообразующего процесса:
МеА + пе↔ Me + An-
Учитывая, что аМеA=aMe=1, этой реакции в соответствии с (5) соответствует следующее уравнение для расчета электродного потенциала:
![]() (19)
(19)
Электрод второго рода можно рассматривать как электрод первого рода, обратимый относительно катиона, у которого активность ионов Меn+ в растворе определяется растворимостью МеА. Покажем это на примере хлорсеребряного электрода.
Хлорсеребряный электрод. Хлорсеребряный электрод представляет собой серебряный электрод, покрытый слоем труднорастворимого хлорида серебра и погруженный в насыщенный раствор хлорида серебра и хлорида калия (рис. 3).
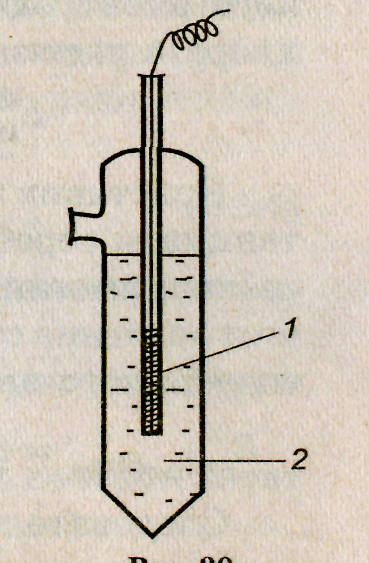 Рис. 3
Рис. 3
Хлорсеребряный электрод
1 — серебряная проволока, покрытая AgCl; 2 — насыщенный раствор AgCl и КСl.
Электрохимическая схема хлорсеребряного электрода:
Ag+,Cl -|AgCl,Ag.
Но так как активность ионов металла (aAg) в растворе его труднорастворимой соли в присутствии соли, содержащей тот же анион, ничтожно мала, ее обыкновенно не включают в электрохимическую схему электрода:
Cl-|AgCl,Ag.
На электроде протекает электрохимический процесс
Ag+ + e ↔Ag,
в соответствии с которым
![]() .
(20)
.
(20)
Однако в насыщенном растворе труднорастворимого AgCl существует равновесие:
AgCl ↔Ag+ + Cl-,
поэтому произведение активностей ионов Ag+ и Сl- является константой при постоянной температуре
![]()
Подставляя значение активностей ионов Ag+, выраженное через произведение растворимости (LAgCl) в уравнение (20), имеем:
![]() .
(21)
.
(21)
В полученном уравнении (21) два первых слагаемых есть величина постоянная, которая представляет собой стандартный электродный потенциал хлорсеребряного электрода, т. е. потенциал при активности ионов хлора в растворе, равной 1:
![]() .
(22)
.
(22)
Подставив в это уравнение значение электродного потенциала серебряного электрода Ag+|Ag и произведения растворимости хлорида серебра LAgcl при t = 25°C, получим значение стандартного электродного потенциала хлорсеребряного электрода:
![]()
Следовательно, уравнение, определяющее электродный потенциал хлорсеребряного электрода:
![]() .
.
или, при t =; 25°С,
.
![]() .
(5.23)
.
(5.23)
Если при изготовлении хлорсеребряного электрода используют насыщенный раствор хлорида калия, то в соответствии с (5.23) при t = 25°C электродный потенциал ECl- AgCl,Ag=0,220 В.
Вследствие устойчивости потенциалов электроды II рода могут быть использованы как электроды сравнения при потенциометрических измерениях.
Окислительно-восстановительны электроды. Окислительно-восстановительные (редокс-) электроды представляют собой инертный металл (платина, золото, иридий), погруженный в раствор, содержащий ионы, участвующие в окислительно-восстановительной реакции. Причем металл не участвует непосредственно в электродной реакции, но только обменивается электронами с участниками окислительно-восстановительного процесса.
Редокс-электроды отличаются от рассмотренных тем, что окисленная и восстановленная формы вещества находятся в одном растворе, а не выделяются на границах фаз.
В общем виде электродная реакция на таком электроде выглядит как
Ох + пе ↔ Red.
Потенциал окислительно-восстановительного электрода по водородной шкале определяется уравнением (14), которое для систем, характеризующихся равновесием Ох + пе↔ Red, может быть записано так:
![]() (24)
(24)
где![]() —
стандартный окислительно-восстановительный
потенциал.
—
стандартный окислительно-восстановительный
потенциал.
Иногда в потенциалобразующей реакции участвуют ионы Н+ и молекулы Н2О.
Например, системе MnO4-, Mn2+, H+|Pt соответствует уравнение реакции:
МпО4- + 8Н+ + 5е → Мп2+ + 4Н2О.
уравнение электродного потенциала (при аH0 =1):
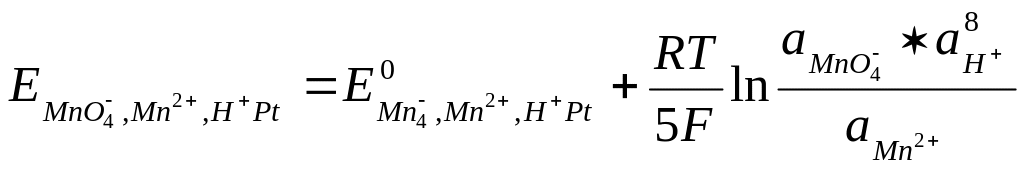 .
(25)
.
(25)
Потенциал таких электродов зависит от активности ионов Н+. Это позволяет использовать некоторые окислительно-восстановительные электроды (например, хингидронный) как индикаторные при потенциалометрических определениях рН растворов.
Ионообменные электроды. Ионообменный электрод состоит из ионита и раствора. Скачок потенциала на границе раздела фаз возникает за счет ионообменных процессов между ионитом и раствором.
Предположим, что ионит содержит ионы А+, способные к обмену с ионами В+, находящимися в растворе:
A+ионит + B+раствор↔ A+ раствор + B+ ионит.
При установившемся равновесии обменного процесса поверхность ионита и раствор приобретают электрические заряды противоположного знака, на границе ионит/раствор возникает двойной электрический слой, которому соответствует скачок потенциала. Поскольку иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, ионообменные электроды называют также ионоселективными. Важнейшим среди этой группы электродов является стеклянный электрод, который применяется для определения рН растворов. В настоящее время с использованием стекол специального состава и различных ионитов разработаны ионоселективные электроды, потенциал которых зависит от активности только одного вида ионов. Такие электроды применяются в потенциометрии для определения содержания в растворах многих катионов и анионов.
Концентрационные гальванические элементы (цепи). Концентрационные элементы составлены из двух качественно одинаковых полуэлементов — электродов любого рода, различающихся активностью ионов или веществ, участвующих в потенциалобразующем процессе.
Например, для элемента:
Ag│Ag+║Ag+│Ag (26)
c1 c2
на отрицательном электроде протекает окислительный процесс, а на положительном — восстановительный:
(-) Ag - e →Ag+(лев)
(+) Ag+(пp) + e → Ag
__________________
Ag+(пp) →Ag+(лев)
При суммировании уравнений электродных реакций получаем уравнение процесса, протекающего в гальваническом элементе, из которого ясно, что в концентрационном элементе химическая реакция не протекает. Электрическая работа совершается за счет процесса выравнивания концентраций потенциалобразующих ионов. Стандартная э. д. с. концентрационного элемента равна 0 (Е° = Е0Ag+|Аg - Е0Ag+|Аg=0),тогда в соответствии с уравнением Нернста для элемента (26) имеем:
 (27)
(27)
или, заменив активность иона на среднеионную активность электролита,
![]()
где а±2, a±1— среднеионная активность растворов правого и левого электродов.
Концентрационные гальванические элементы можно составить из амальгамных электродов, отличающихся концентрацией вещества в амальгаме, или газовых с различными давлениями реагирующего газа.
