
- •Тверской государственный технический университет
- •Электродвижущие силы. Теоретическая часть.
- •Скачок потенциала на границе металл/раствор.
- •Гальванический элемент
- •Токообразующая реакция. Уравнение нернста.
- •Вычисление термодинамических параметров токообразующей реакции.
- •Электродные потенциалы.
- •Классификация обратимых электродов.
- •Измерение электродвижущих сил.
- •Ионометрия.
- •Потенциометрическое титрование.
- •Лабораторная работа № 25. Измерение температурного коэффициента э.Д.С. Гальванического элемента и расчет термодинамических величин.
- •Теоретическое обоснование.
- •Порядок выполнения работы.
Вычисление термодинамических параметров токообразующей реакции.
Измеряя э. д. с. гальванического элемента при разных температурах, можно рассчитать термодинамические параметры реакции, протекающей в гальваническом элементе:
1) стандартный изобарный
потенциал —
![]()
2) константу равновесия —![]() ;
;
3) тепловой эффект реакции — ∆H;
4) изменение энтропии — ∆S.
Как рассчитать и . Стандартный изобарный потенциал (∆G°) реакции, протекающей в гальваническом элементе, связан со стандартной э. д. с. (Е°) этого элемента соотношением:
∆G° = -nFE°. (6)
С другой стороны, как следует из уравнения изотермы химической реакции,
∆G° = -RTlnKa. (7)
Следовательно, nFE° = RTlnKa.
![]() (8)
(8)
Как рассчитать ∆Н и ∆S. Подставив в уравнение Гиббса-Гельмгольца
![]() (9)
(9)
вместо ∆G его выражение (3), получим
![]()
![]() .
(10)
.
(10)
Принимая во внимание, что
∆G° = H- T∆S°
![]() (11)
(11)
Или
![]() (12)
(12)
Таким образом, измеряя Е при различных температурах, можно рассчитать тепловой эффект и изменение энтропии токообразующей реакции.
Электродные потенциалы.
Измерить абсолютное значение отдельного электродного потенциала невозможно. Можно определить только относительные величины, характеризующие электродные потенциалы. Для этого измеряют э. д. с. элемента, составленного из данного электрода и электрода, потенциал которого условно считают равным нулю.
Для электродов, в состав которых входят водные растворы электролитов, в качестве стандарта обычно выбирают нормальный водородный электрод, электродный потенциал которого условно принят за нуль при любой температуре. Эта условная шкала потенциалов называется водородной шкалой.
Водородный электрод — газовый электрод, обратимый относительно катиона Н+. Схема его изображена на рисунке 2. Нормальным называют водородный электрод, который работает при давлении водорода в газовой фазе, равном 1 атмосфере, и активности ионов Н+ в растворе, равной 1.
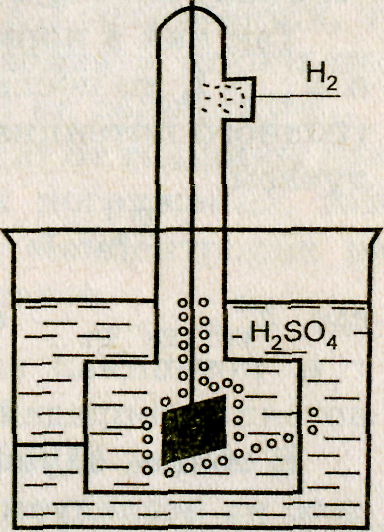
Рис. 2
Электродным потенциалом по водородной шкале называют э. д. с. элемента, составленного из этого электрода (справа) и нормального водородного электрода (слева) при условии, что диффузионный потенциал устранен.
Электродный потенциал может быть величиной положительной или отрицательной. Если в паре с нормальным водородным электродом стоит электрод более положительный, то его потенциал считают положительным, если более отрицательный, то отрицательным.
Например, для редокс-электрода Fe2+, Fe3+|Pt электродный потенциал есть э. д. с. элемента:
(Pt) H2 | Н+ || Fe3+, Fe2+||Pt,
в котором протекает токообразующая реакция:
Н2 - 2е →2Н+ |1
Fe3+ + е → Fe2+ | 2
_____________________
Н2 + 2Fe3+ → 2Н+ + 2Fe2+
Электродвижущая сила данного элемента, по уравнению Нернста ,
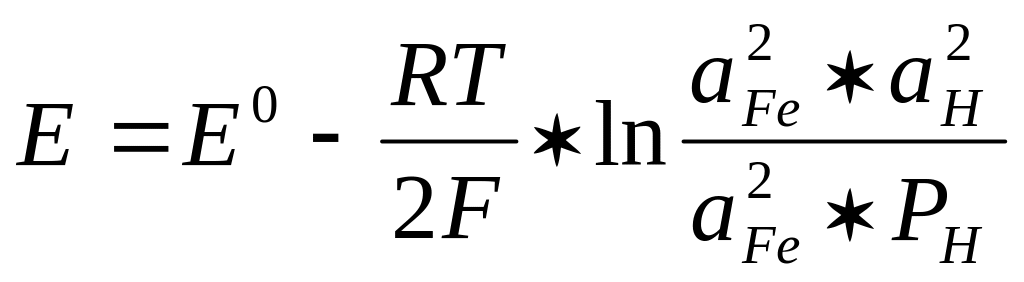 ,
(13)
,
(13)
где![]() —
стандартная э. д. с. элемента, которую
можно принять равной стандартному
потенциалу исследуемого электрода,
поскольку
—
стандартная э. д. с. элемента, которую
можно принять равной стандартному
потенциалу исследуемого электрода,
поскольку
![]() =
0. Так как в нормальном
водородном электроде PH=1
и aH=1,
то после несложных преобразований для
электродного потенциала исследуемого
редокс-электрода получаем:
=
0. Так как в нормальном
водородном электроде PH=1
и aH=1,
то после несложных преобразований для
электродного потенциала исследуемого
редокс-электрода получаем:
(14)
где— стандартный электродный потенциал, т. е. потенциал электрода, в котором активности всех потенциалопределяющих ионов равны 1.
В общем случае, если потенциалопределяющий процесс на исследуемом электроде:
v1 А1+ v2 А2→ v3 А3+ v4 А4,
то, чтобы получить выражение для электродного потенциала по водородной шкале, достаточно записать для электродной реакции уравнение Нернста:
 (15)
(15)
и принять активности воды и индивидуальных веществ, находящихся в твердой фазе, равными 1 (аАтв = 1а(H2O)=1).
Стандартные электродные потенциалы по водородной шкале определены для большинства электродов и приведены в справочной литературе, где они сведены в таблицы и расположены по возрастающему положительному значению. Этот электрохимический ряд включает и ряд напряжений металлов.
Величины электродных потенциалов и порядок расположения стандартных электродных потенциалов в электрохимическом ряду зависят от температуры и природы растворителя, в котором находятся потенциал определяющие ионы.
По значениям электродных потенциалов положительного (Е+) и отрицательного (Е-) электродов можно рассчитать электродвижущую силу (Е) элемента, составленного из этих электродов, если диффузионный потенциал устранен:
Е = Е+ - Е-. (16)
Если диффузионный потенциал (EД) сохраняется, то величина электродвижущей силы элемента отличается от рассчитанной по уравнению (16) на величину EД.
Электродные потенциалы не зависят от толщины пластинки металла или от глубины их погружения, зато заметно меняются в зависимости от концентрации растворов, находящихся с ними в контакте.
