
- •Частные случаи первого закона термодинамики для изопроцессов-
- •Гетерогенные реакции -это хим. Реакции с участием в-в, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
- •Правила составления ионных уравнений реакций-
- •Степень гидролиза
- •Измерение потенциалов
- •Вывод уравнения Нернста
- •Металлы и их физические свойства
- •Металлы и их химические свойства
Правила составления ионных уравнений реакций-
- Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют.
- В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
- Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
- Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
6-11) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают.Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион);
гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз (в реакцию с водой вступает и катион, и анион);
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции.
7-1) Степень окисления — условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд l-. Неполярная ковалентная связь между одинаковыми атомами дает вклад в степень окисления:
При пользовании степенями окисления полезно придерживаться следующих правил:
1) сумма степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю;
2) в соединениях фтор всегда проявляет степень окисления -1;
3) степень окисления кислорода в соединениях обычно равна -2 (кроме ОF2, Н2О2 и др.);
4) степень окисления водорода равна +1 в соединениях с неметаллами и -1 в соединениях с металлами (КН, СаН2).
Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления - минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Понятие степени окисления введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому следует помнить, что в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
Совсем формальным понятие степени окисления становится, когда оно используется при рассмотрении ковалентного соединения.
7-2)Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окислении вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части.
Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента.
Типичные окислители:
F2, Cl2, Br2, I2, O2, H2SO4, HNO3,
MnO2, KMnO4, K2CrO4, NaClO.
Типичные восстановители:
Н2, C, металлы, Н2S, CO, SO2, HI, FeSO4.
Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
Например, окислительно-восстановительную двойственность проявляют все неметаллы (кроме фтора и кислорода), нитриты, сульфиты, некоторые сложные вещества:
+4 +3 SO2, HNO2
7-3)Виды окислительно-восстановительных реакций.
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
7-4) Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Метод полуреакций применим для составления уравнений только таких окислительно-восстановительных процессов, которые протекают в растворах. Однако он имеет ряд преимуществ по сравнению с методом электронного баланса. В частности, при его использовании нет необходимости определять степени окисления элементов, кроме того, учитывается роль среды и реальное состояние частиц в растворе.
1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель.
2. Составляют полуреакции окисления и восстановления:
3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:
Если коэффициенты кратны друг другу, их следует уменьшить, поделив каждый на наибольшее общее кратное. Если коэффициенты нечетные, а формула хотя бы одного вещества содержит четное количество атомов, то коэффициенты следует удвоить.
4. Записывают суммарную реакцию электронного баланса. При этом количество принятых и отданных электронов должно быть одинаковым и должно сократиться на данном этапе уравнивания.
5. Расставляют коэффициенты в молекулярном уравнении реакции и вносят недостающие вещества. При этом коэффициенты перед веществами берутся из суммарной реакции электронного баланса, а атомы остальных элементов уравнивают обычным способом, соблюдая следующую последовательность:
– атомы металлов;
– атомы неметаллов (кроме кислорода и водорода);
– атомы водорода;
– атомы кислорода.
7-5) При уравнивании реакций методом ионно-электронных уравнений соблюдают следующую последовательность действий:
1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель.
2. Записывают ионную схему реакции. При этом сильные электролиты записываются в виде ионов, а слабые электролиты, нерастворимые и малорастворимые вещества, а также газы оставляют в молекулярном виде.
3. Составляют уравнения ионных полуреакций. Для этого сначала уравнивают количество частиц, содержащих атомы элементов, изменявших свои СО.
4. Балансируют количество принятых и отданных электронов так, как это описано в методе электронного баланса.
5. Записывают суммарную реакцию ионно-электронного баланса.
6. Расставляют коэффициенты в молекулярном уравнении реакции:
Расчет молярных эквивалентных масс МЭ окислителя или восстановителя в ОВР следует осуществлять по формуле
МЭ
=
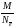
где М – молярная масса вещества, г/моль; Nē – число электронов, участвующих в процессе окисления или восстановления.
7-6)Направление протекания ОВР. Возможность и полнота самопроизвольного протекания ОВР в изобарно-изотермических условиях, как и любого химического процесса, может быть оценена по знаку изменения свободной энергии Гиббса системы G в ходе процесса. Самопроизвольно при Р, Т = = const в прямом направлении могут протекать реакции, для которых G < 0.
Изменение энергии Гиббса окислительно-восстановительного процесса также равно электрической работе, которую совершает система по перемещению электронов от восстановителя к окислителю, то есть
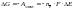
где Е – ЭДС окислительно-восстановительного процесса, В; F – постоянная Фарадея (F = 96 485 96 500 Кл/моль); nē – число электронов, участвующих в данном процессе.
Из уравнения вытекает, что условием самопроизвольного протекания ОВР в прямом направлении является положительное значение ЭДС окислительно-восстановительного процесса (Е > 0). Расчет ЭДС ОВР в стандартных условиях следует вести по уравнению
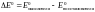
где
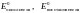 - стандартные окислительно-восстановительные
потенциалы систем.
- стандартные окислительно-восстановительные
потенциалы систем.
8-1)Электрохимическая система
Электрохимическая система - система: - состоящая из двух электродов и находящегося с ними в контакте проводника второго рода (электролита); - в которой могут протекать как минимум одна электрохимическая реакция окисления и одна электрохимическая реакция восстановления вещества.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
