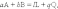- •Частные случаи первого закона термодинамики для изопроцессов-
- •Гетерогенные реакции -это хим. Реакции с участием в-в, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
- •Правила составления ионных уравнений реакций-
- •Степень гидролиза
- •Измерение потенциалов
- •Вывод уравнения Нернста
- •Металлы и их физические свойства
- •Металлы и их химические свойства
1-1)Химия есть наука о веществах, их свойствах и превращениях.
Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Атом - это частица, состоящая из положительно заряженного ядра атома и отрицательно заряженных электронов.
Вещество - это определенная совокупность атомных и молекулярных частиц, их ассоциатов и агрегатов, находящихся в любом из трех агрегатных состояний. Простые вещества - это вещества, состоящие из атомов одного и того же химического элемента. Сложные вещества состоят не из простых веществ, а из элементов, Например, углекислый газ СО2состоит не из простых веществ углерода и кислорода, а из элементов углерода и кислорода.
Масса вещества в граммах, численно равная его относительной молекулярной массе называется молем.
Относительная атомная масса- значение массы атома, выраженное в атомных единицах массы.
Относительная молекулярная масса, или сокращенно молекулярная масса - это единица количества вещества в химии.
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества или масса одного моля вещества
1-2) Авогадро закон: в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Число молекул в одном моле называют Авогадро числом. Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Закон парциальных давлений- общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси. Парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем.
Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона ) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
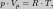
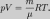
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
1-3) Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
Эквивалент - это часть молекулы (атома), которая реагирует с одним электроном или одним ионом водорода
Число эквивалентности вещества зависит от типа самой реакции.
Закон эквивалентов: во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Расчет молярной массы эквивалента вещества осуществляется по следующим правилам: 1. Химические элементы. Мэ = М / n Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность. 2. Кислоты и основания. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания. 3. Соли и оксиды. Мэ = М / (N * n) Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона. 4. Окислители и восстановители. Мэ = М / n Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя.
2-1) Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой.
Гипотеза де Бройля заключается в том, что французский физик Луи де Бройль выдвинул идею приписать волновые свойства электрону. Проводя аналогию между квантом, де Бройль предположил, что движение электрона или какой-либо другой частицы, обладающей массой покоя, связано с волновым процессом. Гипотеза де Бройля устанавливает, что движущейся частице, обладающей энергией E и импульсом p, соответствует волновой процесс, частота которого равна:
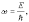
а длина волны:
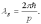
где p - импульс движущейся частицы.
-В. Гейзенбергом был предложен принцип неопределенности, согласно которому для микрочастиц невозможно одновременно точно определить и координату частицы X, и составляющую рх импульса вдоль оси х. Математически принцип неопределенности записывают следующими уравнениями:
ΔxΔpx ≥ h;
ΔxΔpy ≥ h;
ΔxΔpz ≥ h.
Отсюда следует, что при точном определении координаты х микрочастицы исчезает информация о ее импульсе Δpx, так как при х=0 величина Δpx→∞. Если удастся снизить погрешность Δp,то будет велика погрешность Δх. Источник этих погрешностей заключен не в приборах, а в самой природе вещей.
2-2) Для описания свойств электрона используют волновую функцию, которую обозначают буквой Ψ (пси). Квадрат ее модуля |Ψ|2, вычисленный для определенного момента времени и определенной точки пространства, пропорционален вероятности обнаружить частицу в этой точке в указанное время. Величину |Ψ|2 называют плотностью вероятности.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнение второго закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы. Установлено Эрвином Шрёдингером в 1926 году.
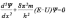
2-3) Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: и .
2-4) Принцип минимума энергии
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней такова: 1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s и так далее …
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства - т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Принцип Паули
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms).
Правило (Гунда) определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон.
Правило Клечковского- эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Заполнение
электронами орбиталей в атоме происходит
в порядке возрастания суммы главного
и орбитального квантовых чисел
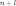 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
![]() .
.
При
заполнении орбитальных оболочек атома
более предпочтительны (более энергетически
выгодны), и, значит, заполняются раньше
те состояния, для которых сумма главного
квантового числа
и
побочного (орбитального) квантового
числа
![]() ,
т.е.
,
т.е.
 ,
имеет меньшее значение.
,
имеет меньшее значение.
2-5) Правило Клечковского имеет исключения. В отдельных случаях электроны, не закончив полное заселение s-атомных орбиталей, могут появиться на d-орбиталях или вместо 4f-атомных орбиталей заселять 5d-орбитали.
Например, у хрома и молибдена (VIБ-группа) на 4s- и 5s-атомных орбиталях, соответственно, имеется только по одному электрону, а остальные пять заполняют 3d- и 4d-атомные орбитали, так как наполовину заполненные d-подуровни имеют высокую устойчивость, и электронная конфигурация (n−1)d5ns1 оказывается для атомов хрома и молибдена более выгодной, чем (n−1)d4ns2.
Особо устойчив также целиком заполненный d-подуровень, поэтому электронной конфигурации валентных электронов атомов меди, серебра и золота (IБ-группа) (n−1)d10ns1 будет соответствовать более низкая энергия, чем (n−1)d9ns2.
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Современная периодическая система включает 109 химических элементов. В периодической системе существуют горизонтальные и вертикальные ряды химических элементов.
Период – это горизонтальный ряд химических элементов, расположенные в порядке возрастания заряда атомного ядра. Всего существует семь периодов. Различают малые и большие периоды химических элементов.
Малые периоды содержат один ряд химических элементов.
Большие периоды содержат по два ряда химических элементов.
Каждый период начинается со щелочного металла и заканчивается инертным газом. Группа – вертикальные ряды, химические элементы в которых имеют одинаковое количества электронов на внешнем энергетическом уровне.
Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомных орбиталей все элементы делятся на s,p,d и f семейства.
S и P химические элементы располагаются в главных подгруппах.
D элементы располагаются в побочных подгруппах.
F элементы – это химические элементы относящиеся к семейству актиноидов и лантаноидов а также побочной подгруппы третьей группы.
2-6) Энергия ионизации (мера проявления металлических свойств) — это энергия, необходимая для отрыва электрона от атома.
(Ca0—>Ca2+ + 2е- - дельта Н).
Чем больше электронов на внешнем электронном слое, тем больше энергия ионизации. С увеличением радиуса атома энергия ионизации уменьшается. Этим объясняется уменьшение металлических свойств в периодах слева направо и увеличение металлических свойств в группах сверху вниз. Цезий (Cs) — самый активный металл.
Энергия сродства к электрону - энергия, которая выделяется в результате присоединения электрона к атому (Сl0 + 1е- —> Сl- + дельта Н. С увеличением числа электронов на внешнем электронном слое энергия сродства к электрону увеличивается, а с увеличением радиуса атома — уменьшается. Этим объясняются увеличение неметаллических свойств в периодах слева направо и уменьшение неметаллических свойств в главных подгруппах сверху вниз.
Под электоотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Зависимость атомных радиусов от заряда ядра атома носит периодический характер. С увеличением заряда ядра атома в периодах проявляется тенденция к уменьшению размеров атома. Это объясняют увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. В пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Потеря электронов атомом приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов - к увеличению.
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра.
3-1) Химической связью называют взаимодействие, удерживающее атомы в молекулах и обуславливающее стабильность молекул в определенных условиях.
Основные характеристики химической связи:
Энергия связи (ЕСВ ) – минимальная энергия, необходимая для разрушения связи.
Измеряется в электрон-вольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь.
Длина связи (LСВ )– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) . Чем короче связь, тем она, как правило, прочнее.
Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – не насыщаема.
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то не направлена.
Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи.
3-2) Ковалентная связь — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяют реакционную способность молекул по отношению к полярным реагентам.
3-3) Способы образования ковалентной химической связи
Обменный механизм.
Каждый из взаимодействующих атомом отдает на образование химической связи по одному электрону. С развитием атомного учения химическая связь – это результат перекрывания атомных орбиталий. В межъядерном пространстве возникает зона повышенной электронной плотности. Возникают силы электростатического притяжения между ядрами и зоной повышенной электронной плотности.
Расстояние между ядрами атомов – это длина химической связи. Чем меньше длина тем больше прочность химической связи. Перекрывание атомных орбиталей не может быть бесконечным, т.к. возникает сила отталкивания между ядрами. Зона повышенной электронной плотности в обязательном порядке предполагает наличие двух электронов с противоположными спинами.
Донорно-акцепторный механизм. В природе веществ, образованных чистой химической связью мало. Одним из самых распространенных способов является донорно-акцепторный механизм. Точно также как и обменный донорно-акцепторный механизм предполагает наличие двух электронов в межъядерном пространстве. Однако в межъядерном пространстве пара электронов предоставляется только одним атомом – донором. Второй атом предоставляет вакантную атомную орбиталь . большинство соединений в природе имеют одну или несколько связей образованных по донорно-акцепторному механизму.
Дативный способ образования связей.
Его можно рассматривать как разновидность донорно-акцепторного механизма. В этом случае каждый из взаимодействующих атомов является донором и акцептором.
3-4) Метод валентных связей– метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
В основе метода ВС лежат следующие положения:
-Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
-Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3-5) Гибридизация атомных орбиталей. Геометрическая форма частиц
Перекрывание атомных орбиталей при формировании двухатомных молекул АВ (А и В - атомы одного или разных элементов) ведет к линейной геометрической форме молекул (Н−Н, F−F, H−Cl).
Образование химических связей в многоатомных молекулах ведет к изменению формы и расположения орбиталей в пространстве у того атома, который образует две или более связей (атом А в частицах AВn), поскольку, в многоатомных частицах происходит гибридизация орбиталей центрального атома А (по теории, разработанной Л. Полингом в 1931 г.).
Типы гибридизации атомных орбиталей центрального атома определяют геометрическую форму частиц (молекул, ионов) AВn.
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
- находят центральный атом и определяют число σ-связей (по числу концевых атомов);
- определяют степени окисления атомов в частице;
- составляют электронную конфигурацию центрального атома в нужной степени окисления;
- если это необходимо, проделывают то же самое для концевых атомов;
- изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально спаривают электроны;
- отмечают орбитали, участвующие в образовании связей с концевыми атомами;
- определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
- по типу гибридизации определяют геометрию химической частицы.
3-6) Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
3-7) Неполярные диэлектрики. К этому классу диэлектриков относятся вещества, состоящие из атомов и молекул, не обладающих собственными дипольными моментами в отсутствии поля. Типичными примерами таких веществ являются одноатомные благородные газы; газы, состоящие из симметричных двухатомных молекул – кислород, водород, азот; различные органические жидкости масла, бензины; из твердых тел – пластмассы. Полярные диэлектрики. Молекулы обладающие собственным дипольным моментом даже в отсутствии внешнего электрического поля называются полярными, а диэлектрики, образованные такими молекулами – полярными диэлектриками. Полярные молекулы несимметричны, электронные плотности в них смещены к одному из атомов. Типичным примером такой молекулы служит молекула воды H2O, в которой электронные облака смещены к атому кислорода, вследствие чего центры положительных и отрицательных зарядов смещены друг относительно друга, поэтому молекула обладает собственным дипольным моментом. 3-8) Ионная связь-Химическая связь, основанная на электростатическом притяжении ионов.
Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов (Δχ > 2 ), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов.
Свойства: В отличие от ковалентной связи ионная связь не обладает насыщаемостью. Прочность ионных связей. Вещества с ионными связями в молекулах, как правило, имеют более высокие температуры кипения и плавления.
3-9) Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Свойства: обладают высокой электро- и теллопроводностью, имеют металлический блеск, пластичны (их можно ковать, деформировать без разрушения металлической связи). Большинство металлов твёрдые, причём температура плавления напрямую связана с прочностью или особенностями металлической связи.
3-10) Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
3-11)Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами.
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания (взаимодействие молекул между собой). Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей.
Основу ван-дер-ваальсовых сил также составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают любому виду химической связи. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
4-1) Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы.
Энтропи́я в естественных науках — мера беспорядка системы, состоящей из многих элементов.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Теплота-форма беспорядочного движения образующих тело частиц; количественной мерой теплоты служит количество теплоты, т. е. количество энергии, получаемой или отдаваемой системой при теплообмене.
4-2) Первый закон термодинамики
Первый закон термодинамики определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
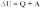
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
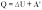
Частные случаи первого закона термодинамики для изопроцессов-
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
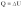
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
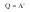
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
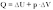
Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
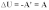
4-3)Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами.
Закон Гесса — основной закон термохимии: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции
- Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
- Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
- Если начальное и конечное состояния химической реакции совпадают, то ее тепловой эффект равен нулю.
4-4) Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения ее частиц.
Второй Закон Термодинамики, как и Первый (Закон сохранения энергии) установлен эмпирическим путем. Впервые его сформулировал Клаузиус: "теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении". Другая формулировка: все самопроизвольные процессы в природе идут с увеличением энтропии.
В
виде формулы второй закон термодинамики
записывают так: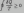
4-5) Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции. G=U+pV-TS
G<0 реакция в прямом направлении
G>0 в обратном
G=0 и в прямом и в обратном
Энтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|.
5-1) Скорость и механизм химических процессов составляют основу химической кинетики. Формальная кинетика позволяет количественно описать ход химического процесса во времени при постоянной температуре в зависимости от концентрации реагирующих веществ и их фазового состава.
Скорость гомогенной химической реакции определяется по изменению концентрации любого из реагирующих веществ в единицу времени. Обычно концентрации выражают в моль/л, а время в секундах. Например, скорость реакции
|
|
|
может быть, с одной стороны, определена по убыли веществ A или В, а с другой стороны, по приращению продуктов реакции L и Q.
Согласно основному закону химической кинетики - закону Аррениуса - скорость химической реакции никогда не обращается в нуль. Она только экспоненциально падает с понижением температуры. Следовательно, как бы низка ни была начальная температура смеси - эта смесь все равно должна прореагировать за достаточно длительный промежуток времени
5-2)Константа скорости реакции - является коэффициентом пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
5-3) Химические реакции можно классифицировать по числу молекул, участвующих в каждом элементарном химическом акте. Мономолекулярными называются реакции, в которых такой акт представляет собой химическое превращение одной молекулы (изомеризация, диссоциация и пр.). Бимолекулярные реакции такие, элементарный акт которых осуществляется при столкновении двух молекул (различных или одинаковых). В тримолекулярных реакциях элементарный акт осуществляется при столкновении трёх молекул.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Для элементарных реакций порядок реакции - целочисленная величина, совпадающая с молекулярностью реакции. Для всех других (не элементарных, сложных) реакций их порядки МОЖНО ОПРЕДЕЛИТЬ ТОЛЬКО ЭКСПЕРИМЕНТАЛЬНО. Причем они могут иметь как целочисленные, так и дробные и (даже нулевое!) значение. В реальных кинетических исследованиях редко встречается порядок реакции выше третьего.
5-4) В случае гетерогенной реакции, т.е. реакции, происходящей на границе раздела фаз между реагентами, находящимися в разных агрегатных состояниях (твердое-жидкое, твердое-газообразное и т.п.), количество реагирующего вещества относят к единице площади S межфазной поверхности:
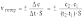
Для сложной реакции, проходящей через несколько элементарных стадий, суммарная скорость определяется скоростью самой медленной стадии.
Лимитирующая стадия – стадия сложной реакции, изменение константы скорости которой оказывает максимальный эффект на скорость сложной реакции. Константа скорости лимитирующей стадии часто входит в явном виде в выражение для скорости образования продуктов.
5-5) Влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
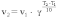
где g - температурный коэффициент, принимающий значения от 2 до 4.
Объяснение зависимости скорости реакции от температуры было дано С. Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц и вывел уравнение Аррениуса для константы скорости реакции: k = koe-E/RT,
где ko и E зависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
5-6) Энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
5-7)Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Для элементарной химической реакции:
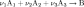
закон действующих масс может быть записан в виде кинетического уравнения вида:
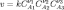
где
![]() —
скорость химической реакции,
—
скорость химической реакции,
![]() —
константа скорости реакции.
—
константа скорости реакции.
5-8)Гомогенные реакции- это хим. реакции, протекающие полностью в одной фазе.