
- •2) Закон эквивалентов.
- •Для простых веществ:
- •Ионная связь.
- •16) Скорость реакции.
- •Смещение равновесий.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Сильные электролиты.
- •24) Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Стаканчиковый
- •Аккумуляторы.
Сильные электролиты.
К сильным электролитам относится: минеральные кислоты (серная, соляная, азотная, фосфорная), гидроксиды щелочных и щелочноземельных металлов, металлы I, II группы ПСХЭ (водные растворы таких гидросксидов называются щелочами), большинство солей (имеют ионный тип связи и в узлах кристаллической решетки находятся ионы). Молекулы воды являются диполями (окружающиеся ионы ориентируясь отрицательным полюсом к катиону и положительным к аниону) тем самым разрушая ионную связь. Степень диссоциации таких соединений теоретически должна быть равна 100%, но концентрация ионов, которую можно обнаружить в растворе практическим путем (путем определения электропроводимости раствора) оказывается всегда меньшей, чем теоретически ожидаемая. Поэтому сильные электролиты принято характеризовать величиной (a) активной концентрации (активность).
Активная концентрация ионов – это концентрация ионов в растворе, которая фактически проявляется в определенной величине электропроводности раствора и в целом в химических взаимодействиях иона. Понижение активности по сравнению с заданной концентрации связано с тем, что ионы в растворе окружены противоионами, молекулами растворителя и при своем движении несут с собой так называемую ионную атмосферу. В связи с этим приготовив раствор определенной концентрации данного электролита, необходимо и возможно рассчитать активность металлов a=f·С, где f – коэффициент активности ионов, он зависит от природы растворителя и от концентрации раствора, то что активность иона всегда ниже их концентрации объясняется тем, что ион в растворе взаимодействует с другими ионами, с молекулами воды, окружающей ионной атмосферой, которая снижает его реакционную способность. Зависит от с f=f(С), как правило, f возрастает при снижении С, f=const, С – концентрация ионов в растворе
С(KCl)=1моль/л, С(K+)=1моль/л, С(Cl–)=1моль/л.
23)
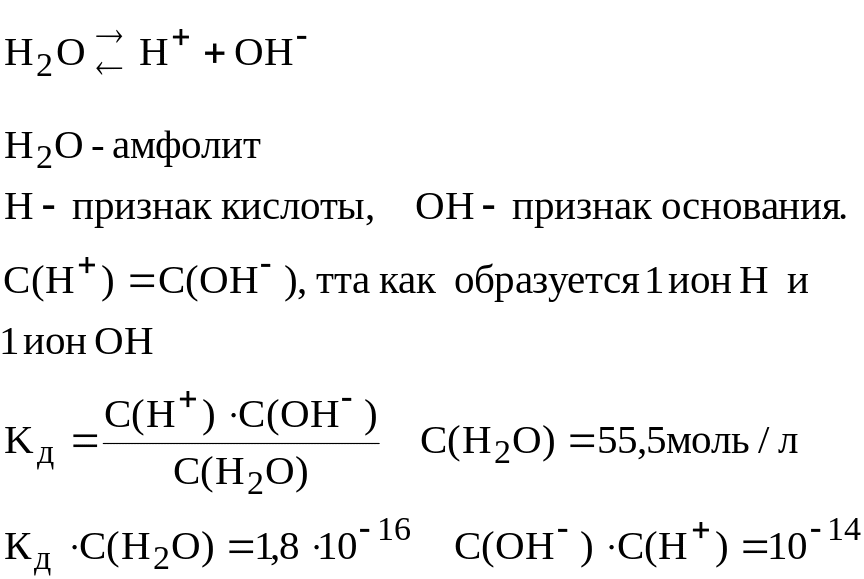
Произведение
концентрации ионов водорода и концентрации
гидродных групп называют ионным
произведением воды, для стандартных
условий есть величина постоянная, равная
10-14
![]()
Водородный показатель (pH)
pH= -lgC(H+) pH= -lg10-7
Если в воде растворить кислоту, равновесие смещается в сторону ассоциации, а ионное произведение воды остается постоянным.

Учитывая, что вода чаще всего используется в качестве среды для многих реакций, протекающих в природе, технике, быту и живых организмах принято говорить о кислой, щелочной и нейтральной реакции среды, характеризуя ее по значению pH. Величину pH можно определить электрохимическим путем с помощью потенциометра. Кроме того, величину pH можно определить с помощью кислотно-щелочных индикаторов- это органические соединения, окраска которых изменяется в зависимости от концентрации ионов водорода в водном растворе. К ним относятся: лакмус, фенолфталеин (бесцветный до pH=9, pH>9 – малиновый), метилоранж (желтый до pH>5, 3<pH<5 – оранжевый, pH<3 – красный). На практике используется универсальный кислотно-щелочной индикатор, с помощью которого pH можно измерить с точность до 1. Его окраска изменяется от красного до светло зеленого в нейтральной среде, и фиолетовый в щелочной среде. Частота этой окраски зависит от частоты вещества.
