
- •2) Закон эквивалентов.
- •Для простых веществ:
- •Ионная связь.
- •16) Скорость реакции.
- •Смещение равновесий.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Сильные электролиты.
- •24) Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Стаканчиковый
- •Аккумуляторы.
Энергетические эффекты при растворении.
Процессы растворения – физико-химические процессы. Их физическая частота заключается в том, что растворение связано с распределением структурных единиц одного вещества между структурными единицами другого. Для этого необходимы затраты энергии.
Теплосодержание (энтропия ) увеличивается, если
 >0,
H2>H1
,
>0,
H2>H1
,
 ;
;Химическая сторона при растворении имеет место взаимодействия между молекулами растворенного вещества и растворителя. Если растворитель вода он называется гидротацией.
![]()
Электролитическая диссоциация.
Законы Рауля не соблюдаются для растворов кислот, оснований и солей.
Пример: если приготовить одномолярный раствор KCl, то температура его замерзания будет приблизительно равна –3,5˚С (должна быть равна -2˚С).
На практике оказывается, что
![]() ,
где
,
где
i-изотонический коэффициент.
Такую аномалию можно объяснить только тем, что число частиц растворенных между структурными единицами растворителя почти в два раза выше, чем число молекул KCl. На основании этого шведский ученый Аррениус предположил, что при растворении в воде кислот, оснований и солей их молекулы распадаются, то есть диссоциируют на ионы, что легло в основу теории электролитической диссоциации.
Электролитическая диссоциация – это распад веществ на ионы под действием молекул растворителя.
![]()
Соединения способные к диссоциации называют электролитами, их водные растворы проводят электрический ток. Их называют проводники второго рода с ионной проводимостью.
Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
По величине степени
диссоциации электролиты делятся на
слабые
![]() и сильные
и сильные
![]() между 0,03 и 0,3 электролиты средней силы.
между 0,03 и 0,3 электролиты средней силы.
Степень диссоциации зависит от природы растворителя, от температуры раствора, от концентрации раствора.
Сильные электролиты.
К сильным электролитам относится: минеральные кислоты (серная, соляная, азотная, фосфорная), гидроксиды щелочных и щелочноземельных металлов, металлы I, II группы ПСХЭ (водные растворы таких гидросксидов называются щелочами), большинство солей (имеют ионный тип связи и в узлах кристаллической решетки находятся ионы). Молекулы воды являются диполями (окружающиеся ионы ориентируясь отрицательным полюсом к катиону и положительным к аниону) тем самым разрушая ионную связь. Степень диссоциации таких соединений теоретически должна быть равна 100%, но концентрация ионов, которую можно обнаружить в растворе практическим путем (путем определения электропроводимости раствора) оказывается всегда меньшей, чем теоретически ожидаемая. Поэтому сильные электролиты принято характеризовать величиной (a) активной концентрации (активность).
Активная концентрация ионов – это концентрация ионов в растворе, которая фактически проявляется в определенной величине электропроводности раствора и в целом в химических взаимодействиях иона. Понижение активности по сравнению с заданной концентрации связано с тем, что ионы в растворе окружены противоионами, молекулами растворителя и при своем движении несут с собой так называемую ионную атмосферу. В связи с этим приготовив раствор определенной концентрации данного электролита, необходимо и возможно рассчитать активность металлов a=f·С, где f – коэффициент активности ионов, он зависит от природы растворителя и от концентрации раствора, то что активность иона всегда ниже их концентрации объясняется тем, что ион в растворе взаимодействует с другими ионами, с молекулами воды, окружающей ионной атмосферой, которая снижает его реакционную способность. Зависит от с f=f(С), как правило, f возрастает при снижении С, f=const, С – концентрация ионов в растворе
С(KCl)=1моль/л, С(K+)=1моль/л, С(Cl–)=1моль/л.
21)
Кислоты – это электролиты в водных растворах, которых всегда присутствуют катионы H (протоны); это электролиты, которые диссоциируют катион водорода (H+ - HCl, HNO3, H2SO4) и анион кислотного остатка.
HCl→H++Cl-
HNO3→ H++ NO3-
Многоосновные кислоты (серная, фосфорная) диссоциируют ступенчато.
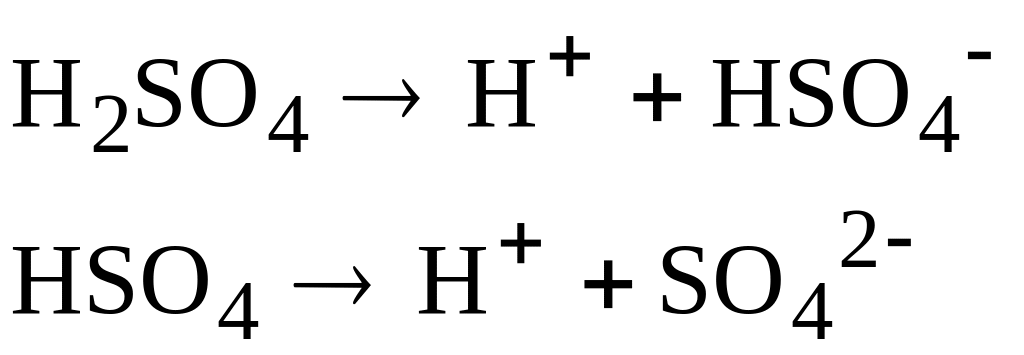
Кислыми считаются
растворы, в которых присутствуют катионы
водорода. Протоны в воде гидротируются
![]() с
образованием иона гидраксония.
с
образованием иона гидраксония.
2.
Основания
– это
электролиты, которые при диссоциации
образуют анион гидроксильной группы
OH-
и катион металла
![]() ;
это электролиты, в водных растворах
которых присутствуют анионогидраксильной
группы (OH
– гидроксильный анион) и катионы Me
(
;
это электролиты, в водных растворах
которых присутствуют анионогидраксильной
группы (OH
– гидроксильный анион) и катионы Me
(![]() ).
Растворы гидроксидов, щелочных и
щелочноземельных металлов называют
щелочами. В них всегда присутствует OH
и в целом водные растворы, в которых
присутствует гидроксид-ион, называют
щелочными.
).
Растворы гидроксидов, щелочных и
щелочноземельных металлов называют
щелочами. В них всегда присутствует OH
и в целом водные растворы, в которых
присутствует гидроксид-ион, называют
щелочными.
3. Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
 .
.
22)
