
- •2) Закон эквивалентов.
- •Для простых веществ:
- •Ионная связь.
- •16) Скорость реакции.
- •Смещение равновесий.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Сильные электролиты.
- •24) Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Стаканчиковый
- •Аккумуляторы.
Смещение равновесий.
Всякое равновесное состояние определяется постоянством условий (T, p, V, концентрации). Если изменить одно из этих условий, равновесие будет нарушено. Скорость прямой не равно скорости обратной реакции. Но с течением времени будет достигнуто новое состояние равновесия, т. е. скорость прямой равно скорости обратной реакции, но это будут другие скорости, Кр1= Кр2, изменятся равновесные концентрации (С1(A)≠C2(A)). Система из одного состояние равновесия перейдет в другое состояние равновесия (смещение равновесий). Поиск условий проведения реакции, при которых константы равновесия больше единицы, сводится к смещению равновесий. Для этого используется принцип Ле-Шателье. Если на систему, находящуюся в равновесии, оказывают воздействие (изменение концентрации, температуры, давления или объёма), то система увеличивает скорость тех процессов, которые направлены на снижение уровня произведенного на систему воздействия.
В настоящее время реакции проводятся с помощью катализатора. Катализатор – это вещество, которое увеличивает скорость реакции за счет образования промежуточных продуктов реакции (реакция проходит в несколько стадий, причем каждая стадия имеет меньшую энергетическую активацию). В продуктах реакции катализатор отсутствует. В результате реакция не изменяется, однако, его поверхность дезактивируется, и периодически проводят его регенерацию (восстанавливают активность катализатора).
Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в строну прямой реакции.
Катализаторы не влияют на положение равновесия.
19) Раствор - однородная смесь двух или более компонентов относительное содержание которых изменяется во всех объемных пределах и может изменятся в широких пределах.
1) Массовая доля растворённого вещества (ω(В), где В – формула растворённого вещества)

На практике можно измерить плотность любого раствора (ρ) используя ареометр.
![]()
2) Молярная концентрация.
![]()
3) Ковалентная концентрация
![]()
![]() -
моляльность.
-
моляльность.
Применение закона эквивалента для реакции идущих в растворах.
Пример: реакция нейтрализации: ее используют для определения содержания кислот или щелочей в различных жидких системах, путем определения их концентрации.
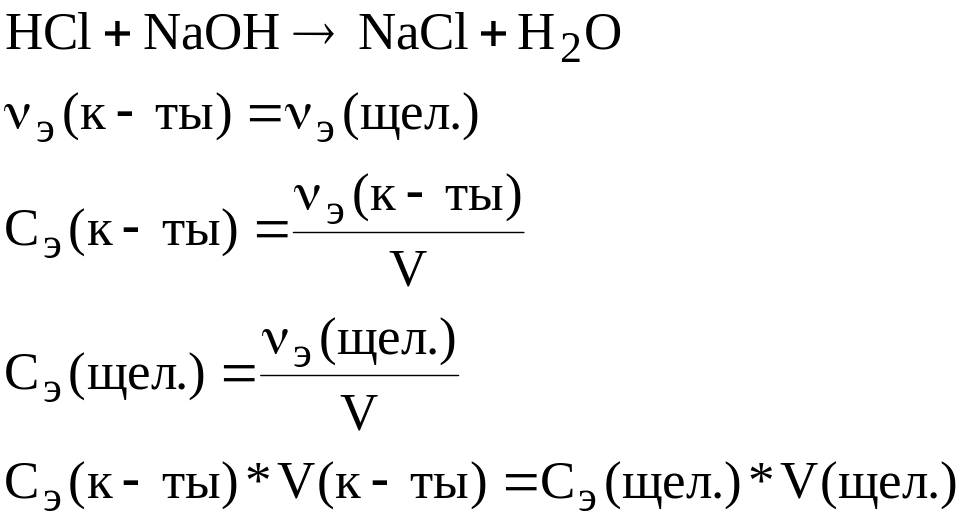
20)
Законы Рауля.
1.Тонаскапический закон: понижение давления (∆p) насыщенного пара над раствором по сравнению с чистым растворителем прямопропорционален числу моль растворенного вещества и обратно пропорционален количеству растворителя.
![]()
p0 – давление насыщенного пара над растворителем (например вода), p - давление насыщенного пара над раствором, n – количество растворенного вещества, N – количество растворителя.
2. Эбулиоскапический – повышение температуры кипения раствора по сравнению с чистым растворителем (∆T) прямопропорционально молярной концентрации раствора.
![]() ; T0
– температура
кипения чистого растворителя; T
– температура кипения раствора.
; T0
– температура
кипения чистого растворителя; T
– температура кипения раствора.
∆Tкип=Kэб Сm ; Kэб=const – эбулеотостатическая константа (справочная величина характерная для растворителя).
3. Криоскопический (крио-холод) – изменение температуры замерзания раствора по сравнению с чистым растворителем пропорционален молярной концентрации.
∆Tзам=Kкр
Сm ![]() T0
– температура
замерзания растворителя, T
– температура замерзания раствора.
T0
– температура
замерзания растворителя, T
– температура замерзания раствора.
Kкр=const – криоскопическая константа (справочная величина).
Изменение температуры замерзания в смеси веществ тепловые эффекты при смешивании веществ используются в технике для приготовления систем охлаждающих жидкости.
Эти законы соблюдаются для растворов, где между молекулами растворителя распределены молекулы растворенного вещества (молекулярный раствор) и они не соблюдаются для растворов кислот, щелочей и солей.
