
- •2) Закон эквивалентов.
- •Для простых веществ:
- •Ионная связь.
- •16) Скорость реакции.
- •Смещение равновесий.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Сильные электролиты.
- •24) Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Стаканчиковый
- •Аккумуляторы.
1) Вещество – каждый отдельный вид материи, обладающий, при данных физических условиях, определенной совокупностью физических свойств.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
Молекулярной массой - называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения.
Молярная масса вещества — масса одного моля вещества
Масса атомов – физическая величина являющаяся мерой его инерционных энергетических сил.
2) Закон эквивалентов.
![]()
Вещества взаимодействуют в эквивалентных количествах.
Эквивалентное
количество вещества
(![]() ,
моль) – это такое количество вещества,
которое в химических реакциях
взаимодействует с 1 моль атомов, ионов
или электронов водорода.
,
моль) – это такое количество вещества,
которое в химических реакциях
взаимодействует с 1 моль атомов, ионов
или электронов водорода.
![]()
![]()
Эквивалентная
масса вещества
(![]() )
– это масса 1 моль эквивалента вещества.
)
– это масса 1 моль эквивалента вещества.
Эквивалентные массы и объемы простых и сложных веществ.
Для простых веществ:
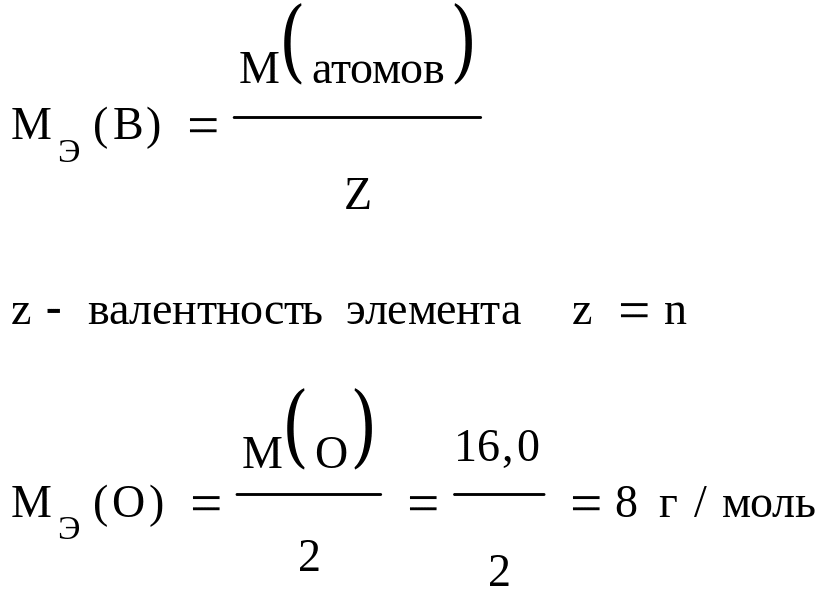
3) Это один из законов естествознания: в равных объёмах любых газов при одинаковых физических условиях содержится одинаковое число частиц (молекул или атомов, если простое вещество, как, например, He, Ar).
Этот закон применим также и для ионов и электронов ионизованных газов в том числе, если их концентрация не очень велика и воздействием внешних электрических и магнитных полей можно пренебречь.
Позднее (в середине 1850-х годов) Жераром получены следствия из закона Авогадро, на основании которых он предложил метод определения молекулярных масс независимо от химического состава молекул газообразных веществ.
Первое следствие: грамм-молекулы любых газов имеют равный объем при одинаковых физических условиях. Молярный объем газа при нормальных условиях (0°С, 760 мм рт. ст.):
![]()
Второе следствие: молекулярная масса газообразного вещества равна удвоенной плотности его по водороду (точнее 2,016 плотности). Это следствие из закона Авогадро выводится очень легко. Пусть мы имеем два одинаковых объема разных газов при одинаковых физических условиях. Массы их в данных объемах будут разными:
![]()
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA=6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D.
Так как молярные объемы всех газов одинаковы (следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
D = М1/М2
где М1 и М2 – молярные массы двух газообразных веществ. Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа М1 и эталонного газа с известной молекулярной массой М2. По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D*M2.
4) В результате развития учения строения атома с одной стороны и природы света с другой.)
В начале XX века в физике утвердился принцип «корпускулярно-волнового дуализма». Свет распространяется как электромагнитная волна, но линейчатый характер спекторов атома водорода, явление фотоэффекта, свидетельствует, что свет есть поток частиц, такая двойственность природы света позволили Де Бройлю в 1924 году высказать гипотезу, что всякая микрочастица (в том числе электрон) ведут двойственные свойства.
![]() ,
,
т.е. частица массы
m
двигаясь со скоростью
![]() ,
может стать источником электромагнитного
излучения с длиной волны
,
может стать источником электромагнитного
излучения с длиной волны
![]() .
Волновые свойства электронов были
подтверждены в 1925 году Дейнисом и
Джерлином, они наблюдали прохождение
катодных лучей через кристаллы никеля,
таким образом гипотеза Де Бройля нашла
свое практическое подтверждение и стала
основой для развития нового раздела
физико- квантовой механики - изучение
движения частиц.
.
Волновые свойства электронов были
подтверждены в 1925 году Дейнисом и
Джерлином, они наблюдали прохождение
катодных лучей через кристаллы никеля,
таким образом гипотеза Де Бройля нашла
свое практическое подтверждение и стала
основой для развития нового раздела
физико- квантовой механики - изучение
движения частиц.
5)
Главное квантовое число (ввел Бор)
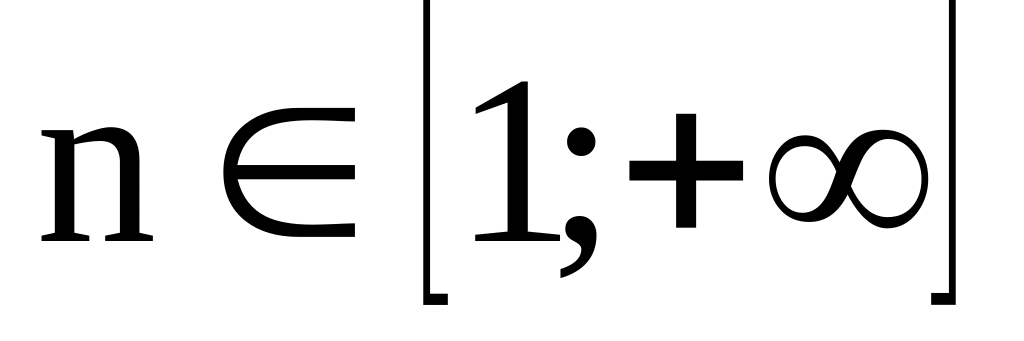 .
.
Физический смысл: задает размер атомной орбитали и определяет энергетический уровень электрона в атоме.
Орбитальное квантовое число,
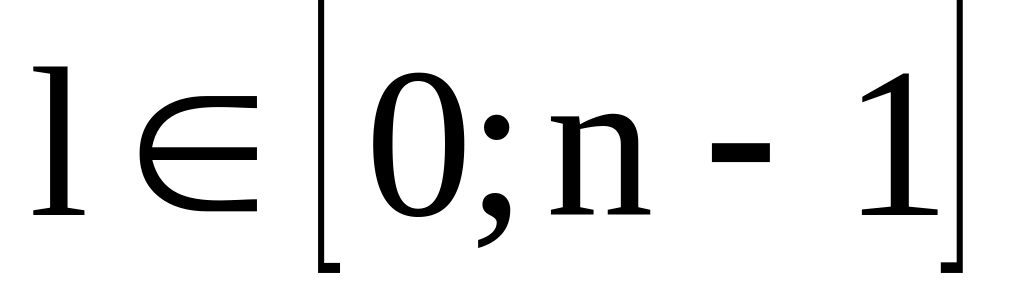 .
.
Физический смысл: определяет форму атомной орбитали, энергетический уровень.
Атомная орбиталь (АО) – это область околоядерного пространства, для которой вероятность нахождения электрона составляет 95%. Каждый электрон в атоме занимает соответствующую АО, т.е. область определенного размера (n), определенной формы (l) и определенной ориентации в магнитном поле земли. АО могут быть одинакового размера, но разной формы, следовательно, размер задаст энергетический уровень, а форма – энергетический подуровень.
Численным значениям орбитального квантового числа в квантовой механике даня соответствующие буквенные значения:
Пример: n=2
l = 0 (s-орбиталь) или l = 1(p-орбиталь)
l = 2(d-орбиталь) l = 3 (f-орбиталь)
Магнитное квантовое число
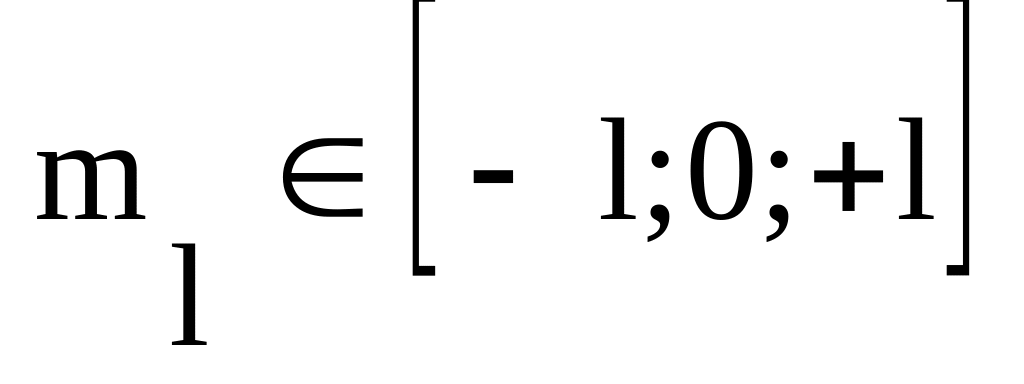 Общее число значений магнитного
квантового числа равно:
Общее число значений магнитного
квантового числа равно:

Физический смысл: определяет пространственную ориентацию в магнитном поле. В общем случае число атомных орбиталей определяется суммой значений магнитного квантового числа.
4.Спиновое
квантовое число,
принимает значение
![]() .
Определяет собственный магнитный момент
электрона, т. е. направление вращения
атомной орбитали вокруг собственной
оси. На одной атомной орбитали, может
находиться 2 электрона различных по
значению
.
Определяет собственный магнитный момент
электрона, т. е. направление вращения
атомной орбитали вокруг собственной
оси. На одной атомной орбитали, может
находиться 2 электрона различных по
значению![]() такие
электроны называются спаренными. Таким
образом, энергия состояния электрона
в атоме определяется размером, формой
и направлением вращения АО Число
электронов, которое может находиться
на данном энергетическом уровне,
определяется по формуле:
такие
электроны называются спаренными. Таким
образом, энергия состояния электрона
в атоме определяется размером, формой
и направлением вращения АО Число
электронов, которое может находиться
на данном энергетическом уровне,
определяется по формуле:
![]()
Принцип Паули говорит, что в атоме не может быть двух электронов, имеющих одинаковый набор 4-х квантовых чисел.
|
|
|
|
|
|
|
|
Значит, на одной АО могут находиться два электрона различных по значению спинового квантового числа.
6) распределение электронов в атоме по энергетическим состояниям происходит с соблюдением основного принципа устойчивости систем т. е. минимума свободной энергии из которого следует, что если в атоме есть 1 электрон, то он безусловно займет первый энергетический уровень. Этот основной принцип реализуется в квантовой механике в виде следующих правил:
Принцип Паули – в атоме не может быть двух электронов, характеризующихся одинаковым набором четырех квантовых чисел.
Правило Хунда:
Если имеется в атоме несколько электронов, находящихся на одном энергетическом подуровне, то состоянию с меньшей энергией соответствует использованию большего числа орбиталей. ( Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально).
Правило Клечковского:
При увеличении заряда ядра атома последовательное заполнение орбиталей происходит от орбитали с меньшим значением суммы главного квантового числа и орбитального квантового числа (n+l) к орбиталям с большим значением суммы.
7) Периодические изменения свойств химических элементов обнаруженные Д. И. Менделеевым можно объяснить, рассматривая электронную структуру атомов.
Положение химического элемента в периодической системе соответствует электронному строению его атома, при этом в одной группе оказываются элементы, имеющие одинаковое число электронов на внешнем энергетическом уровне. Всякие элементы в периодической системе находятся на пересечении горизонтального и вертикального ряда. Номер группы соответствует числу электронов на внешнем энергетическом уровне атома, а номер периода совпадает с числом энергетических уровней в атоме и указывает номер внешнего энергетического уровня.
Период
– это горизонтальный ряд электронов,
расположенных по возрастанию атомной
массы, заряда ядра, числа электронов в
атоме, начинающийся с типичного металла
и заканчивающийся инертным газом
![]() свойства
атомов определяются строением внешнего
энергетического уровня, т. е. числом
электронов на этом уровне и номером
этого уровня. Номер уровня определяет
расстояние электрона от ядра. Таким
образом, свойства элементов изменяются
периодически в связи с тем, что периодически
повторяется структура внешнего
энергетического уровня атома. В периоде
с ростом порядкового номера идет
формирование нового энергетического
уровня, и при переходе от предыдущего
к последующему число электронов
возрастает, увеличивается энергия
взаимодействия внешнего электрона с
ядром атома, а значит, уменьшается
способность атомов отдавать электроны,
может быть количественно выражено
потенциалом ионизации. Такие атомы с
одинаковой структурой внешнего
энергетического уровня находятся в
одной группе и обладают сходными
свойствами. Электроны внешних
энергетических уровней называются
валентными электронами. Именно они
определяют способность атомов к
взаимодействию с другими атомами.
Элементы, находящиеся в 1-3 группе вступая
во взаимодействие, отдают электроны и
при этом превращаются в положительно
заряженные ионы (катионы), приобретая
устойчивую восьми электронную оболочку.
свойства
атомов определяются строением внешнего
энергетического уровня, т. е. числом
электронов на этом уровне и номером
этого уровня. Номер уровня определяет
расстояние электрона от ядра. Таким
образом, свойства элементов изменяются
периодически в связи с тем, что периодически
повторяется структура внешнего
энергетического уровня атома. В периоде
с ростом порядкового номера идет
формирование нового энергетического
уровня, и при переходе от предыдущего
к последующему число электронов
возрастает, увеличивается энергия
взаимодействия внешнего электрона с
ядром атома, а значит, уменьшается
способность атомов отдавать электроны,
может быть количественно выражено
потенциалом ионизации. Такие атомы с
одинаковой структурой внешнего
энергетического уровня находятся в
одной группе и обладают сходными
свойствами. Электроны внешних
энергетических уровней называются
валентными электронами. Именно они
определяют способность атомов к
взаимодействию с другими атомами.
Элементы, находящиеся в 1-3 группе вступая
во взаимодействие, отдают электроны и
при этом превращаются в положительно
заряженные ионы (катионы), приобретая
устойчивую восьми электронную оболочку.
8) Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с увеличением порядкового номера потенциалы ионизации атомов возрастают, т. е. способность атомов отдавать электроны уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат, только S-электроны называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы 3 группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов).
И дёт
формирование d-подуровней,
формируется от предыдущего к последующему
предвнешние энергетические уровни.
Имея два или один электрон на внешнем
энергетическом уровне, все они являются
металлами, их называют d-элементами.
У большинства из них d-подуровни
являются не завершёнными, поэтому они:
дёт
формирование d-подуровней,
формируется от предыдущего к последующему
предвнешние энергетические уровни.
Имея два или один электрон на внешнем
энергетическом уровне, все они являются
металлами, их называют d-элементами.
У большинства из них d-подуровни
являются не завершёнными, поэтому они:
1)Могут обладать переменной валентностью;
2)Обладают специфическими физическими свойствами (например, электропроводность) за счёт вакантных d-орбиталей.
В 6 периоде от La – Lu и в 7 от Ac – Lr формируются подуровни f:
L![]() a
– Lu (4f), Ac – Lr (5f). Их
называют f-элементы.
Из отдельной клеточки они вынесены в
отдельную строку, их называют лантаноиды
и актиноиды. Это металлы. Работа отрыва
электрона от отрицательно заряженного
иона, измеренная спектрально или методом
Франка и Герца, характеризует сродство
к электрону. Сродство к электрону E
и первый потенциал ионизации I1
определяют химическую активность атома
– его окислительные или восстановительные
свойства.
a
– Lu (4f), Ac – Lr (5f). Их
называют f-элементы.
Из отдельной клеточки они вынесены в
отдельную строку, их называют лантаноиды
и актиноиды. Это металлы. Работа отрыва
электрона от отрицательно заряженного
иона, измеренная спектрально или методом
Франка и Герца, характеризует сродство
к электрону. Сродство к электрону E
и первый потенциал ионизации I1
определяют химическую активность атома
– его окислительные или восстановительные
свойства.
Один и тот же атом может принимать электроны, проявляя к ним сродство, или отдавать электроны другому атому, у которого сродство к электрону больше.
Электроотрицательность позволяет оценить возможность взаимодействия между данными атомами и прогнозировать распределение зарядов электронных облаков в образующемся соединении.
Электроотрицательность представляет собой периодическую функцию, величина которой позволяет оценивать поведение атома данного элемента при химических реакциях, а также влияние этого атома на распределение электронной плотности в уже готовых молекулах.
Энергия ионизации — энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в основном энергетическом состоянии; обычно выражается в электрон-вольтах. Многоэлектронные атомы имеют несколько значений энергии ионизации:
I1, I2 ..., соответствующих отрыву первого, второго и т. д. электронов, при этом всегда 71</2</3<... .
Энергия ионизации периодически изменяется. Для элементов каждого периода она возрастает слева направо с увеличением заряда ядра; в главных подгруппах уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра, а в побочных подгруппах наблюдается более сложная закономерность (сначала уменьшается, а затем растет).
9) Образование ковалентной неполярной связи.
H+H![]() H2
H2
![]()
![]()
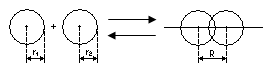
+ Q
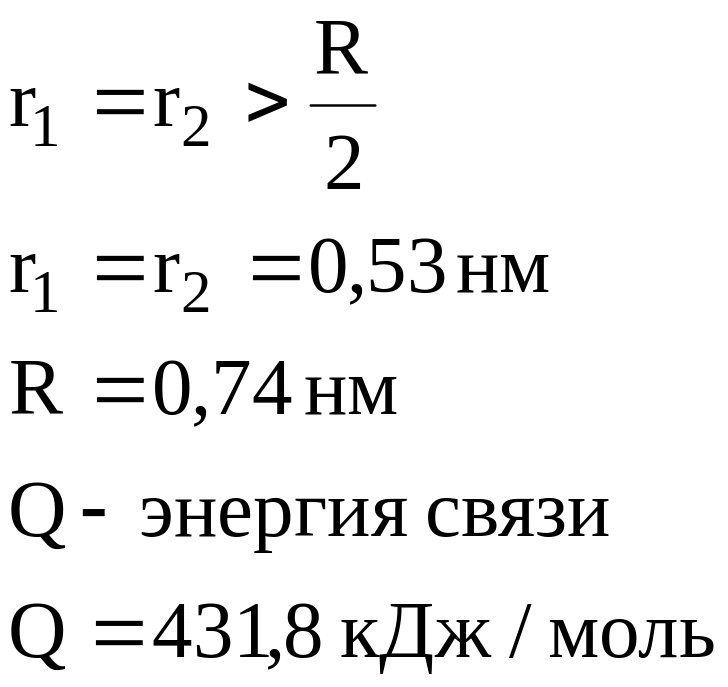
Ковалентная связь
бывает полярной и неполярной. Ковалентная
неполярная связь
образуется между двумя одинаковыми
атомами (![]() ) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома.
Полярная ковалентная связь образуется
между двумя разными атомами. Различают
ковалентные связи
) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома.
Полярная ковалентная связь образуется
между двумя разными атомами. Различают
ковалентные связи
![]() и ковалентные связи
и ковалентные связи
![]() .
.
Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
связь – образуется при таком перекрывании атомных орбиталей, когда область максимальной электронной области находится над и под плоскостью, в которой лежит прямая соединяющая центры атомов.
![]()
+![]() Q
Q
![]()
H2O
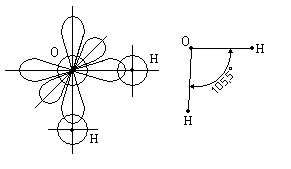
Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды.
10) Свойства ковалентной связи:
1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи.
2. Ковалентная связь бывает полярной и неполярной:
а) Ковалентная
неполярная связь образуется между двумя
одинаковыми атомами (![]() ) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома. Полярная ковалентная
связь образуется между двумя разными
атомами.
) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома. Полярная ковалентная
связь образуется между двумя разными
атомами.
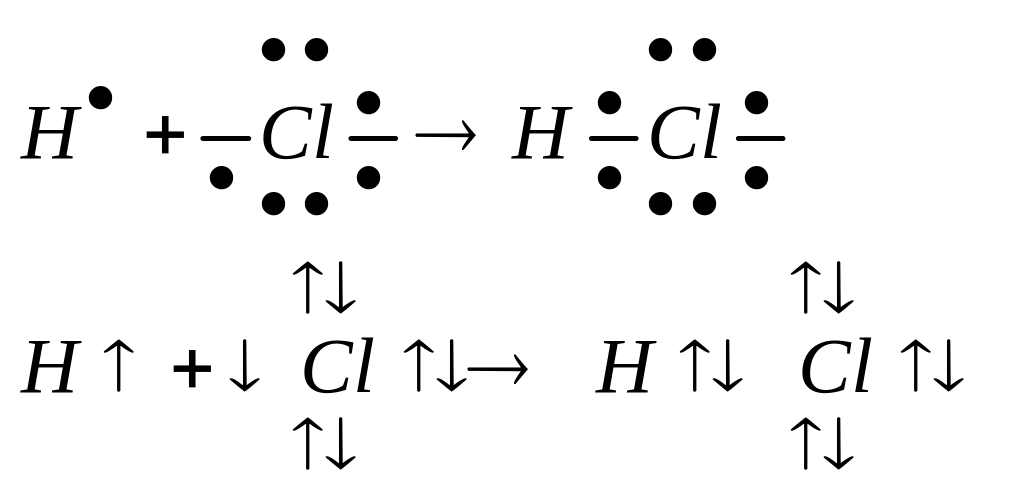
При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи.
