- •41. Моносахариды (пентозы, гексозы). Представители, строение, свойства, применение.
- •43. Молекулярно – кинетические свойства коллоидных систем. Коллоидные поверхностно – активные вещества как стабилизаторы гетерогенных пищевых и непищевых систем.
- •44. Углеводы. Классификация, строение, изомерия. Примеры.
- •45. Что такое гидролиз? Примеры реакций гидролиза: а) соли сильного основания и слабой кислоты. Б) соли сильной кислоты и слабого основания. В) соли слабой кислоты и слабого основания.
- •46. Природа химических связей в углеводородах, строение. Примеры.
- •47.Амины. Классификация, представители, особенности свойств.
- •48. Что такое жёсткость воды? Сущность определения общей жёсткости воды; карбонатной и некарбонатной жёсткости воды.
- •49. Алканы. Получение, свойства, применение.
- •50. Высшие жирные кислоты и их соли. Строение, свойства, применение.
- •53. Карбоновые кислоты. Классификация, номенклатура, свойства, применение.
- •55. Спирты. Классификация, свойства одноатомных спиртов, применение.
- •56. Положение металлов в периодической системе Менделеева. Свойства s- и d- элементов. Взаимодействие различных металлов с простыми веществами (вода, щёлочи, кислоты, соли).
- •58. Альдегиды, кетоны. Строение, особенности свойств, применение.
- •59. Неметаллы р – элементов. Окислительная активность неметаллов. Физические и химические свойства.
- •60. В чём заключается сущность реакции полимеризации органических соединений, привести примеры.
- •61. Фенолы. Классификация, свойства, применение.
- •Свойства.1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •62. Сущность окислительно – восстановительных реакций. Методы составления уравнений окислительно – восстановительных реакций. Привести пример.
- •Метод полуреакций этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
- •63. В чём заключается сущность реакции поликонденсации органических соединений. Примеры.
- •64. Функциональные производные карбоновых кислот: ангидриды, галогенагидриды, амиды, сложные эфиры.
- •65. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель.
55. Спирты. Классификация, свойства одноатомных спиртов, применение.
Спирты́ (устар. алкого́ли, англ. alcohols; от лат. spiritus — дух) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−OH.
Спирты классифицируются следующим образом:
По числу гидроксильных групп:
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). |
|
|
трёхатомный спирт глицерин |
четырёхатомный спирт пентаэритрит |
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
|
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
|
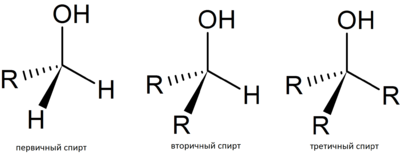
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
|
Одноатомные спирты - спирты, у которых имеется одна гидроксильная группа. Бывают первичные, вторичные и третичные спирты:
Свойства спиртов, которые являются изомерными, во многом похожи, но в некоторых реакциях они ведут себя по-разному. Сравнивая относительную молекулярную массу спиртов (Mr) c относительными атомными массами углевордородов, можно заметить, что спирты имеют более высокую температуру кипения. Это объясняется наличием водородной связи между атомом H в группе ОН одной молекулы и атомом O в группе ОН другой молекулы. При расторении спирта в воде образуются водородные связи между молекулами спирта и воды. Этим объясняется уменьшение объёма раствора (он всегда будет меньше, чем сумма объёмов воды и спирта по отдельности). Наиболее ярким представителем химических соединений этого класса является этиловый спирт. Его химическая формула C2H5-OH. Концентрированный этиловый спирт (он же - винный спирт или этанол) получают из разбавленных его растворов путём перегонки; действует опьяняюще, а в больших доза - это сильный яд, который разрушает живые ткани печени и клетки мозга. При этом нужно отметить, что этиловый спирт полезен в качестве растворителя, консерванта, средства понижающего температуру замерзания какого-либо преперата. Ещё один не менее известный представитель этого класса - метиловый спирт (его ещё называют - древесный или метанол). В отличии от этанола метанол смертельно опасен даже в самых малых дозах! Сначало он вызывает слепоту, затем просто "убивает"! Наиболее крупнотоннажными направлениями использования спиртов являются (в произвольном порядке):
промежуточные продукты для основного органического синтеза;
применение в качестве топлива;
производство растворителей;
производство синтетических моющих средств, парфюмерии и косметики;
использование в пищевой и фармацевтической промышленности.