- •Концентрация раствора.
- •Скорость реакции.
- •Элемент Даниэля–Якоби:
- •Измерение эдс цепи:
- •Направление протекания овр:
- •Коррозия под действием блуждающих токов
- •Метод валентных связей
- •1927 Г. – Гейтлер и Лондон Квантово-механический расчет молекулы водорода
- •Механизмы образования связи
- •Механизм образования ковалентной связи.
- •Донорно-акцепторный и дативный механизмы.
- •Экзаменационный билет № 12
- •Энтропия
- •Закон Вант-Гоффа:
- •Экзаменационный билет № 13
- •Периодическое изменение свойств
- •Экзаменационный билет № 14
- •Химическая связь
- •Виды ковалентной связи
- •Экзаменационный билет № 15
- •Гибридизация
- •Экзаменационный билет № 16
- •Отличительные черты катализаторов:
- •Химические источники тока
- •Экзаменационный билет № 17
- •Энтальпия
- •Второй закон Фарадея
- •Экзаменационный билет № 19
- •Химическая термодинамика
- •Свойства системы
- •Коррозия (по механизму)
- •Экзаменационный билет № 20
- •Устойчивость коллоидных систем.
- •Экзаменационный билет № 21
- •Экзаменационный билет № 22
- •Экзаменационный билет № 23
- •Экзаменационный билет № 24
- •Гидролиз солей.
- •Основные свойства
- •Основные виды
- •Коллоидные системы, применяемые в химическом анализе
- •Экзаменационный билет № 25
- •Экзаменационный билет № 26
- •Ионное произведение воды
- •Вывод значения ионного произведения воды
- •Практическое значение ионного произведения воды
- •Ионные произведения других растворителей
- •Водородный показатель
- •Экзаменационный билет № 27
- •Экзаменационный билет № 28
- •Химическое равновесие
- •Принцип Ле Шателье
- •Химические источники тока
- •Экзаменационный билет № 29
- •Феноменология
- •Природа поляризации
- •Экзаменационный билет № 30
- •Основные свойства
- •Электрохимическая коррозия
- •Электрохимическая коррозия.
Химические источники тока
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если ΔG < 0. Из соотношений ΔG = –nFE и ΔG° = –nFE° следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E° > 0
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
Для реакции
![]()
![]()
![]()
осуществляемой в элементе
![]()
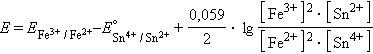
Экзаменационный билет № 29
Строение частиц лиофобных и лиофильных коллоидных систем.
Кинетика электродных процессов. Поляризация, ее виды.
Ответ:
Лиофильные и лиофобные коллоиды, коллоидные системы, различающиеся по интенсивности молекулярного взаимодействия веществ дисперсной фазы и жидкой дисперсионной среды. В лиофильных коллоидах частицы дисперсной фазы интенсивно взаимодействуют с молекулами окружающей их жидкости. Поверхность частиц сильно сольватирована и удельная свободная поверхностная энергия на границе раздела фаз чрезвычайно мала. При комнатной температуре условие возникновения лиофильных коллоидов реализуется, если межфазное (поверхностное) натяжение не превосходит нескольких сотых долей мн·м-1 (дин·см-1). Лиофильные коллоиды образуются в результате самопроизвольногодиспергирования крупных кусков твёрдого тела или капель жидкости на мельчайшие коллоидные частицы, или мицеллы. Лиофильные коллоиды термодинамически устойчивы и поэтому не разрушаются во времени при сохранении условий их возникновения. К лиофильным коллоидам относятся т. н. критические эмульсии, т. е. эмульсии, возникающие вблизи критической температуры смешения двух жидкостей; коллоидные дисперсии мицеллообразующих поверхностно-активных веществ (мыл, некоторых органических пигментов и красителей), водные дисперсии бентонитовых глин.
В лиофобных коллоидах частицы дисперсной фазы слабо взаимодействуют с окружающей средой. Межфазное натяжение в таких системах довольно велико [не ниже нескольких десятых долеймн·м-1 (дин·см-1) при комнатной температуре]. Вследствие избытка свободной поверхностной энергии они термодинамически неустойчивы, т. е. всегда сохраняют тенденцию к распаду. При распаде лиофобного коллоида происходит укрупнение коллоидных частиц, которое сопровождается уменьшением свободной энергии системы. Агрегативная устойчивость (способность противостоять укрупнению частиц) любого лиофобного коллоида носит временной характер; она обусловлена наличием стабилизатора — вещества, адсорбирующегося на поверхности частиц (капель) и препятствующего их слипанию (слиянию). Типично лиофобные коллоиды — гидро- и органозоли металлов, окисей, сульфидов предельно высокодисперсные эмульсии (кроме критических), латексы.
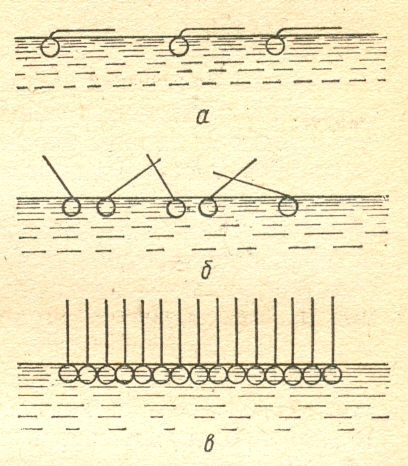
Схема расположения молекул поверхностно-активного вещества на поверхности раздела водный раствор-воздух.


Гидрофильная Гидрофобная
часть (полярная) часть (неполярная)
|
а – концентрация молекул очень мала б – концентрация молекул увеличена, и они взаимодействуют друг с другом неполярными частями в – молекулы образовали плотный мономолекулярный слой
|
Поляризация электрохимическая - отклонение потенциала электрода от равновесного значения.