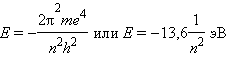Оглавление:
Билет №6
Билет №7
Билет №8
Билет №9
Билет №10.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
-
Возникновение потенциала на границе раздела металл / раствор. Устройство и работа гальванического элемента. Элемент Якоби-Даниэля.
-
Простые и сложные химические реакции. Молекулярность и порядок реакции.
Ответ:
|
|
|
При погружении металлической пластины в воду или раствор ее соли между поверхностью пластины и раствором образуется двойной электрический слой. Возникает разность потенциалов. Потенциал-это работа, которую выполняет электрон. Проходя через электрическое поле. Потенциал-напряжение. Разность потенциалов измеряют относительно стандартного водородного электрода. Измеренные потенциалы называют стандартными. Стандартные потенциалы которые посылают электроны к водородному электроду заряжаются отрицательно. А потенциал получающий от водородного электрода электроны заряжается положительно. Самым активным металлом будет являться металл у которого самая большая электроотрицательность у потенциала. Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).
Элемент Даниэля–Якоби:
 (катода) >
(анода)
(катода) >
(анода)
0 (Zn2+/Zn) = - 0,76
0 (Cu2+/Cu) = + 0,34
Электрод, на котором происходит процесс окисления – анод
А (-): Zn0 – 2e– → Zn2+
Электрод, на котором происходит процесс восстановления – катод
К (+): Cu2+ + 2e– → Cu0
Токообразующая реакция
Cu2+ + Zn0 → Zn2+ + Cu0
Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью стехиометрических коэффициентов перед формулами соединений:
где A, B, C, D – реагирующие вещества; a, b, c, d – стехиометрические коэффициенты.
Можно выделить четыре основных типа химических реакций:
-
Соединения
-
Замещения
-
Разложения:
-
Обмена
Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными. Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние. Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей.
Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются параллельными.
К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция).
В цепных реакциях выделяют три стадии: зарождение цепи, ее развитие и обрыв. Зарождение (иницирование) происходит под воздействием светового, радиационного, термического или другого воздействия. Реакции, протекающие под воздействием светового излучения, называются фотохимическими.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции. Кинетическое уравнение реакции только для элементарных стадий совпадает с выражением ЗДМ. В этих случаях молекулярность и порядок реакции совпадают, хотя и не всегда. Так, при избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения концентрации вещества В (А = const), поэтому порядок бимолекулярной реакции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для реакции aА + bВ → кинетические уравнения по веществу А и веществу В выглядят соответственно
![]()
|
|
|
|
а общее кинетическое уравнение –
|
|
|
(5.2) |
Здесь z = x + y – общий порядок реакции. Запишем кинетическое уравнение в дифференциальной форме для разных исходных реагентов:
![]()
|
|
|
|
Разделение переменных и интегрирование в пределах от нуля до τ дает приведенные в таб. 5.1 уравнения для реакций первого, второго и третьего порядков.
|
Порядок реакции Z
|
||||||||||||
|
|
В каждом случае кинетическое уравнение линейно в соответствующих координатах С(τ), что позволяет графически определить порядок реакции (рис. 5.2).
|
|
|
|
Прологарифмировав уравнение (5.2), получим lgV = lgK + z lgC; из графической зависимости (рис. 5.2) получаем lgK и z = tg φ.
Порядок реакции, особенно гетерогенной, может быть не только целочисленным (в том числе и нулевым), но и дробным. Нулевой порядок реакции указывает на постоянство скорости во времени.
Для гетерогенной реакции C(тв) + О2(г) = СО2(г) можно создать концентрационнные условия, при которых порядок реакции будет меняться в пределах от нуля до единицы. Действительно, при больших парциальных давлениях кислорода в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку ~ const. Поэтому реакция горения углерода будет в этих условиях подчиняться кинетическому уравнению нулевого порядка. При уменьшении парциального давления кислорода, начиная с некоторого скорость реакции будет соответствовать кинетическому уравнению первого порядка При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7
-
Квантовые числа: главное, орбитальное, магнитное и спиновое.
-
ЭДС гальванического элемента, ее связь с максимальной работой. Стандартный электродный потенциал. Уравнение Нернста. Ряд напряжений как характеристика свойств металлов.
Ответ:
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
l = 0 1 2 3 4 …
l = s p d f g …
Электроны с одинаковым значением l образуют подуровень.
Квантовое число l определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно ось z).
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз .
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.