
Химическое равновесие
– для
растворов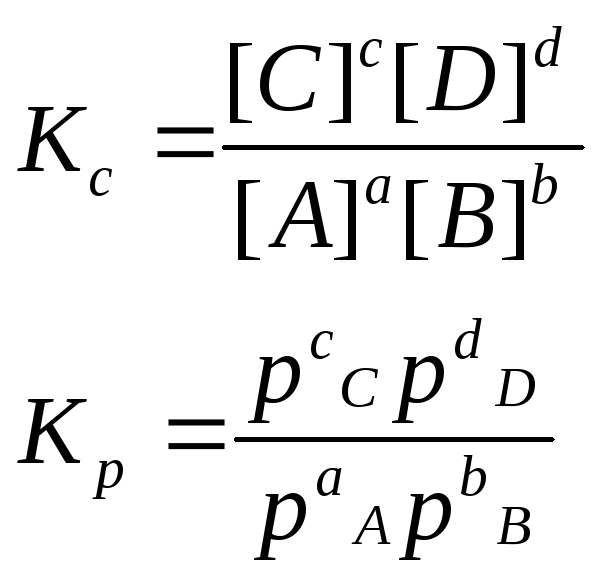
– для газов
Константа равновесия (К) –мера глубины протекания процесса (степени превращения исходных веществ в конечные)
![]()
– изотерма
Ванта-Гоффа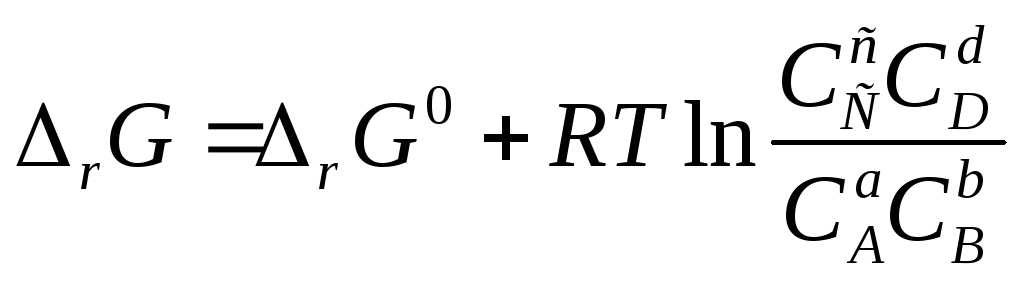
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
-
Атомные орбитали. Заполнение АО электронами: принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда.
-
Коррозия под действием блуждающих токов. Защита металлоконструкций от коррозии блуждающими токами.
Ответ:
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда. Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. Если число электронов при заданном l просуммировать от 0 до n – 1, то получим формулу Бора–Бьюри, определяющую общее число электронов на уровне с заданным n:
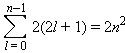
Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3. Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: ? , и суммарный спин S = 3/2, а не так: , S = 1/2.
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронныхатомах.
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
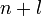 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением 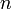 .
.
Коррозия под действием блуждающих токов
"Вход" тока – катодный участок, "выход" тока – анодный участок (корродирует)
Защита:
Дренаж – соединение проводником анодной зоны трубы и катодной зоны рельса
Дополнительный анод, соединенный с катодным участком рельса
