- •Концентрация раствора.
- •Скорость реакции.
- •Элемент Даниэля–Якоби:
- •Измерение эдс цепи:
- •Направление протекания овр:
- •Коррозия под действием блуждающих токов
- •Метод валентных связей
- •1927 Г. – Гейтлер и Лондон Квантово-механический расчет молекулы водорода
- •Механизмы образования связи
- •Механизм образования ковалентной связи.
- •Донорно-акцепторный и дативный механизмы.
- •Экзаменационный билет № 12
- •Энтропия
- •Закон Вант-Гоффа:
- •Экзаменационный билет № 13
- •Периодическое изменение свойств
- •Экзаменационный билет № 14
- •Химическая связь
- •Виды ковалентной связи
- •Экзаменационный билет № 15
- •Гибридизация
- •Экзаменационный билет № 16
- •Отличительные черты катализаторов:
- •Химические источники тока
- •Экзаменационный билет № 17
- •Энтальпия
- •Второй закон Фарадея
- •Экзаменационный билет № 19
- •Химическая термодинамика
- •Свойства системы
- •Коррозия (по механизму)
- •Экзаменационный билет № 20
- •Устойчивость коллоидных систем.
- •Экзаменационный билет № 21
- •Экзаменационный билет № 22
- •Экзаменационный билет № 23
- •Экзаменационный билет № 24
- •Гидролиз солей.
- •Основные свойства
- •Основные виды
- •Коллоидные системы, применяемые в химическом анализе
- •Экзаменационный билет № 25
- •Экзаменационный билет № 26
- •Ионное произведение воды
- •Вывод значения ионного произведения воды
- •Практическое значение ионного произведения воды
- •Ионные произведения других растворителей
- •Водородный показатель
- •Экзаменационный билет № 27
- •Экзаменационный билет № 28
- •Химическое равновесие
- •Принцип Ле Шателье
- •Химические источники тока
- •Экзаменационный билет № 29
- •Феноменология
- •Природа поляризации
- •Экзаменационный билет № 30
- •Основные свойства
- •Электрохимическая коррозия
- •Электрохимическая коррозия.

Оглавление:
Билет №1
Билет №2
Билет №3
Билет №4
Билет №5.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
1. Физико-химическая теория растворов, энергетика процесса растворения. Механизм растворения.
2. Понятие об электролизе. Сходство и различие процессов в гальванических элементах и при электролизе.
Ответ:
Растворы гомогенные системы, состоящие из двух или более компонентов, состав которых можно изменять в некоторых пределах без нарушения однородности (твердые, жидкие, газообразные).
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твердых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многиефизические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
Растворение - сложный физико-химический процесс. Растворение – самопроизвольный процесс (G < 0).
фазовый переход Нф.п. > 0, Sф.п. > 0
|
сольватация Hсольв. < 0, Sсольв. < 0
|
H = Hф.п. + Hсольв.
S = Sф.п. + Sсольв.
Электролиз – окислительно-восстановительные процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника.
При рассматривании ГЭ мы говорили, что на электродах самопроизвольно ( из-за разности Е0) протекают Ox-Red реакции причем Ox и Red разделены в пространстве. Освободившиеся в реакции окисления электроны переходят в зону восстановления через внешнюю цепь. Так, в ГЭ Pt, H2/H2SO4/O2, Pt
А(-) H2 → 2H+ + 2e (окисление)
К(+) ½O2 + 2H+ + 2e → H2O (восстановление)
――――――――――――――
H2 + ½O2 → H2O
Этот процесс происходит в ГЭ самопроизвольно ∆G0р-ции = -237,3 кДж/моль.
Поэтому поток электронов перемещается во внешней цепи и обуславливает взаимосвязь полуреакций окисления и восстановления.
Если с помощью внешнего источника тока обеспечить обратное протекание электронов, тогда они, поступая к водородному электроду, примут участие в процессе восстановления, а на другом электроде пойдет процесс окисления:
К(-) 2H+ + 2e → H2
A(+) H2O → ½O2 + 2H+ + 2e
―――――――――――――
H2O → H2 + ½O2
Для этого процесса ∆G0р-ции = 237,3 > 0 следовательно, при стандартных условиях самопроизвольно не идет.
Т. о. при электролизе реакции электродов в отличие от ГЭ поменялись : водородный – К(-), кислородный А(+), что обусловлено обратным направлением тока.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
Способы выражения концентрации растворов.
Скорость химической реакции: средняя и истинная. Зависимость скорости химической реакции от концентрации реагентов. Закон действующих масс для простых гомогенных и гетерогенных реакций.
Ответ:
Концентрация раствора.
Молярная концентрация (С) – число молей растворенного вещества в одном литре раствора.
![]()
Моляльная концентрация (Сm) – число молей растворенного вещества в одном килограмме растворителя.
![]()
П![]() роцентная
концентрация (ω)
– число граммов растворенного вещества
в 100 граммах раствора.
роцентная
концентрация (ω)
– число граммов растворенного вещества
в 100 граммах раствора.
Скорость реакции.
С![]() корость
реакции изменение
концентрации реагентов или продуктов
реакции в единицу времени
корость
реакции изменение
концентрации реагентов или продуктов
реакции в единицу времени
Средняя скорость – конечное изменение концентрации с2-с1, относящееся к промежутку времени t2-t1
Истинная (мгновенная) скорость – первая производная концентрации по времени

![]()
![]()
Скорость реакции зависит:
от природы реагирующих веществ
от температуры
от концентрации
от давления (для газов)
от катализатора
от площади соприкосновения (для гетерогенных реакций)
от среды (для реакций в растворах)
от формы сосуда (для цепных реакций)
Основной постулат химической кинетики
1867 г. Гульдберг, Вааге – закон действующих масс:
скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
aA + bB → сС + dD
V=k[A]a[B]b
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
Понятие о дисперсных системах. Дисперсная фаза, дисперсионная среда. Классификации и примеры дисперсных систем.
Защитные покрытия металлов от коррозии. Анодные и катодные покрытия.
Ответ:
Дисперсными называют такие системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе.
При этом распределяемое вещество принято называть дисперсной фазой, а вещество, в котором происходит распределение, - дисперсной средой.
Дисперсные системы |
Размеры частиц дисперсной системы |
Устойчивость и гомогенность системы |
Грубодисперсные (суспензии, взвеси) |
10-3…10-5 см (10…0,1 мкм) |
Неустойчивы, гетерогенны |
Тонкодисперсные (коллоидные растворы) |
10-5…10-7 см (0,1…0,001 мкм) |
Довольно устойчивы, микрогетерогенны |
Молекулярно-дисперсные (истинные растворы) |
~10-8 см (размер молекул и ионов) |
Весьма устойчивы, гомогенны |
Дисперсная среда |
Дисперсная фаза |
Примеры |
Газ |
газ жидкость твердое тело |
газовые смеси (воздух) туманы, облака пыль, дым |
Жидкость |
газ жидкость твердое тело |
пена эмульсии (молоко, кремы, мази), суспензии, взвеси (глина в воде) |
Твердое тело |
газ
жидкость
твердое тело |
твердые пены(пенопласты, пемза, пеностекло) твердые эмульсии (вода в парафине, жемчуг) сплавы, твердые растворы |
Защитные покрытия:
Металлические
Химические
Неметаллические
- Неорганические (эмали)
- Органические (лаки, краски, пластмассы, смолы, битум, асфальт)
Анодное покрытие – покрытие металлом, с более отрицательным потенциалом
Оцинкованное железо
А(–) Zn – 2e– → Zn2+
K(+) (Fe) 2H+ + 2e– → H2
Катодное покрытие – покрытие металлом, с более положительным потенциалом
Луженое железо
А(–) Fe – 2e– → Fe2+
K(+) (Sn) 2H+ + 2e– → H2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
Основные положения квантовой механики: уравнение де Бройля, принцип неопределенности Гейзенберга, уравнение Шредингера.
Свойства разбавленных растворов неэлектролитов (законы Рауля).
Ответ:
В 20-х годах XX столетия
было установлено, что любая частица
имеет корпускулярно-волновую природу.
Согласно теории Л.
де Бройля (1924 г.),
каждой частице с импульсом соответствует
волновой процесс с длиной волны λ,
т.е. λ = h / p.
Чем меньше масса частицы, тем больше
длина волны. Для элементарных частиц В.
Гейзенберг сформулировал
принцип неопределенности, согласно
которому невозможно одновременно
определить положение частицы в
пространстве и ее импульс. Следовательно,
нельзя рассчитать траекторию движения
электрона в поле ядра, можно лишь оценить
вероятность его нахождения в атоме с
помощью волновой
функции ψ, которая
заменяет классическое понятие траектории.
Волновая функция ψ характеризует
амплитуду волны в зависимости от
координат электрона, а ее квадрат
ψ2 определяет
пространственное распределение электрона
в атоме. В наиболее простом варианте
волновая функция зависит от трех
пространственных координат и дает
возможность определить вероятность
нахождения электрона в атомном
пространстве или его орбиталь.
Таким образом, атомная
орбиталь (АО)
– область атомного пространства, в
котором вероятность нахождения электрона
наибольшая. Волновые функции получаются
при решении основополагающего соотношения
волновой механики – уравнения Шредингера.
Пусть волновая
функция задана
в N-мерном пространстве, тогда в каждой
точке с координатами ![]() ,
в определенный момент времени t она
будет иметь вид
,
в определенный момент времени t она
будет иметь вид ![]() .
В таком случае уравнение Шрёдингера
запишется в виде:
.
В таком случае уравнение Шрёдингера
запишется в виде:
![]()
где ![]() ,
, ![]() — постоянная
Планка;
— постоянная
Планка; ![]() —
масса частицы,
—
масса частицы, ![]() —
внешняя по отношению к частице
потенциальная
энергия в
точке
,
—
внешняя по отношению к частице
потенциальная
энергия в
точке
, ![]() — оператор
Лапласа (или
лапласиан), эквивалентен квадрату оператора
набла.
— оператор
Лапласа (или
лапласиан), эквивалентен квадрату оператора
набла.
(Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения). Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел.
Законы Рауля.
Д
1– растворитель; 2 –
нелетучее вещество ![]()
![]()
![]()
![]()
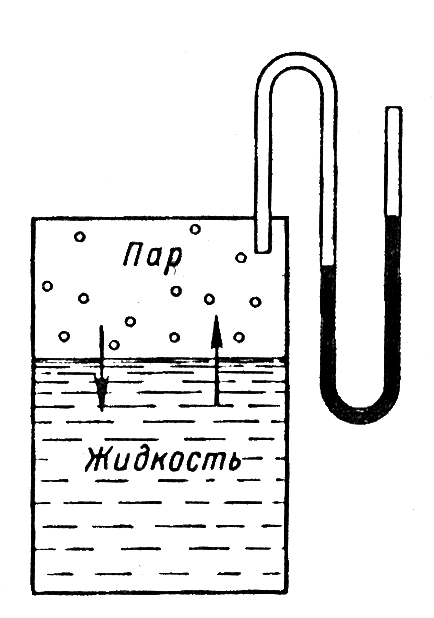
Первый закон Рауля: давление насыщенного пара растворителя над раствором равно произведению его давления над чистым растворителем на мольную долю растворителя
Понижение давления насыщенного пара над раствором
Первый закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества
Давление пара над
раствором: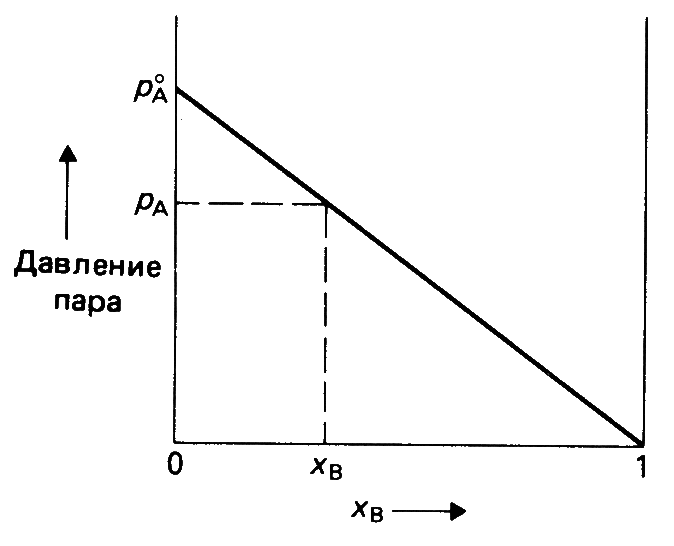
![]()
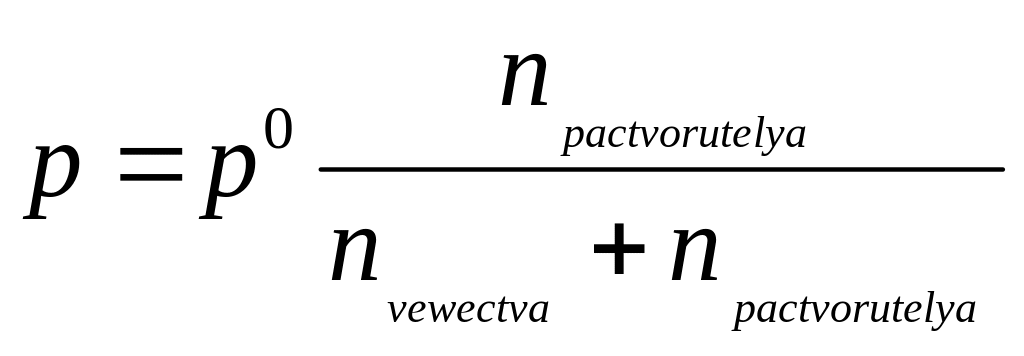
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
Введение в химию. Основные понятия химии (атомная, молекулярная, молярная и эквивалентная масса, моль, валентность, степень окисления). Значение химии в инженерном деле.
Сравнительная характеристика электролиза расплава и раствора соли.
Ответ:
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Zэлектронов.
Массовое число A равно сумме числа протонов Z и числа нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина) она численно равна атомной массе элемента.
Относительная атомная масса элемента с учетом его изотопного состава равна – относительная атомная масса изотопа, – доля каждого из изотопов элемента в земной коре.
Способность атома присоединять или замещать определенное число других атомов называют валентностью. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно- , а кислород двухвалентен.
Степень окисления – условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «–» в виде верхнего правого индекса символа элемента: Cl–I, Cl+VII, O–II, H+I, Mg+II, N–III, N+V, Cr+VI.
Моль – количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), сколько содержится атомов углерода в 12 г изотопа углерода-12 (число Авогадро)..
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г•моль–1.
В инженерном деле: основания и фундаменты, механика грунтов, строительные конструкции – невозможны без химии. Огромной важности на железных дорогах вопросы коррозии и защиты металлов от коррозии.
Электролиз расплавленных солей. Рассмотрим Эл-з расплава Nа, при tплав≥8010C ионная кристаллическая решетка NaCl разрушается на ионы Na+ и Cl-. Поместим в этот расплав два химически инертных, не реагирующих с электролитом электрода, например, из графита (С). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и анионов (Cl-), никаких других частиц, могущих участвовать в эл-зе нет. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Этот электрод явл-ся К(-), и на нем идет процесс восстановления: К(-)Na+ + 1е = Na0. Под действием электрического поля ионы Cl- переносятся к А(+) и на нем окисляются А(+) 2Cl- - 2е = Сl2. Электроны от анода переносятся к внешнему источнику тока. Суммирую К(-) и А(+), получим Ox-Red реакцию, протекающую в ходе электролиза: Na+ + Cl- → Na + ½ Cl2.
При электролизе расплава смеси солей NaCl и CuCl2 на К(-) возможно восстановление и Na+ и Cu2+, однако восстанавливаться будут ионы Cu2+: К(-) Cu2+ + 2e = Cu0. Об этом свидетельствует положение Na и Cu в периодической системе и химические свойства этих элементов. Na – активный щелочной металл с низкой энергией ионизации, которая намного меньше энергии ионизации Cu до Cu2+. Следовательно окисленное состояние Na более типично. Чем для меди, и обратный процесс (восстановление Na+ до Na) требует больших энергетических затрат, чет восстановление Cu2+ до Cu.
На аноде идет процесс окисление Cl-: A(-)2Cl- - 2е = Сl2.
Суммарно: NaCl + CuCl2 (Cu2+ + 3Cl- + Na+) → Cu0 + Сl2 + Na+
Или же Cu2+ + 2Cl- → Cu + Сl2.
Для определения наиболее вероятных реакций при электролизе расплавов нельзя пользоваться рядом стандартных потенциалов, т.к. это потенциалы Ox-Red процессов в водных растворах. Для расплавов есть свои электродные потенциалы. В ряде наиболее очевидных случаев для определения последовательности процессов при электролизе расплавов можно руководствоваться положением элементов в периодической таблице, сравнительной характеристикой химических свойств элементов и их ионов.
Электролиз растворов электролитов. Его отличие от электролиза расплавов состоит в том, что все ионы в водном растворе гидратированы, т. е. отличаются от аналогичных ионов в расплаве. И, кроме того, помимо самого вещества, в растворе присутствуют молекулы H2O и ионы H+ и O2-, как продукты диссоциации H2O, поэтому при рассмотрении реакций на электродах необходимо учитывать их возможное участие в электролизе.
Для определения наиболее вероятного процесса в ТД пользуются значениями ∆G0р-ции, что эквивалентно ЭДС Ox-Red реакции. Так для реакции H2 + ½O2 → H2O ∆G0р-ции = -237,3 кДж/моль.
E0 = (-∆G)/(nF), E0 = (237.3*1000)/(2*96500) = 1,23 В
Для того, чтобы заставить протекать процесс в обратном направлении (электролиз воды), необходимо напряжение внешнего источника больше 1,23 В. Такое минимальное напряжение, вызывающее электролиз, называется напряжение разложения (Uразл), или потенциал разложения (Eразл) соответствующего вещества. Чем меньше Uразл, тем легче осуществить электролиз вещества. Т. е. если имеются несколько веществ, то электролизу будет подвиргаться то вещество, которе имеет меньший потенциал разложения
Uразл = - E0 = Е0К – Е0А. Т. о., наиболее вероятным процессом на аноде будет реакция с минимальным электродным потенциалом, на катоде наиболее вероятна с максимальным электродным потенциалом.
Рассмотрим, например, электролиз раствора Na2SO4.
В электролизе способны участвовать частицы Na+, SO42-, H+, OH-, (из H2O), а также H2O (сами молекулы).
Возможные процессы на К(-):
* 2H2O + 2е → H2 + 2OH- Е0 = -0,41 В U0 = -0.87 В
2H+ + 2е → H2 малая диссоциация воды Е0 = -0,059*7 = -0,41В
Na+ + 1e → Na Е0 = -2.71В
Вероятные процессы на А(+):
* 2H2O = O2 + 4 H+ + 4e Е0 = +0.82 В U0 = 1.23 В
2SO42- = S2O8 + 2e Е0 = +2.05 В
Т. о., при электролизе раствора Na2SO4 на К(-) выделяется водород, а на А(+) выделяется кислород, т.е. происходит только электролиз воды:
2H2O → 2H2 + О2.
* Рассмотрим также электролиз раствора CuCl2 (pH < 7, pH ~ 5)
К(-): 2H+ + 2е → H2 Е0 = -0,3 В
* Cu2+ + 2e → Cu Е0 = +0.34 В
А(+): 2H2O = O2 + 4 H+ + 4e Е0 = +0,9 В! 1,23 - 0,3 = 0,93
2Cl- = Cl2 + 2e Е0 = +1.36 В
Следовательно, в равновесных условиях на А(+) в первую очередь будет выделяться кислород. Однако важно учитывать не только ТД, но и кинетику процесса. Хотя выделение кислорода на аноде начинается раньше, скорость реакции окисления хлора в насыщенном растворе NаCl на некоторых анодах выше, чем скорость выделения кислорода. Кроме того, возможна кислородная поляризация, что повышает потенциал данной реакции.
Существует эмпирическое правило, согласно которому в первую очередь на аноде разряжаются анионы бескислородных кислот (кроме F-), затем вода, и только потом – анионы кислородосодержащих кислот.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциалы других веществ или ионов, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металл или другого проводника, используемого в качестве анода, имеет более положительное значение, то идет электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют Au и платиновые металлы, PbO2, RuO4, С графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например Ni и Fe в щелочном растворе, Pb в H2SO4, Ti, Ta, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
Теперь уточним последовательность электродных процессов на катоде. Все окислители, которые восстанавливаются на К(-) можно разделить на три группы:
1. Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода (-0,41В, pH=7). В таких водных растворах на катоде выделяется только водород. Металлы могут быть получены только электролизом расплавов.
2. Ионы металлов, потенциалы которых более положительны, чем потенциал водородного электрода ( Cu2+, Hg2+, Ag+, Au3+). При наличии этих ионов в растворе они разряжаются в первую очередь, т. е. на К(-) выделяется металл и разряд ионов H+ не происходит.
3. ионы, потенциал которых мало отличается от потенциала водородного электрода – Cd2+, Co2+, Ni2+ ( с учетом изменения Е0Н2/Н+ вследствие различного pH солей этих металлов). В таких случаях на катоде протекают два параллельных процесса: выделение металла и выделение водорода.
Т. о., под действием электрического тока на электродах происходят процессы, называемые электролизом. Последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
Электролиз растворов
Важна последовательность электродных процессов, зависящая от потенциала ионов
Анод
Катод
1) Анионы
галогенов:
2Cl–
– 2e–
→ Cl2
2)
О-содержащие анионы не разряжаются,
окисляются молекулы воды:
2H2O
– 4e–
→ O2
+ 4H+
3)
Растворимый анод окисляется:
Cu
– 2e–
→ Cu2+
1) Ионы металлов, выше
Al
не
разряжаются; 2H+
+ 2e–
→ H2 2)
Ионы металлов ниже Н+
разряжаются: Cu2+
+ 2e–
→ Cu 3)
Ионы металлов между Al
и H+:
разряжается и металл, и Н2О
Оглавление:
Билет №6
Билет №7
Билет №8
Билет №9
Билет №10.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
Возникновение потенциала на границе раздела металл / раствор. Устройство и работа гальванического элемента. Элемент Якоби-Даниэля.
Простые и сложные химические реакции. Молекулярность и порядок реакции.
Ответ:
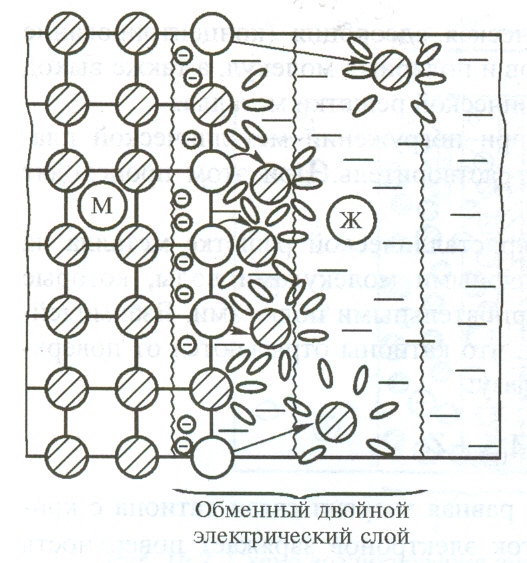
|
|
При погружении металлической пластины в воду или раствор ее соли между поверхностью пластины и раствором образуется двойной электрический слой. Возникает разность потенциалов. Потенциал-это работа, которую выполняет электрон. Проходя через электрическое поле. Потенциал-напряжение. Разность потенциалов измеряют относительно стандартного водородного электрода. Измеренные потенциалы называют стандартными. Стандартные потенциалы которые посылают электроны к водородному электроду заряжаются отрицательно. А потенциал получающий от водородного электрода электроны заряжается положительно. Самым активным металлом будет являться металл у которого самая большая электроотрицательность у потенциала. Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).