
- •Механика Кинематика криволинейного движения
- •Скорость и ускорение. Нормальное и тангенсальное.
- •Полное ускорение
- •Кривизна траектории.
- •Вращательное движение
- •Радиус вектор
- •Угловая скорость, ускорение
- •Зависимость угла скорости и угла поворота от времени.
- •Поступательное вращательное движение
- •Динамика Законы Ньютона
- •Сила как мера взаимодействия тел.
- •Поле Сил Силовые поля
- •Электростатическое поле (поле неподвижных зарядов)
- •Гравитационное поле
- •Электромагнитное поле, постоянное во времени (поле постоянных токов)
- •Электромагнитное поле (общий случай)
- •Границы применения сил, классификация Прямые и обратные задачи механики. Начальные и граничные условия.
- •Энергия и работа. (теорема о Ек)
- •Потенциальная энергия, как энергия в-я.
- •Системы изолированные и неизолированные.
- •Диссипация энергии в диссипативной системе
- •Работа переменной силы.
- •Работа и энергия в поле тяготения
- •Общие характеристики гравитационного поля.
- •Напряженность и потенциал гравитационного поля.
- •Гравитационный потенциал и уравнения движения
- •Связь потенциальной энергии и силы
- •Потенциальные кривые и энергетические уровни
- •Импульс (II закон Ньютона с использованием импульса).
- •Закон сохранения импульса
- •Вращательное движение
- •Момент силы.
- •Момент импульса.
- •Момент инерции
- •Осевые моменты инерции некоторых тел
- •Теорема Штейнера
- •[Править]Вывод
- •[Править]Пример
- •Основное уравнение динамики вращательного движения
- •Зако́н сохране́ния моме́нта
- •Гироскопический эффект
- •Кинетическая энергия вращающегося тела
- •Работа при вращательном движении
- •Общий случай плоского движения
- •Основное свойство плоского движения.
- •Сравнительный характер поступательного и вращательного движения.
- •Колебательные движения
- •Смещение, скорость, ускорение, фаза, начальная фаза колебательного движения.
- •Энергия незатухающего колебательного движения Гармонический осциллятор
- •Сложение колебаний одного направления и биений
- •Сложение взаимно перпендикулярных колебаний. Фигура Лиссажу.
- •Математический маятник
- •Физический маятник(приведенная длина, точка качения и их св-ва, вывод формулы периода).
- •[Править]Вычисление
- •Затухающие колебания(логарифмический декремент, 4 подхода к определению добротности)
- •Вынужденные колебания
- •Консервативный гармонический осциллятор
- •II закон Ньютона к поступательному, вращательному, колебательному движению.
- •Теория относительности
- •Следствия из постулатов сто
- •1. Относительность одновременности событий
- •2. Относительность промежутков времени
- •3. Относительность расстояний
- •4. Сложение скоростей в сто
- •5. Закон Ньютона в релятивистской форме
- •6. Связь между энергией и массой
- •Молекулярная физика Адиабатический процесс
- •Физический смысл адиабатического процесса
- •Адиабата Пуассона
- •Политропный процесс
- •Теорема Больцмана
- •[Править]h-теорема
- •Молекулярная теплоемкость газа.
- •Теплоёмкость для различных состояний вещества
- •Термодинамика Первое начало термодинамики
- •[Править]Частные случаи
- •Работа газа при изопроцессах
- •Молярная и удельная теплоемкость газа.
- •II начало термодинамики
- •Ограничения
- •Обратимые и необратимые процессы
- •Квазистатический процесс Квазистатический процесс
- •Значение квазистатических процессов
- •Виды квазистатических процессов
- •Тепловые, холодильные машины.(их кпд) Цикл Карно.
- •Кпд тепловой машины Карно
- •Приведенная теплота и теорема Клаузиса
- •Энтропия
- •Изменение энтропии при квазистопическом процессе.
- •Энтропия в изолированной системе
- •Макро и микро состояния.
- •Термодинамическая вероятность состояний
- •Эргодическая гипотеза Статистическое толкование энтропии
- •Теорема Нерста
- •Параметрическая формула и распределение Больцмана
- •Распределение Максвелла Реальные газы
- •Уравнение Ван-дер-Ваальса
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Явление переноса
- •Эффективное сечение
- •Число столкновений и средняя длина свободного пробега молекул в газах
Изменение энтропии при квазистопическом процессе.
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
|
|
|
(6.2.1) |
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий. Исходя из этого, найдем изменения энтропии в процессах идеального газа. Так как при Т = const,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6.2.2) |
Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2. Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
изохорический:
 ,
т.к.
,
т.к.  ;
;изобарический:
 т.к. Р1 =
Р2;
т.к. Р1 =
Р2;изотермический:
 т.к.
т.к.  ;
;адиабатический:
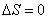 ,
т.к.
,
т.к. 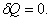
Отметим, что в
последнем случае адиабатический процесс
называют изоэнтропийным
процессом,
т.к. ![]() .
.
Энтропия в изолированной системе
С помощью энтропии формулируются условия достижения термодинамического равновесия системы при постоянстве ее внутренней энергии, объема и числа молей i-го компонента (изолированная система) и условие устойчивости такого равновесия:
![]()
Это означает, что энтропия изолированной системы достигает максимума в состоянии термодинамического равновесия. Самопроизвольные процессы в системе могут протекать только в направлении возрастания энтропии.
Макро и микро состояния.
МАКРОСКОПИЧЕСКОЕ СОСТОЯНИЕ (макросостояние) системы - определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров (напр., Т и p или Т и v).
МИКРОСКОПИЧЕСКОЕ СОСТОЯНИЕ (микросостояние) системы - определяется в классической механике заданием координат и импульсов всех частиц системы. В квантовой механике микроскопическое состояние - квантовое состояние системы, определяемое набором соответствующих квантовых чисел частиц.
Термодинамическая вероятность состояний
Термодинамическая вероятность — число способов, которыми может быть реализовано состояние физической системы. В термодинамике состояние физической системы характеризуется определёнными значениями плотности, давления, температуры и др. измеримых величин. Перечисленные величины определяют состояние системы в целом (её макросостояние). Однако при одной и той же плотности, температуре и т. д. частицы системы могут различными способами распределиться в пространстве и иметь различные импульсы. Каждое данное распределение частиц называется микросостоянием системы. Вероятность термодинамическая (обозначается W) равна числу микросостояний, реализующих данное макросостояние, из чего следует, что W3 = 1 . Вероятность термодинамическая связана с одной из основных макроскопических характеристик системы энтропией S соотношением Больцмана: S = k * ln(W), где k — Больцмана постоянная.
Вероятность термодинамическая не является вероятностью в математическом смысле. Она применяется в статистической физике для определения свойств систем, находящихся в термодинамическом равновесии (для них Вероятность термодинамическая имеет максимальное значение). Для расчёта Вероятность термодинамическая существенно, считаются ли частицы системы различимыми или неразличимыми. Поэтому классическая и квантовая механика приводят к разным выражениям для Вероятность термодинамическая

 ,
или
,
или