
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
27. Диэлектрики и полупроводники.
В зависимости от взаимного расположения валентных зон и зон проводимости все кристаллы делятся на: металлы, полупроводники и диэлектрики. В диэлектриках величина энергии запретной зоны составляет больше 3 эВ, и е под воздействием внешних факторов не могут перейти из валентной зоны в зону проводимости. Такие кристаллы не проводят ток.
В полупроводниках величина энергии запретной зоны составляет от 0,1 до 3 эВ. При низких температурах полупроводники не проводят ток и являются диэлектриками. Под воздействием внешних факторов (температура, кванты света, разность приложенного напряжения) е могут из валентной зоны перейти в зону проводимости. В результате появляется 2 вида проводимости :электронная (в зоне проводимости) и дырочная (в валентной зоне)
28. Полупроводники примесного типа.
Полупроводники – материалы, которые под воздействием внешних факторов резко изменяют свои электрические свойства.

В донорные полупроводники вводятся примеси элементов, имеющие на внешнем валентном слое 5е. в таких полупроводниках возникает дополнительный энергетический уровень, с которого избыточные е легко переходят в зону проводимости. Резко увеличивается электрическая проводимость
В полупроводники акцепторного типа вводятся примеси, на внешнем валентном слое которых недостаток е (обычно 3). Появляется дополнительный энергетический уровень, на который легко переходят е из валентной зоны. Резко увеличивается проводимость полупроводника.
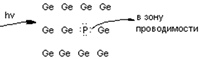
Примесь вводится в количестве 10-6 %. Такое количество увеличивает электронную проводимость от 10-13 до 10-1 Ом-1*см-1. Введение 1 атома серебра на 108 атомов германия приводит к появлению в 1 см3 германия 4,5*1014 е. это в 20 раз больше концентрации собственных носителей е в германии.
29. Собственные полупроводники.
Полупроводники – материалы, которые под воздействием внешних факторов резко изменяют свои электрические свойства.
Полупроводники, обладающие двумя видами проводимости, называются собственными полупроводниками.

30. Закон сохранения энергии. Энтальпия системы.
Закон сохранения энергии (первое начало термодинамики): теплота, подведенная к системе, расходуется на изменение внутренней энергии системы и совершение работы против внешних сил, действующих на эту систему Q=ΔU+A. Внутренняя энергия – полная энергия системы, включающая энергию кинетическую и потенциальную, атомных ядер, электронов, атомов и молекул, энергию движения (поступательного, вращательного и колебательного) атомов и молекул, энергию притяжения и отталкивания между ядрами молекул и атомов. Внутренняя энергия относится к функциям состояния системы, т. е. она не зависит от пути перехода системы из одного состояния в другое. Абсолютные значения внутренней энергии не известны, и всегда определяют только изменение внутренней энергии в результате химических реакций.
Работа – мера энергии, направленная против внешних сил, действующих на систему. Работа не является функцией состояния, она зависит от пути перехода системы из одного состояния в другое.
Теплота – мера энергии, предаваемой от одних тел к другим за счет их различной температуры. В химической термодинамике теплота – это тепловой эффект реакции. Q>0 – теплота выделяется (экзотермический процесс) Q<0 – теплота поглощается (эндотермический процесс) Пусть единственным видом работы, действующей на систему будет давление (A=p∆V) рТ=const Q=ΔU+p(V2-V1)=(U2-U1)+pV2-V1=(U2+pV2)-(U1+pV1).
Энтальпия – функция состояния системы, теплосодержание системы, мера упорядоченности системы (H=U+pV) В изобарно-изотермических условиях энтальпия равна тепловому эффекту, но имеет другой знак ∆Н<0 - экзотермический процесс ∆H>0 - эндотермический процесс
Q=(U2-U1)+p(V2-V1)=U2-U1 – в изохорно-изотермических условиях подведенная к системе теплота полностью расходуется на изменение внутренней энергии.
