
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
Правило
Ван-Гоффа:
при повышении температуры на 100 скорость
химической реакции увеличивается в 2
– 4 раза.
![]() (γ
= 2–4 температурный коэффициент скорости).
(γ
= 2–4 температурный коэффициент скорости).
Аррениус установил в 1866 более точную зависимость скорости реакции от температуры
Уравнение
Аррениуса: ![]()
k – константа скорости ЕА – энергия активации химической реакции А – доля активных молекул
ЕА можно определить графически и экспериментальным путем

Если определить к при двух температурах, то можно найти ЕА

39. Энергия активации химических реакций.
Любая химическая реакция протекает при столкновении отдельных молекул. Однако не все молекулы при столкновении превращаются в конечные продукты, а только их часть. Активные молекулы – молекулы, которые превращаются в конечные продукты Активные молекулы имеют энергию выше, чем среднестатистическая энергия всех молекул
Энергия, необходимая для прохождения химической реакции, и которая выше, чем среднестатистическая, называется энергией активации.
Энергия активации необходима для ослабления химических связей в исходных соединениях и образования новых связей для конечных продуктов Чем меньше энергия активации, тем скорость химической реакции больше. Энергия активации имеет небольшую величину для ионных реакций. Для органических реакций величина энергии активации достаточно большая. Реакции (ЕА>150 кДж/моль) не могут протекать при комнатных температурах, несмотря на то, что с термодинамической точки зрения такие реакции должны протекать.

40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
Необратимыми называются химические реакции, в результате которых образуются твердые или газообразные тела.
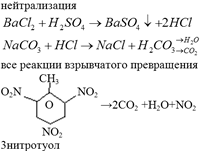 Большинство химических
реакций относятся
к обратимым –
могут протекать справа налево и слева
направо (
Большинство химических
реакций относятся
к обратимым –
могут протекать справа налево и слева
направо (![]() ).
Для
обратимых реакций находят
.
).
Для
обратимых реакций находят
.

Химическое равновесие наступает, если скорость прямой реакции равна скорости обратной.
Это кинетическое условие равновесия. А термодинамическое условие ΔG~0.
![]()
Если наступает химическое равновесие, то можно сосчитать константу равновесия:

константа равновесия – отношение константы скорости прямой реакции к константе скорости обратной
Кр не зависит от концентрации реагирующих веществ, а зависит от температуры, природы реагирующих веществ, наличия/отсутствия катализаторов.

Химическое равновесие – наиболее устойчивое состояние системы. Если изменится какой либо термодинамический параметр, то система переходит в новое равновесное состояние.
41. Смещение химического равновесия. Принцип Ле-Шателье.
Если
изменится какой либо термодинамический
параметр, то система переходит в новое
равновесное состояние.
Переход
системы в новое равновесное состояние
называется смещением (сдвигом) равновесия,
которое определяется принципом Ле
Шателье.
Принцип
Ле Шателье:
если на систему, находящуюся в равновесии,
оказать внешнее воздействие, то
равновесие в системе сместится в ту
сторону, где уменьшится эффект внешнего
воздействия.
Влияние концентрации
При
повышении концентрации исходных
продуктов равновесие смещается в правую
сторону, т. к. В этом случае исходные
продукты расходуются в реакции.
При
увеличении концентрации конечных
продуктов равновесие смещается в левую
сторону (идет обратный процесс)
Давление влияет
на смещение равновесия, если в реакции
участвуют газообразные продукты. Если
жидкости и твердые тела, то давление
никакого влияния не оказывает.
Если
число молей газообразных продуктов до
и после реакции одинаково, то давление
не влияет на равновесие.
При повышении
давления равновесие всегда смещается
в сторону меньшего числа молей
газообразных продуктов. ![]() Температура
Для
эндотермической реакции (ΔН>0) повышение
температуры – благоприятное условие
и равновесие смещается в правую
сторону.
Для экзотермической реакции
благоприятным условием является отвод
тепла, по этому понижение температуры
приводит к смещению равновесия вправо.
Температура
Для
эндотермической реакции (ΔН>0) повышение
температуры – благоприятное условие
и равновесие смещается в правую
сторону.
Для экзотермической реакции
благоприятным условием является отвод
тепла, по этому понижение температуры
приводит к смещению равновесия вправо.
