
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
42. Зонная теория кристаллов.
Общий подход к строению и свойствам кристаллических тел дает зонная теория. Зонная теория базируется на теории молекулярных орбиталей. При образовании кристалла из 2х атомов происходит взаимодействие атомных орбиталей и образование 2х новых молекулярных орбиталей. Одна из них – связывающая, другая – разрыхляющая. Если в образовании кристалла участвуют 4 атома, то 2 связывающих и 2 разрыхляющих. Т. к. в реальных кристаллах число атомов составляет 1022 – 1023, то количество образующихся молекулярных орбиталей представляет большую величину. В результате расщепления образуется энергетическая зхона, в которой разность между энергетическими уровнями представляет величину 10-28 Дж. В этом случае е легко могут переходить с одного уровня на другой в пределах этой энергетической зоны.
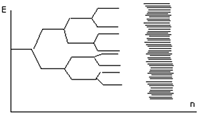
Энергетическая зона охватывает весь кристалл в 3х направлениях. Зоны, образованные внутренними е (не принимающими участие в образовании связи) достаточно узки и не влияют на электропроводность кристалла. А зоны, образованные валентными е, достаточно широки, и они определяют свойства кристаллов.
В соответствии с зонной теорией, зона, в которой находятся валентные е, называется валентной зоной. А зона, имеющая энергию выше, чем валентная зона, и свободная от е, называется зоной проводимости.
Зона между валентной зоной и зоной проводимости – запретная зона.

43. Типы и свойства кристаллов.
В основе всех твердых веществ – кристаллическая решетка. Важнейшей характеристикой кристаллической решетки является ее энергия – энергия, необходимая для разрушения кристалла. Все кристаллические вещества в зависимости от сил, которые связывают отдельные атомы, молекулы, ионы, е делятся на
молекулярные
ковалентные
ионные
металлические
Молекулярные кристаллы. Отдельные молекулы связаны между собой силами Вндер-Вальса (притяжение-отталкивание/силами водородной связи). Энергия кристаллической решетки невелика 10-20 кДж/моль. Непрочные, хрупкие, не проводят электрический ток, обладают низкой теплопроводностью, диэлектрики (H2O, NH3, BF3)
Ковалентные кристаллы. Отдельные атомы связаны между собой химической ковалентной связью.
![]()
Энергия кристаллической решетки 200-500 кДж/моль. Высокая температура плавления, прочные, диапазон электропроводности: от типичных диэлектриков до полупроводников (Si, Ge, ZnS, CdS). В таких кристаллах каждый атом отдает в общее пользование 4е для образования связи, по этому связи упорядоченные, в результате прочная кристаллическая структура.
Ионные кристаллы. Отдельные ионы связаны электростатическими силами. Ионные кристаллы образуются элементами, которые имеют различную электроотрицательность. Такой кристалл имеет структуру, в которой положительно заряженные частицы окружены частицами, несущими отрицательный заряд, а каждая отрицательная частица окружена частицами с противоположным зарядом (NaCl, BaCl2, KBr). энергия кристаллической решетки 500-800 кДж/моль. Прочные, диэлектрики, растворы таких кристаллов – электролиты. Металлические кристаллы. к металлам относятся около 80 элементов, которые обладают следующими свойствами : 1) высокая тепло- и электропроводность 2) металлический блеск 3) высокая ковкость элементы, имеющие небольшое число электронов на внешнем валентном слое (1-3) и большое число вакантных (незаполненных) орбиталей. при кристаллизации атомы упаковываются с максимальной плотностью так, чтобы небольшое число свободных е было доступно для нескольких соседних атомов (8-12) – координационное число. свободные е оказываются не фиксированными у определенного атома и они могут перемещаться внутри кристалла – электродный газ. химическая связь – металлическая. по энергии кристаллической решетки металлы занимают промежуточные состояния между ковалентными и ионными кристаллами.
