
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
9. Поляризация электродов в г.Э.
Поляризация электродов в Г. Э. – изменение потенциала электрода при прохождении по нему электрического тока, по сравнению с равновесным потенциалом. Δφ=φi-φp. φp определяется, когда ток в цепи отсутствует.
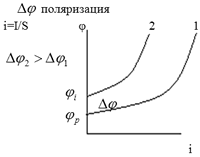
Поляризация электродов связана с замедленностью отдельных стадий химических процессов. 3 стадии электрохимического процесса: 1) подвод реагентов к электроду 2) химическая реакция 3) отвод продуктов реакции от электрода. Если поляризация связана с (1) и (3) стадией, то она называется концентрационной.
![]()
Сi - концентрация ионов в приэлектронном слое.
СV - концентрация ионов в объёме. Концентрационную поляризацию можно уменьшить путем перемешивания растворов. Поляризация, связанная со (2) стадией, называется электрохимической. В химическую реакцию вступают не все частицы, а только те, которые имеют величину энергии большую, чем энергия активации. Для уменьшения электрохимической поляризации можно уменьшить величину энергии активации, используя катализаторы или увеличить температуру (доля активных молекул возрастет).
10. Понятие об электролизе. Электролиз расплавов солей.
Электролиз – совокупность о-в процессов, происходящих при пропускании постоянного электрического тока через раствор или расплав электролита. Электрическая энергия превращается в химическую. Электролиз осуществляется в установках – электролизерах, а в промышленности – электролитических ванных. Простейший электролизер – U-образная трубка, заполненная электролитом, в два колена погружены электроды, которые соединены с источником постоянного тока. Электрод, присоединенный к (-) – катод, заряжен отрицательно, сюда подаются е, однако на катоде протекает реакция восстановления. Электрод, присоединенный к (+) – анод, заряжен положительно, окисление. Наиболее легко протекает электролиз расплавов солей, т. к. в расплаве не присутствует других веществ.
![]()
1 закон Фарадея: масса вещества, выделившегося на электроде пропорциональна силе тока и времени, в течение которого протекает этот ток. m=kIτη k – электрохимический эквивалент (k=э/F (э – химический эквивалент)) η - выход по току (95-99%)
11. Электролиз водных растворов солей.
Электролиз водных растворов солей протекает сложнее, чем электролиз расплавов, т. к. на электродах наблюдается конкуренция между ионами электролита и молекулами воды. Процессы на катоде: 1) восстановление (восстанавливаются наиболее сильные окислители, в первую очередь - ионы и молекулы, имеющие большее значение φ) 2) металлы, стоящие в ряду напряжений до Al (имеют низкий φ), активные металлы никогда не восстанавливаются на катоде. В этом случае идет восстановление воды или других ионов (φAl=-1,66В) 3) металлы, стоящие в ряду напряжений после водорода (φ>0) всегда восстанавливаются на катоде 4) металлы, стоящие от алюминия до водорода, в зависимости от условий проведения электролиза, могут восстанавливаться, а могут и не восстанавливаться - это зависит от кислотности среды и силы тока. 5) молекулы воды могут восстанавливаться на катоде по следующим уравнениям реакций:
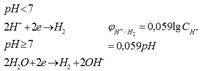
Процессы на аноде:
1) окисление (в первую очередь окисляются наиболее сильные восстановители, с меньшими значением φ) 2) кислотные остатки кислоролосодержаших кислот никогда не окисляются на аноде, т. к. имеют большое значение φ, в этом случае происходит окисление воды.
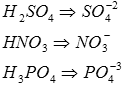
3)молекулы воды могут окисляться на аноде по следующим уравнениям реакций
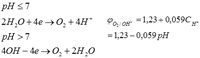
Материал анода может принимать участие в электролизе, т. е. окисляться (активный анод). При электролизе наблюдается поляризация электродов. Это явление следует учитывать.
