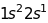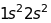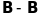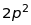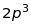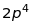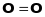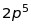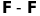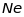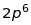- •Глава 2. Корпускулярні та хвильові властивості частинок
- •2.1. Відкриття корпускул
- •2.2. Вимірювання заряду електрона. Досліди Міллікена
- •Таким чином, у цих дослідах вдалося виміряти найменший від’ємний заряд речовини і його приписали зарядові електрона. За ці класичні досліди Мілікен у 1923 році був відзначений Нобелівською премією.
- •2.3. Маси атомів. Ізотопи
- •2.4. Релятивістські частинки. Рівняння їх руху
- •2.5. Зв’язок між масою, енергією та імпульсом
- •Розсіяння електронів розрідженими газами
- •2.7. Класичний розгляд розсіяння
- •- Кут розсіяння, - прицільна відстань, :
- •2.8. Зміна інтенсивності потоку частинок внаслідок розсіяння в речовині
- •2.9. Довжина вільного пробігу частинки в речовині
- •2.11. Ефект Рамзауера
- •На атомах Ar.
- •2.12. Неможливість пояснення процесів розсіяння електронів на основі класичних уявлень про електрон, як корпускулу
- •Висновки
- •Глава 3. Експериментальні передумови сучасної теорії атома
- •3.1. Досліди Резерфорда з розсіяння -частинок
- •3.2. Формула Резерфорда
- •3.3. Планетарна модель атома, труднощі її пояснення на підставі класичних уявлень
- •3.4. Загальні характеристики атомних спектрів
- •3.5. Спектральні терми
- •3.6. Комбінаційний принцип (Рідберга-Рітца)
- •3.7. Спектр атомів водню
- •3.8. Досліди Франка і Герца
- •3.9. Визначення потенціалів іонізації атомів
- •3.10. Висновки
- •Глава 4. Атом водню в моделі бора
- •4.1.Постулати Бора
- •4.2. Рівні енергії та стаціонарні орбіти
- •4.3. Позитроній та мезоатом
- •4.4. Еліптичні орбіти. Головне та орбітальне квантові числа.
- •4.5. Висновки
- •Глава 5. Хвильова природа матерії
- •5.1. Передумови пізнання хвильової природи матерії
- •5.1.1. Квантова природа випромінювання світла
- •Квантова природа поглинання світла
- •Короткохвильова границя неперервного спектра рентгенівських променів
- •Суцільного спектра рентгенівських променіввід енергії електронів .
- •5.1.4. Ефект Комптона
- •Розсіяних рентгенівських променів при різних кутах розсіяння .
- •В ефекті Комптона.
- •5.1.5. Некогерентне розсіяння квантів на електронах
- •5.1.6. Оптико-механічна аналогія
- •5.2. Гіпотеза та формула де Бройля
- •5.3. Експериментальне обґрунтування хвильової природи матерії
- •5.3.1. Досліди Рамзауера
- •5.3.2. Досліди Девісона та Джермера з відбиття електронів від граней монокристалів
- •Розсіяних електронів поверхнями речовини: а) аморфної, б) кристалічної, в-ж) кристалічної при різних енергіях електронів.
- •Променями, що відбиваються від двох сіткових площин:
- •5.3.3. Досліди Томсона по проходженню електронів крізь тонкі плівки речовини
- •5.4. Дифракція та інтерференція інших частинок та атомів
- •5.5. Дифракція поодиноких електронів
- •5.6.Визначення довжини хвилі де Бройля матеріальних частинок із дослідів по дифракції електронів на кристалах
- •5.7. Електронографія та нейтронографія
- •5.8. Висновки
- •Глава 6. Хвильова функція електронів та її фізичний зміст
- •6.1. Хвильова функція плоскої хвилі де Бройля
- •6.2. Хвильовий пакет, як модель частинки та її недосконалість
- •6.3. Фізичний зміст хвильової функції
- •Співвідношення невизначеностей
- •6.5. Висновки
- •Глава 7. Рівняння шредінґера
- •7.1. Рівняння Шредінґера
- •7.2. Найпростіші випадки розв’язку рівнянь Шредінґера
- •Частинка в потенціальній ямі з нескінченними стінками
- •7.2.2. Частинка в потенціальній ямі зі скінченними стінками
- •7.3. Гармонічний осцилятор
- •7.4. Прозорість потенціального бар’єра (тунелювання)
- •7.5. Оператори
- •7.6. Висновки
- •Глава 8. Уявлення про будову атома водню у квантовій механіці
- •8.1. Схема розв’язку рівняння Шредінґера для атома водню
- •8.2. Кутова частина рівняння Шредінґера
- •8.3. Кутовий розподіл густини ймовірності знайти електрон в атомі водню. Електронна хмара.
- •8.4. Атомні орбіталі атома водню
- •8.5. Фізичний зміст квантових чисел та
- •8.6. Просторове квантування
- •8.7. Радіальна частина хвильової функції електрона атома водню
- •8.8. Радіальний розподіл електронної хмари атома водню
- •Густини стану атому н: а) ; б) контурна карта;
- •8.9. Квантові числа та їх фізичний зміст
- •8.10. Правила відбору квантових чисел
- •8.11. Висновки
- •Глава 9. Експериментальні дані про будову та властивості складних атомів
- •9.1. Структура атомів лужних металів, валентний електрон
- •9.2. Зняття виродження за квантовим числом
- •9.3. Спектральні серії атомних спектрів лужних металів
- •9.4. Дублетна структура термів та спектральних ліній атомів лужних металів
- •9.5. Спін електрона
- •9.6. Сума моментів кількості руху
- •9.7. Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії
- •На ядрі, б) – початок координат на електроні, в) – розщеплення рівнів.
- •Особливості тонкої структури атомних спектрів лужних металів
- •Надтонка структура спектральних термів атомів лужних металів
- •9.10. Висновки
- •Глава 10. Тонка структура атомного спектра водню
- •10.1. Тонка структура спектральних ліній атомного спектра водню. Спін-орбітальна взаємодія
- •10.2. Надтонка структура ліній атомного спектра водню
- •10.3. Досліди Лемба і Різерфорда з вимірювання зміщення енергетичних рівнів атомів водню
- •Частоти електромагнітних хвиль, що опромінюють потік збуджених атомів водню.
- •Зсув та надтонка структура основного терму за рахунок впливу спіну ядра.
- •10.4. Поняття про нульові коливання та поляризацію вакууму як причини лембівського зсуву
- •10.5. Висновки
- •Глава 11. Векторна модель атома
- •11.1. Векторна модель атома. Типи зв’язку
- •11.2. Нормальний (l-s) або Рассел-Саундеровський зв’язок
- •11.3. Квантові числа складних атомів
- •11.4. Правила відбору
- •11.5. Правила Хунда (Гунда)
- •11.6. Систематика спектрів складних атомів з нормальним зв’язком
- •11.7. Приклади застосування векторної моделі атома
- •11.9. Висновки
- •12. Атом гелію
- •12.1. Рівняння Шредінґера для двохелектронного атома
- •12.2. Метод збурень
- •12.3. Принцип Паулі
- •12.4. Вплив антисиметричності хвильових функцій на стаціонарні стани атому Не
- •12.5. Висновки
- •Глава 13. Інтенсивність та ширина спектральних ліній
- •Ймовірність переходів
- •Золоте правило Фермі
- •Сила осцилятора
- •13.4. Поглинання світла
- •13.5. Інтенсивність спектральних ліній
- •13.6. Ширина спектральних ліній
- •13.7. Принципи генерації електромагнітних коливань (лазери)
- •- Дзеркала резонатора, 2-робоче тіло,
- •Рубіновий лазер
- •13.8. Висновки
- •Глава 14. Будова та заповнення оболонок складних атомів. Теорія періодичної системи елементів д.І. Менделєєва
- •14.1. Послідовність заповнення електронних
- •Оболонок атомів
- •14.2. Періодична система елементів
- •14.3. Недоліки квантової моделі періодичної системи елементів
- •14.4. Прикінцеві зауваження
- •Глава 15. Рентгенівські промені
- •15.1. Характеристичний спектр рентгенівських променів
- •Спектри поглинання рентгенівських променів
- •15.4. Висновки
- •Глава 16. Магнітні властивості атомів
- •16.1. Орбітальний та спіновий магнетизм. Магнетон Бора
- •Сумарний магнітний момент кількості руху. Множник Ланде
- •Розкладемо вектор на паралельну і перпендикулярну складові
- •Просторове квантування
- •Гіромагнітні ефекти
- •Досліди Штерна й Герлаха
- •16.6. Сучасні методи визначення атомних магнітних моментів
- •16.6.1. Електронний парамагнітний резонанс (епр)
- •Таким чином метод епр дозволяє отримувати такі результати:
- •16.6.2. Надтонка структура ліній епр
- •У магнітному полі з урахуванням ядерного спіну.
- •16.6.3. Резонансний метод Рабі дослідження магнітних моментів атомних ядер
- •16.6.4. Ядерний магнітний резонанс (ямр).
- •16.7. Значення магніто-резонансних методів для визначення атомних магнітних моментів
- •Висновки
- •Глава 17. Вплив магнітного та електричного полів на атоми
- •17.1. Ефект Зеємана
- •(Частота Лармора)
- •17.2. Аномальний ефект Зеємана і його квантова теорія
- •Ефект Пашена і Бака
- •17.4. Поляризація світла при ефекті Зеємана
- •Ефект Штарка
- •Сукупність атомів у магнітному полі
- •17.6.А. Парамагнетизм
- •17.6.Б. Діамагнетизм речовини. Теорема Лармора
- •17.7. Циклотронний резонанс
- •(А) та ділянки спектра поглинання при ньому (б, в і г).
- •17.8. Висновки
- •Глава 18. Природа хімічного зв'язку
- •18.1. Вступ
- •18.2. Іонний зв’язок
- •При ця задача, як і в главі 13, розділяється на дві незалежних задачі для не взаємодіючих атомів водню, для яких існує розв’язок у вигляді: , ; , .
- •18.4. Сили Ван-дер-Ваальса
- •18.5. Водневий зв’язок
- •18.6. Метод валентного зв’язку
- •18.7. Метод молекулярних орбіталей
- •18.8. Гібридизація орбіталей
- •18.9. Висновки
- •Глава 19. Спектри молекул
- •19.1. Загальна характеристика
- •19.2. Обертальні спектри молекул
- •Обертального спектру.
- •19.3. Коливальні спектри молекул
- •19.4. Коливально-обертальні спектри молекул
- •19.5. Електронні стани
- •Принцип Франка-Кондона. Якісне пояснення інтенсивності ліній молекулярних спектрів
- •19.7. Комбінаційне розсіяння світла
- •Висновки
- •Глава 20. Квантові властивості твердих тіл
- •20.1. Вступ
- •20.2. Електрон у полі періодичного потенціалу
- •20.3. Модель Кроніга – Пені
- •20.4. Зони Бріллюена
- •20.5. Заповнення зон електронами
- •20.6. Густина станів
- •(А) та його енергетичні рівні (б).
- •20.7. Динаміка електронів, ефективна маса, електрони та дірки
- •20.8. Ефект Холла
- •20.9. Електропровідність металів
- •20.10. Особливості власних напівпровідників
- •20.11. Домішкові напівпровідники
- •I(V) характеристика.
- •20.13. Магнітні властивості твердих тіл
- •20.14. Обмінний гамільтоніан Гeйзенберга. Спонтанна намагніченість, феромагнетизм та антиферомагнетизм
- •20.15. Феромагнітні домени, стінки Блоха
- •20.16. Спінові хвилі
- •20.17. Надпровідність
- •20.18. Магнітні властивості надпровідників
- •20.19. Квантування магнітного потоку
- •20.20. Критичний струм і критичне магнітне поле
- •20.21. Ефекти Джозефсона
- •20.22. Високотемпературна надпровідність
- •20.23. Прикінцеві зауваження
18.6. Метод валентного зв’язку
Кількісна
теорія потребує складних розрахунків.
Тому на практиці для аналізу молекул
використовують різні моделі, наприклад,
моделі:
валентного зв’язку і молекулярних
орбіталей. У
моделі валентного зв’язку молекула
розглядається як група атомів, з’єднаних
між собою ковалентними зв’язками. Вони
утворюються двома електронними з
антипаралельними спінами по одному від
кожного атома, що взаємодіє. Позитивною
рисою цієї моделі є можливість зображення
молекул у вигляді простих хімічних
формул, таких як
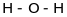 ;
;
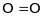 ;
;
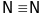 ,тощо. Такий зв’язок утворюють лише
електрони незаповнених оболонок (див.
таблицю 18.1).
,тощо. Такий зв’язок утворюють лише
електрони незаповнених оболонок (див.
таблицю 18.1).
З
таблиці 18.1 видно, що
валентність по відношенню до водню
дорівнює подвоєному значенню повного
спінового числа
,
тобто вона
дорівнює
кількості неспарених електронів.
Цей метод широко використовується в
хімії. Проте іноді він призводить до
невірних результатів. Наприклад, у
молекулах
 та
та
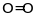 сумарне спінове число
,
бо всі їхні спіни спарені. Молекули з
,
повинні бути діамагнітними, а в дійсності
вони парамагнітні, що не пояснює модель
валентних зв’язків. Для цього потрібно
застосувати більш досконалу модель
молекулярних орбіталей.
сумарне спінове число
,
бо всі їхні спіни спарені. Молекули з
,
повинні бути діамагнітними, а в дійсності
вони парамагнітні, що не пояснює модель
валентних зв’язків. Для цього потрібно
застосувати більш досконалу модель
молекулярних орбіталей.
Таблиця 18.1. Електронна конфігурація і валентність по відношенню до водню в методі валентного звязку
|
|
ел. конфі-гурація |
Заселеність |
валентн. |
формула |
енерг. еВ |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
1 |
|
4.7 |
|||
|
2 |
|
|
|
|
|
|
0 |
- |
- |
|||
|
3 |
|
|
|
|
|
|
1 |
|
1.0 |
|||
|
4 |
|
|
|
|
|
|
0 |
- |
- |
|||
|
5 |
-
|
|
|
|
|
|
1 |
|
2.3 |
|||
|
6 |
-
|
|
|
|
|
|
2 |
|
6.5 |
|||
|
7 |
-
|
|
|
|
|
|
3 |
|
9.8 |
|||
|
8 |
-
|
|
|
|
|
|
2 |
|
5.1 |
|||
|
9 |
-
|
|
|
|
|
|
1 |
|
1.6 |
|||
|
10 |
-
|
|
|
|
|
|
0 |
- |
- |
|||

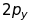
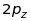
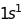
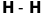
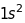
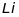 i
i