
- •Глава 2. Корпускулярні та хвильові властивості частинок
- •2.1. Відкриття корпускул
- •2.2. Вимірювання заряду електрона. Досліди Міллікена
- •Таким чином, у цих дослідах вдалося виміряти найменший від’ємний заряд речовини і його приписали зарядові електрона. За ці класичні досліди Мілікен у 1923 році був відзначений Нобелівською премією.
- •2.3. Маси атомів. Ізотопи
- •2.4. Релятивістські частинки. Рівняння їх руху
- •2.5. Зв’язок між масою, енергією та імпульсом
- •Розсіяння електронів розрідженими газами
- •2.7. Класичний розгляд розсіяння
- •- Кут розсіяння, - прицільна відстань, :
- •2.8. Зміна інтенсивності потоку частинок внаслідок розсіяння в речовині
- •2.9. Довжина вільного пробігу частинки в речовині
- •2.11. Ефект Рамзауера
- •На атомах Ar.
- •2.12. Неможливість пояснення процесів розсіяння електронів на основі класичних уявлень про електрон, як корпускулу
- •Висновки
- •Глава 3. Експериментальні передумови сучасної теорії атома
- •3.1. Досліди Резерфорда з розсіяння -частинок
- •3.2. Формула Резерфорда
- •3.3. Планетарна модель атома, труднощі її пояснення на підставі класичних уявлень
- •3.4. Загальні характеристики атомних спектрів
- •3.5. Спектральні терми
- •3.6. Комбінаційний принцип (Рідберга-Рітца)
- •3.7. Спектр атомів водню
- •3.8. Досліди Франка і Герца
- •3.9. Визначення потенціалів іонізації атомів
- •3.10. Висновки
- •Глава 4. Атом водню в моделі бора
- •4.1.Постулати Бора
- •4.2. Рівні енергії та стаціонарні орбіти
- •4.3. Позитроній та мезоатом
- •4.4. Еліптичні орбіти. Головне та орбітальне квантові числа.
- •4.5. Висновки
- •Глава 5. Хвильова природа матерії
- •5.1. Передумови пізнання хвильової природи матерії
- •5.1.1. Квантова природа випромінювання світла
- •Квантова природа поглинання світла
- •Короткохвильова границя неперервного спектра рентгенівських променів
- •Суцільного спектра рентгенівських променіввід енергії електронів .
- •5.1.4. Ефект Комптона
- •Розсіяних рентгенівських променів при різних кутах розсіяння .
- •В ефекті Комптона.
- •5.1.5. Некогерентне розсіяння квантів на електронах
- •5.1.6. Оптико-механічна аналогія
- •5.2. Гіпотеза та формула де Бройля
- •5.3. Експериментальне обґрунтування хвильової природи матерії
- •5.3.1. Досліди Рамзауера
- •5.3.2. Досліди Девісона та Джермера з відбиття електронів від граней монокристалів
- •Розсіяних електронів поверхнями речовини: а) аморфної, б) кристалічної, в-ж) кристалічної при різних енергіях електронів.
- •Променями, що відбиваються від двох сіткових площин:
- •5.3.3. Досліди Томсона по проходженню електронів крізь тонкі плівки речовини
- •5.4. Дифракція та інтерференція інших частинок та атомів
- •5.5. Дифракція поодиноких електронів
- •5.6.Визначення довжини хвилі де Бройля матеріальних частинок із дослідів по дифракції електронів на кристалах
- •5.7. Електронографія та нейтронографія
- •5.8. Висновки
- •Глава 6. Хвильова функція електронів та її фізичний зміст
- •6.1. Хвильова функція плоскої хвилі де Бройля
- •6.2. Хвильовий пакет, як модель частинки та її недосконалість
- •6.3. Фізичний зміст хвильової функції
- •Співвідношення невизначеностей
- •6.5. Висновки
- •Глава 7. Рівняння шредінґера
- •7.1. Рівняння Шредінґера
- •7.2. Найпростіші випадки розв’язку рівнянь Шредінґера
- •Частинка в потенціальній ямі з нескінченними стінками
- •7.2.2. Частинка в потенціальній ямі зі скінченними стінками
- •7.3. Гармонічний осцилятор
- •7.4. Прозорість потенціального бар’єра (тунелювання)
- •7.5. Оператори
- •7.6. Висновки
- •Глава 8. Уявлення про будову атома водню у квантовій механіці
- •8.1. Схема розв’язку рівняння Шредінґера для атома водню
- •8.2. Кутова частина рівняння Шредінґера
- •8.3. Кутовий розподіл густини ймовірності знайти електрон в атомі водню. Електронна хмара.
- •8.4. Атомні орбіталі атома водню
- •8.5. Фізичний зміст квантових чисел та
- •8.6. Просторове квантування
- •8.7. Радіальна частина хвильової функції електрона атома водню
- •8.8. Радіальний розподіл електронної хмари атома водню
- •Густини стану атому н: а) ; б) контурна карта;
- •8.9. Квантові числа та їх фізичний зміст
- •8.10. Правила відбору квантових чисел
- •8.11. Висновки
- •Глава 9. Експериментальні дані про будову та властивості складних атомів
- •9.1. Структура атомів лужних металів, валентний електрон
- •9.2. Зняття виродження за квантовим числом
- •9.3. Спектральні серії атомних спектрів лужних металів
- •9.4. Дублетна структура термів та спектральних ліній атомів лужних металів
- •9.5. Спін електрона
- •9.6. Сума моментів кількості руху
- •9.7. Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії
- •На ядрі, б) – початок координат на електроні, в) – розщеплення рівнів.
- •Особливості тонкої структури атомних спектрів лужних металів
- •Надтонка структура спектральних термів атомів лужних металів
- •9.10. Висновки
- •Глава 10. Тонка структура атомного спектра водню
- •10.1. Тонка структура спектральних ліній атомного спектра водню. Спін-орбітальна взаємодія
- •10.2. Надтонка структура ліній атомного спектра водню
- •10.3. Досліди Лемба і Різерфорда з вимірювання зміщення енергетичних рівнів атомів водню
- •Частоти електромагнітних хвиль, що опромінюють потік збуджених атомів водню.
- •Зсув та надтонка структура основного терму за рахунок впливу спіну ядра.
- •10.4. Поняття про нульові коливання та поляризацію вакууму як причини лембівського зсуву
- •10.5. Висновки
- •Глава 11. Векторна модель атома
- •11.1. Векторна модель атома. Типи зв’язку
- •11.2. Нормальний (l-s) або Рассел-Саундеровський зв’язок
- •11.3. Квантові числа складних атомів
- •11.4. Правила відбору
- •11.5. Правила Хунда (Гунда)
- •11.6. Систематика спектрів складних атомів з нормальним зв’язком
- •11.7. Приклади застосування векторної моделі атома
- •11.9. Висновки
- •12. Атом гелію
- •12.1. Рівняння Шредінґера для двохелектронного атома
- •12.2. Метод збурень
- •12.3. Принцип Паулі
- •12.4. Вплив антисиметричності хвильових функцій на стаціонарні стани атому Не
- •12.5. Висновки
- •Глава 13. Інтенсивність та ширина спектральних ліній
- •Ймовірність переходів
- •Золоте правило Фермі
- •Сила осцилятора
- •13.4. Поглинання світла
- •13.5. Інтенсивність спектральних ліній
- •13.6. Ширина спектральних ліній
- •13.7. Принципи генерації електромагнітних коливань (лазери)
- •- Дзеркала резонатора, 2-робоче тіло,
- •Рубіновий лазер
- •13.8. Висновки
- •Глава 14. Будова та заповнення оболонок складних атомів. Теорія періодичної системи елементів д.І. Менделєєва
- •14.1. Послідовність заповнення електронних
- •Оболонок атомів
- •14.2. Періодична система елементів
- •14.3. Недоліки квантової моделі періодичної системи елементів
- •14.4. Прикінцеві зауваження
- •Глава 15. Рентгенівські промені
- •15.1. Характеристичний спектр рентгенівських променів
- •Спектри поглинання рентгенівських променів
- •15.4. Висновки
- •Глава 16. Магнітні властивості атомів
- •16.1. Орбітальний та спіновий магнетизм. Магнетон Бора
- •Сумарний магнітний момент кількості руху. Множник Ланде
- •Розкладемо вектор на паралельну і перпендикулярну складові
- •Просторове квантування
- •Гіромагнітні ефекти
- •Досліди Штерна й Герлаха
- •16.6. Сучасні методи визначення атомних магнітних моментів
- •16.6.1. Електронний парамагнітний резонанс (епр)
- •Таким чином метод епр дозволяє отримувати такі результати:
- •16.6.2. Надтонка структура ліній епр
- •У магнітному полі з урахуванням ядерного спіну.
- •16.6.3. Резонансний метод Рабі дослідження магнітних моментів атомних ядер
- •16.6.4. Ядерний магнітний резонанс (ямр).
- •16.7. Значення магніто-резонансних методів для визначення атомних магнітних моментів
- •Висновки
- •Глава 17. Вплив магнітного та електричного полів на атоми
- •17.1. Ефект Зеємана
- •(Частота Лармора)
- •17.2. Аномальний ефект Зеємана і його квантова теорія
- •Ефект Пашена і Бака
- •17.4. Поляризація світла при ефекті Зеємана
- •Ефект Штарка
- •Сукупність атомів у магнітному полі
- •17.6.А. Парамагнетизм
- •17.6.Б. Діамагнетизм речовини. Теорема Лармора
- •17.7. Циклотронний резонанс
- •(А) та ділянки спектра поглинання при ньому (б, в і г).
- •17.8. Висновки
- •Глава 18. Природа хімічного зв'язку
- •18.1. Вступ
- •18.2. Іонний зв’язок
- •При ця задача, як і в главі 13, розділяється на дві незалежних задачі для не взаємодіючих атомів водню, для яких існує розв’язок у вигляді: , ; , .
- •18.4. Сили Ван-дер-Ваальса
- •18.5. Водневий зв’язок
- •18.6. Метод валентного зв’язку
- •18.7. Метод молекулярних орбіталей
- •18.8. Гібридизація орбіталей
- •18.9. Висновки
- •Глава 19. Спектри молекул
- •19.1. Загальна характеристика
- •19.2. Обертальні спектри молекул
- •Обертального спектру.
- •19.3. Коливальні спектри молекул
- •19.4. Коливально-обертальні спектри молекул
- •19.5. Електронні стани
- •Принцип Франка-Кондона. Якісне пояснення інтенсивності ліній молекулярних спектрів
- •19.7. Комбінаційне розсіяння світла
- •Висновки
- •Глава 20. Квантові властивості твердих тіл
- •20.1. Вступ
- •20.2. Електрон у полі періодичного потенціалу
- •20.3. Модель Кроніга – Пені
- •20.4. Зони Бріллюена
- •20.5. Заповнення зон електронами
- •20.6. Густина станів
- •(А) та його енергетичні рівні (б).
- •20.7. Динаміка електронів, ефективна маса, електрони та дірки
- •20.8. Ефект Холла
- •20.9. Електропровідність металів
- •20.10. Особливості власних напівпровідників
- •20.11. Домішкові напівпровідники
- •I(V) характеристика.
- •20.13. Магнітні властивості твердих тіл
- •20.14. Обмінний гамільтоніан Гeйзенберга. Спонтанна намагніченість, феромагнетизм та антиферомагнетизм
- •20.15. Феромагнітні домени, стінки Блоха
- •20.16. Спінові хвилі
- •20.17. Надпровідність
- •20.18. Магнітні властивості надпровідників
- •20.19. Квантування магнітного потоку
- •20.20. Критичний струм і критичне магнітне поле
- •20.21. Ефекти Джозефсона
- •20.22. Високотемпературна надпровідність
- •20.23. Прикінцеві зауваження
Рис.9.6.
Схема спін-орбітального зв’язку:
а) – початок координат
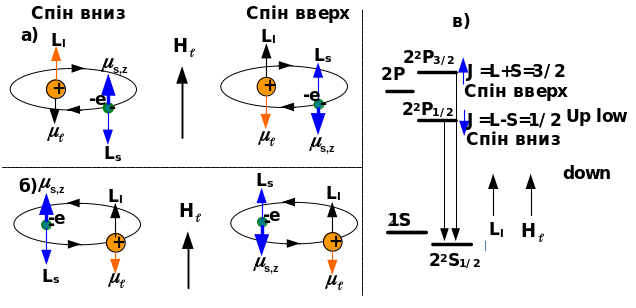
На ядрі, б) – початок координат на електроні, в) – розщеплення рівнів.
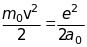 ,
отримаємо
,
отримаємо
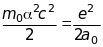 .
Із цього співвідношення отримаємо вираз
для сталої
тонкої структури
.
Із цього співвідношення отримаємо вираз
для сталої
тонкої структури
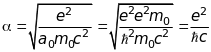 . (9.27)
. (9.27)
Стала
тонкої структури
- фундаментальна фізична стала, яка
визначає величину розщеплення спектральний
ліній. У рамках напівквантової теорії
Бора для атома водню вона характеризує
швидкість електрона на першій борівській
орбіті
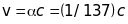 .
.
Визначимо абсолютну величину напруженості магнітного поля , що створюється рухом ядра навколо електрона, через сталу тонкої структури
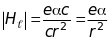 (9.28)
(9.28)
Підставивши
(9.28)
у вираз для енергії спін-орбітальної
взаємодії для атома водню (9.26) і враховуючи
значення радіуса Бора і енергій
 отримаємо:
отримаємо:
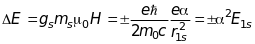 . (9.29)
. (9.29)
Енергія
спін-орбітальної взаємодії залежить
від квадрата сталої тонкої структури
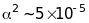 ,
яка згідно (9.27), – мала величина
,
яка згідно (9.27), – мала величина
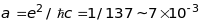 ,
тому спін-орбітальна взаємодія значно
менша за енергію стаціонарного стану
,
тому спін-орбітальна взаємодія значно
менша за енергію стаціонарного стану
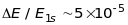 .
Але вона збільшується у
.
Але вона збільшується у
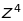 разів
для воднеподібних систем із зарядом
ядра
,
що вже відчутно для спектрів лужних
металів.
разів
для воднеподібних систем із зарядом
ядра
,
що вже відчутно для спектрів лужних
металів.
Енергія
спін-орбітальної взаємодії залежить
від магнітного спінового квантового
числа ms,
яке може мати два значення 1/2.
Це означає, що спін-орбітальна взаємодія
призводить до розщеплення енергетичних
рівнів стаціонарного стану на два
підрівні з
енергіями
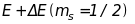 і
і
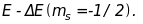 Ці два рівні енергії відповідають двом
значенням квантового числа сумарного
моменту кількості руху
,
Ці два рівні енергії відповідають двом
значенням квантового числа сумарного
моменту кількості руху
,
або
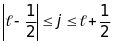
Для кожного числа одноелектронного атома є два значення числа :
 (9.30)
(9.30)
В
окремому випадку, коли
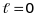 (
- стан)
(
- стан)
 (9.31)
(9.31)
Таким чином, стаціонарні стани водневоподібних атомів лужних металів з одним валентним електроном визначаються трьома квантовими числами , і . Їх терми прийнято позначати:
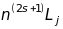 ,
,
де
-
називається
мультиплетністю
термів,
- головне квантове число. (Стани електронів
в атомі позначаються
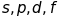 ,
а терми
,
а терми
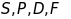 ).
).
Особливості тонкої структури атомних спектрів лужних металів
Таблиця 9.3. Терми Na |
|||
n |
|
j |
терм |
3 |
0 |
1/2 |
32S1/2 |
|
1 |
1/2 |
32P1/2 |
|
|
3/2 |
32P3/2 |
|
2 |
3/2 |
32D3/2 |
|
|
5/2 |
32D5/2 |
4 |
0 |
1/2 |
42S1/2 |
|
1 |
1/2 |
42P1/2 |
|
|
3/2 |
42P3/2 |
|
2 |
3/2 |
42D3/2 |
|
|
5/2 |
42D5/2 |
|
3 |
5/2 |
42F5/2 |
|
|
7/2 |
42F7/2 |
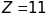 .
Його валентний електрон знаходиться в
не збудженому стані на енергетичному
рівні з головним квантовим числом
.
Його валентний електрон знаходиться в
не збудженому стані на енергетичному
рівні з головним квантовим числом
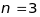 .
Декілька його термів
.
Декілька його термів
наведені
в таблиці 9.3, де для їх характеристик
використані стандартні позначення
термів. Терми натрію мають бути дублетними,
тому що
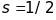 ,
мультиплетність
термів дорівнює
,
мультиплетність
термів дорівнює
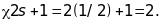 Між енергетичними рівнями можуть мати
місце спонтанні переходи, якщо виконуються
правила відбору. Застосування правила
відбору для дипольних переходів
Між енергетичними рівнями можуть мати
місце спонтанні переходи, якщо виконуються
правила відбору. Застосування правила
відбору для дипольних переходів
 дозволило
отримати такі спектральні серії
(рис.9.7).
дозволило
отримати такі спектральні серії
(рис.9.7).
Рис.9.7.
Схема термів і переходів між ними для
атомів
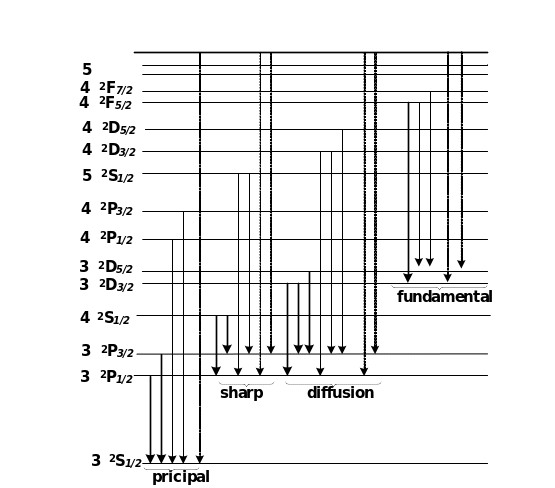
 .
.
Головна серія (principal)
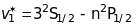

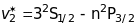 .
.
лінії
цієї серії дублети, в яких
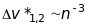 .
.
Друга побічна серія ( sharp )
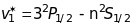 ,
, 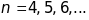
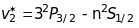 ,
,
різниця хвильових чисел дублетів цієї серії не залежить від квантового числа .
Дифузна серія (diffusion) або перша побічна
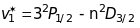
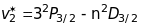
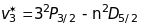
лінії
цієї серії - триплети, у яких
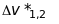 не залежить від квантового числа
,
а
не залежить від квантового числа
,
а
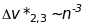 .
Крім цих серій є ще фундаментальна серія
( рис. 9.7)
.
Крім цих серій є ще фундаментальна серія
( рис. 9.7)
Таким
чином, ми встановили мультиплетну
структуру ліній основних серій спектрів
атомів лужних металів і якісно вказали
на залежність величини розщеплення
лінії від головного квантового числа.
Все
це дає підставу стверджувати, що причиною
виникнення тонкої структури термів і
спектральних ліній атомних спектрів
лужних металів
є
спін-орбітальна взаємодія. Під
час розгляду складних багатоелектронних
атомів потрібно враховувати обертальну
складову енергії
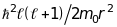 .
Їх вплив призводить до появи залежності
Е не тільки від n,
але й від квантового числа
,
тому можуть мати місце випадки, коли
.
Їх вплив призводить до появи залежності
Е не тільки від n,
але й від квантового числа
,
тому можуть мати місце випадки, коли
 .
Цей ефект збільшується пропорційно
.
Цей ефект збільшується пропорційно
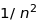 .
Рівняння Шредінґера не дає кількісних
величин розщеплення термів, бо воно не
релятивістське, а в основі спін-орбітальної
взаємодії лежить релятивістська магнітна
взаємодія спінового і орбітального
магнітних моментів. Для врахування
магнітної взаємодії потрібно знайти
нове фундаментальне рівняння, яке
повинно бути інваріантним по відношенню
до перетворень Лоренца. Таке рівняння
було запропоновано нобелівським
лауреатом Полем
Діраком.
.
Рівняння Шредінґера не дає кількісних
величин розщеплення термів, бо воно не
релятивістське, а в основі спін-орбітальної
взаємодії лежить релятивістська магнітна
взаємодія спінового і орбітального
магнітних моментів. Для врахування
магнітної взаємодії потрібно знайти
нове фундаментальне рівняння, яке
повинно бути інваріантним по відношенню
до перетворень Лоренца. Таке рівняння
було запропоновано нобелівським
лауреатом Полем
Діраком.
Розв’язок цього рівняння для найпростішого атома водню з урахуванням спін-орбітальної взаємодії дало величину енергії розщеплення термів, значення якої досить добре збігається з експериментальним. Воно виявилось прямо пропорційним квадрату сталої тонкої структури і квадрату атомного номера , та значенню
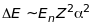 (9.32)
(9.32)
або точніше
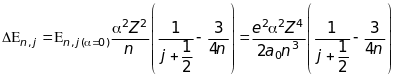 (9.33)
(9.33)
де
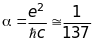 - стала тонкої структури, а
- стала тонкої структури, а
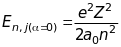 - енергія стаціонарного стану без
врахування спін-орбітальної взаємодії.
З формули (9.33) видно, що величина
спін-орбітального розщеплення залежить
лише від двох квантових чисел
і
- енергія стаціонарного стану без
врахування спін-орбітальної взаємодії.
З формули (9.33) видно, що величина
спін-орбітального розщеплення залежить
лише від двох квантових чисел
і
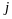 і не залежить для атома водню від
орбітального квантового числа
.
Тому у
атома водню зберігається виродження
за орбітальним
квантовим
числом
.
При переході від атома водню до атомів
лужних металів з одним валентним
електроном виродження за числом
знімається, а величина розщеплення
збільшується в
і не залежить для атома водню від
орбітального квантового числа
.
Тому у
атома водню зберігається виродження
за орбітальним
квантовим
числом
.
При переході від атома водню до атомів
лужних металів з одним валентним
електроном виродження за числом
знімається, а величина розщеплення
збільшується в
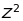 разів. Тому тонка
структура спектрів,
причиною виникнення якої є спін-орбітальна
взаємодія, значно
легше спостерігається в атомних спектрах
лужних
металів,
ніж у атомному спектрі водню. Для
спостереження за тонкою структурою
спектрів атомів водню необхідно мати
спектрограф з дуже великою роздільною
здатністю такою, щоб
разів. Тому тонка
структура спектрів,
причиною виникнення якої є спін-орбітальна
взаємодія, значно
легше спостерігається в атомних спектрах
лужних
металів,
ніж у атомному спектрі водню. Для
спостереження за тонкою структурою
спектрів атомів водню необхідно мати
спектрограф з дуже великою роздільною
здатністю такою, щоб
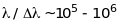 .
Така тонка структура дійсно була знайдена
і
збільшувалось із збільшенням
.
.
Така тонка структура дійсно була знайдена
і
збільшувалось із збільшенням
.
