
- •Глава 2. Корпускулярні та хвильові властивості частинок
- •2.1. Відкриття корпускул
- •2.2. Вимірювання заряду електрона. Досліди Міллікена
- •Таким чином, у цих дослідах вдалося виміряти найменший від’ємний заряд речовини і його приписали зарядові електрона. За ці класичні досліди Мілікен у 1923 році був відзначений Нобелівською премією.
- •2.3. Маси атомів. Ізотопи
- •2.4. Релятивістські частинки. Рівняння їх руху
- •2.5. Зв’язок між масою, енергією та імпульсом
- •Розсіяння електронів розрідженими газами
- •2.7. Класичний розгляд розсіяння
- •- Кут розсіяння, - прицільна відстань, :
- •2.8. Зміна інтенсивності потоку частинок внаслідок розсіяння в речовині
- •2.9. Довжина вільного пробігу частинки в речовині
- •2.11. Ефект Рамзауера
- •На атомах Ar.
- •2.12. Неможливість пояснення процесів розсіяння електронів на основі класичних уявлень про електрон, як корпускулу
- •Висновки
- •Глава 3. Експериментальні передумови сучасної теорії атома
- •3.1. Досліди Резерфорда з розсіяння -частинок
- •3.2. Формула Резерфорда
- •3.3. Планетарна модель атома, труднощі її пояснення на підставі класичних уявлень
- •3.4. Загальні характеристики атомних спектрів
- •3.5. Спектральні терми
- •3.6. Комбінаційний принцип (Рідберга-Рітца)
- •3.7. Спектр атомів водню
- •3.8. Досліди Франка і Герца
- •3.9. Визначення потенціалів іонізації атомів
- •3.10. Висновки
- •Глава 4. Атом водню в моделі бора
- •4.1.Постулати Бора
- •4.2. Рівні енергії та стаціонарні орбіти
- •4.3. Позитроній та мезоатом
- •4.4. Еліптичні орбіти. Головне та орбітальне квантові числа.
- •4.5. Висновки
- •Глава 5. Хвильова природа матерії
- •5.1. Передумови пізнання хвильової природи матерії
- •5.1.1. Квантова природа випромінювання світла
- •Квантова природа поглинання світла
- •Короткохвильова границя неперервного спектра рентгенівських променів
- •Суцільного спектра рентгенівських променіввід енергії електронів .
- •5.1.4. Ефект Комптона
- •Розсіяних рентгенівських променів при різних кутах розсіяння .
- •В ефекті Комптона.
- •5.1.5. Некогерентне розсіяння квантів на електронах
- •5.1.6. Оптико-механічна аналогія
- •5.2. Гіпотеза та формула де Бройля
- •5.3. Експериментальне обґрунтування хвильової природи матерії
- •5.3.1. Досліди Рамзауера
- •5.3.2. Досліди Девісона та Джермера з відбиття електронів від граней монокристалів
- •Розсіяних електронів поверхнями речовини: а) аморфної, б) кристалічної, в-ж) кристалічної при різних енергіях електронів.
- •Променями, що відбиваються від двох сіткових площин:
- •5.3.3. Досліди Томсона по проходженню електронів крізь тонкі плівки речовини
- •5.4. Дифракція та інтерференція інших частинок та атомів
- •5.5. Дифракція поодиноких електронів
- •5.6.Визначення довжини хвилі де Бройля матеріальних частинок із дослідів по дифракції електронів на кристалах
- •5.7. Електронографія та нейтронографія
- •5.8. Висновки
- •Глава 6. Хвильова функція електронів та її фізичний зміст
- •6.1. Хвильова функція плоскої хвилі де Бройля
- •6.2. Хвильовий пакет, як модель частинки та її недосконалість
- •6.3. Фізичний зміст хвильової функції
- •Співвідношення невизначеностей
- •6.5. Висновки
- •Глава 7. Рівняння шредінґера
- •7.1. Рівняння Шредінґера
- •7.2. Найпростіші випадки розв’язку рівнянь Шредінґера
- •Частинка в потенціальній ямі з нескінченними стінками
- •7.2.2. Частинка в потенціальній ямі зі скінченними стінками
- •7.3. Гармонічний осцилятор
- •7.4. Прозорість потенціального бар’єра (тунелювання)
- •7.5. Оператори
- •7.6. Висновки
- •Глава 8. Уявлення про будову атома водню у квантовій механіці
- •8.1. Схема розв’язку рівняння Шредінґера для атома водню
- •8.2. Кутова частина рівняння Шредінґера
- •8.3. Кутовий розподіл густини ймовірності знайти електрон в атомі водню. Електронна хмара.
- •8.4. Атомні орбіталі атома водню
- •8.5. Фізичний зміст квантових чисел та
- •8.6. Просторове квантування
- •8.7. Радіальна частина хвильової функції електрона атома водню
- •8.8. Радіальний розподіл електронної хмари атома водню
- •Густини стану атому н: а) ; б) контурна карта;
- •8.9. Квантові числа та їх фізичний зміст
- •8.10. Правила відбору квантових чисел
- •8.11. Висновки
- •Глава 9. Експериментальні дані про будову та властивості складних атомів
- •9.1. Структура атомів лужних металів, валентний електрон
- •9.2. Зняття виродження за квантовим числом
- •9.3. Спектральні серії атомних спектрів лужних металів
- •9.4. Дублетна структура термів та спектральних ліній атомів лужних металів
- •9.5. Спін електрона
- •9.6. Сума моментів кількості руху
- •9.7. Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії
- •На ядрі, б) – початок координат на електроні, в) – розщеплення рівнів.
- •Особливості тонкої структури атомних спектрів лужних металів
- •Надтонка структура спектральних термів атомів лужних металів
- •9.10. Висновки
- •Глава 10. Тонка структура атомного спектра водню
- •10.1. Тонка структура спектральних ліній атомного спектра водню. Спін-орбітальна взаємодія
- •10.2. Надтонка структура ліній атомного спектра водню
- •10.3. Досліди Лемба і Різерфорда з вимірювання зміщення енергетичних рівнів атомів водню
- •Частоти електромагнітних хвиль, що опромінюють потік збуджених атомів водню.
- •Зсув та надтонка структура основного терму за рахунок впливу спіну ядра.
- •10.4. Поняття про нульові коливання та поляризацію вакууму як причини лембівського зсуву
- •10.5. Висновки
- •Глава 11. Векторна модель атома
- •11.1. Векторна модель атома. Типи зв’язку
- •11.2. Нормальний (l-s) або Рассел-Саундеровський зв’язок
- •11.3. Квантові числа складних атомів
- •11.4. Правила відбору
- •11.5. Правила Хунда (Гунда)
- •11.6. Систематика спектрів складних атомів з нормальним зв’язком
- •11.7. Приклади застосування векторної моделі атома
- •11.9. Висновки
- •12. Атом гелію
- •12.1. Рівняння Шредінґера для двохелектронного атома
- •12.2. Метод збурень
- •12.3. Принцип Паулі
- •12.4. Вплив антисиметричності хвильових функцій на стаціонарні стани атому Не
- •12.5. Висновки
- •Глава 13. Інтенсивність та ширина спектральних ліній
- •Ймовірність переходів
- •Золоте правило Фермі
- •Сила осцилятора
- •13.4. Поглинання світла
- •13.5. Інтенсивність спектральних ліній
- •13.6. Ширина спектральних ліній
- •13.7. Принципи генерації електромагнітних коливань (лазери)
- •- Дзеркала резонатора, 2-робоче тіло,
- •Рубіновий лазер
- •13.8. Висновки
- •Глава 14. Будова та заповнення оболонок складних атомів. Теорія періодичної системи елементів д.І. Менделєєва
- •14.1. Послідовність заповнення електронних
- •Оболонок атомів
- •14.2. Періодична система елементів
- •14.3. Недоліки квантової моделі періодичної системи елементів
- •14.4. Прикінцеві зауваження
- •Глава 15. Рентгенівські промені
- •15.1. Характеристичний спектр рентгенівських променів
- •Спектри поглинання рентгенівських променів
- •15.4. Висновки
- •Глава 16. Магнітні властивості атомів
- •16.1. Орбітальний та спіновий магнетизм. Магнетон Бора
- •Сумарний магнітний момент кількості руху. Множник Ланде
- •Розкладемо вектор на паралельну і перпендикулярну складові
- •Просторове квантування
- •Гіромагнітні ефекти
- •Досліди Штерна й Герлаха
- •16.6. Сучасні методи визначення атомних магнітних моментів
- •16.6.1. Електронний парамагнітний резонанс (епр)
- •Таким чином метод епр дозволяє отримувати такі результати:
- •16.6.2. Надтонка структура ліній епр
- •У магнітному полі з урахуванням ядерного спіну.
- •16.6.3. Резонансний метод Рабі дослідження магнітних моментів атомних ядер
- •16.6.4. Ядерний магнітний резонанс (ямр).
- •16.7. Значення магніто-резонансних методів для визначення атомних магнітних моментів
- •Висновки
- •Глава 17. Вплив магнітного та електричного полів на атоми
- •17.1. Ефект Зеємана
- •(Частота Лармора)
- •17.2. Аномальний ефект Зеємана і його квантова теорія
- •Ефект Пашена і Бака
- •17.4. Поляризація світла при ефекті Зеємана
- •Ефект Штарка
- •Сукупність атомів у магнітному полі
- •17.6.А. Парамагнетизм
- •17.6.Б. Діамагнетизм речовини. Теорема Лармора
- •17.7. Циклотронний резонанс
- •(А) та ділянки спектра поглинання при ньому (б, в і г).
- •17.8. Висновки
- •Глава 18. Природа хімічного зв'язку
- •18.1. Вступ
- •18.2. Іонний зв’язок
- •При ця задача, як і в главі 13, розділяється на дві незалежних задачі для не взаємодіючих атомів водню, для яких існує розв’язок у вигляді: , ; , .
- •18.4. Сили Ван-дер-Ваальса
- •18.5. Водневий зв’язок
- •18.6. Метод валентного зв’язку
- •18.7. Метод молекулярних орбіталей
- •18.8. Гібридизація орбіталей
- •18.9. Висновки
- •Глава 19. Спектри молекул
- •19.1. Загальна характеристика
- •19.2. Обертальні спектри молекул
- •Обертального спектру.
- •19.3. Коливальні спектри молекул
- •19.4. Коливально-обертальні спектри молекул
- •19.5. Електронні стани
- •Принцип Франка-Кондона. Якісне пояснення інтенсивності ліній молекулярних спектрів
- •19.7. Комбінаційне розсіяння світла
- •Висновки
- •Глава 20. Квантові властивості твердих тіл
- •20.1. Вступ
- •20.2. Електрон у полі періодичного потенціалу
- •20.3. Модель Кроніга – Пені
- •20.4. Зони Бріллюена
- •20.5. Заповнення зон електронами
- •20.6. Густина станів
- •(А) та його енергетичні рівні (б).
- •20.7. Динаміка електронів, ефективна маса, електрони та дірки
- •20.8. Ефект Холла
- •20.9. Електропровідність металів
- •20.10. Особливості власних напівпровідників
- •20.11. Домішкові напівпровідники
- •I(V) характеристика.
- •20.13. Магнітні властивості твердих тіл
- •20.14. Обмінний гамільтоніан Гeйзенберга. Спонтанна намагніченість, феромагнетизм та антиферомагнетизм
- •20.15. Феромагнітні домени, стінки Блоха
- •20.16. Спінові хвилі
- •20.17. Надпровідність
- •20.18. Магнітні властивості надпровідників
- •20.19. Квантування магнітного потоку
- •20.20. Критичний струм і критичне магнітне поле
- •20.21. Ефекти Джозефсона
- •20.22. Високотемпературна надпровідність
- •20.23. Прикінцеві зауваження
14.3. Недоліки квантової моделі періодичної системи елементів
Крім
розглянутої дуже наближеної моделі
періодичної системи елементів, яка
заснована на одноелектронному наближенні,
існують і інші більш складні моделі
[8]. Наприклад, моделі, у яких замість
усередненого потенціалу
 використовується ефективний потенціал
використовується ефективний потенціал
 ,
що враховує також «відцентровий внесок»,
або використовує потенціал Томаса-Ферм,
і тощо. Проте й ці більш складні моделі
також не позбавлені недоліків:
,
що враховує також «відцентровий внесок»,
або використовує потенціал Томаса-Ферм,
і тощо. Проте й ці більш складні моделі
також не позбавлені недоліків:
в існуючій теорії періодичної системи використовуються стани окремих електронів електронних оболонок, а не стани електронних оболонок у цілому, що є досить грубим наближенням;
електрон на оболонці характеризується орбітальним квантовим числом . Це припускає збереження орбітального моменту кількості руху для кожного електрону. Проте, закон збереження кількості руху справедливий лише для частинок, що рухаються в центральносиметричному силовому полі, і не має місця в інших випадках. Проте, поле складного атома, що створюється атомним ядром і електронами, не має точної сферичної симетрії. До рівняння Шредінґера повинна входити не усереднена потенціальна енергія точкового заряду, а потенціальна енергія, котра є функцією всіх координат електронів атома.
14.4. Прикінцеві зауваження
Існуючі уявлення про будову атома дозволяють, використовуючи принцип Паулі та принцип мінімізації енергії, визначити електронну конфігурацію атомів. Повністю заповненим оболонкам відповідають нульові орбітальний і спіновий моменти, внаслідок чого їх можна не враховувати при визначенні термів для валентних електронів. Вони також відіграють незначну роль при визначенні хімічних і інших властивостей елементів.
Починаючи
з
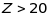 ,
починає відігравати більш значну роль
відцентрова енергія, урахування якої
дозволяє в першому наближенні пояснити
деталі електронної конфігурації всіх
елементів періодичної системи Д.І.
Менделєєва. Усе це дозволяє дійти до
висновку, що періодичний закон властивостей
елементів відображає періодичність у
заповненні електронних оболонок атомів.
Подібність властивостей елементів
зв’язана з однаковою кількістю електронів
на зовнішній валентній оболонці їхніх
атомів.
,
починає відігравати більш значну роль
відцентрова енергія, урахування якої
дозволяє в першому наближенні пояснити
деталі електронної конфігурації всіх
елементів періодичної системи Д.І.
Менделєєва. Усе це дозволяє дійти до
висновку, що періодичний закон властивостей
елементів відображає періодичність у
заповненні електронних оболонок атомів.
Подібність властивостей елементів
зв’язана з однаковою кількістю електронів
на зовнішній валентній оболонці їхніх
атомів.
Кількісна теорія атома потребує подальшого вдосконалення моделі, у якій необхідно більш точно врахувати особливості просторового розподілу потенціалу важких атомів.
Глава 15. Рентгенівські промені
15.1. Характеристичний спектр рентгенівських променів
Збільшення
різниці потенціалів, що прискорює
електрони, до значень більших за критичне
 ,
призводить до появи на тлі суцільного
спектра окремих монохроматичних ліній
рентгенівських променів. Ці монохроматичні
лінії називаються лініями характеристичного
спектра рентгенівських променів.
Характеристичний спектр рентгенівських
променів схематично наведено на рис.
15.1.б для декількох потенціалів на
антикатоді, що прискорюють електрони:
,
призводить до появи на тлі суцільного
спектра окремих монохроматичних ліній
рентгенівських променів. Ці монохроматичні
лінії називаються лініями характеристичного
спектра рентгенівських променів.
Характеристичний спектр рентгенівських
променів схематично наведено на рис.
15.1.б для декількох потенціалів на
антикатоді, що прискорюють електрони:
 ;
;
 та схема їх досліджень
та схема їх досліджень
Рис.
15.1. Схема отримання характеристичних
рентгенівських променів (а) та їх спектр
при різних напругах на антикатоді:
(б).
Експериментально встановлено такі властивості:
кожній речовині антикатода притаманний характеристичний спектр рентгенівських променів, який залежить від атомів, що входять до її складу;
характеристичний спектр складається з окремих спектральних ліній, які можна розбити на серії, що отримали назви К -, L -, М - серій відповідно. Лінії К- і L- серій мають найкоротші довжини хвиль. У елементів з
 з’являються лінії тільки К-серії й
лише при
з’являються лінії тільки К-серії й
лише при
 спостерігаються лінії М- серій з більшими
довжинами хвиль. Кількість ліній значно
менша ніж в оптичному діапазоні.
спостерігаються лінії М- серій з більшими
довжинами хвиль. Кількість ліній значно
менша ніж в оптичному діапазоні.
Рис. 15.2. К – серія для речовин з Z=37-42.
кожна речовина має декілька критичних потенціалів ,
кількість яких збільшується при
збільшенні атомного номера речовини
антикатода;
,
кількість яких збільшується при
збільшенні атомного номера речовини
антикатода;при
 виникає лише одна найбільш довгохвильова
серія характеристичних ліній спектра,
при
виникає лише одна найбільш довгохвильова
серія характеристичних ліній спектра,
при
 - дві серії і т.д.;
- дві серії і т.д.;інтенсивність ліній характеристичного спектра зростає зі збільшенням напруги прискорення за степеневим законом
 де
– розмірний коефіцієнт, а
де
– розмірний коефіцієнт, а

характеристичний спектр відносно простий та одноманітний (рис.15.1 та 15.2). Спектральні лінії однієї й тієї серії зсуваються в бік менших зі зростанням , згідно закону Мозелі (рис.15.4),
 ,
де
,
де
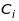 та
та
 -
стала екранування атомного ядра. Для
К- серії, наприклад,
-
стала екранування атомного ядра. Для
К- серії, наприклад,
 ,
а для L-серії
,
а для L-серії
 ;
;
довжини хвиль ліній характеристичного спектра рентгенівських променів не залежать від того, чи виготовлений антикатод із простої речовини з
 ,
чи зі сплаву або сполуки;
,
чи зі сплаву або сполуки;
ліній -серії дублетні, лінії всіх останніх серій мають складну мультиплетну структуру і поділяються на підсерії: - на три, - на п’ять, - на сім підсерій.
Усі ці властивості дозволяють дійти до висновку, що характеристичний спектр рентгенівських променів виникає при збудженні електронів глибоких оболонок атома, будова яких однакова в атомах із різними атомними номерами і не змінюється при хімічних реакціях і утворенні сплавів. Збудження рентгенівських променів можна розбити на дві стадії.
На
першій
стадії збудження рентгенівських променів
електрони або інші елементарні частинки
передають свою енергію електронам, що
знаходяться на
-,
-,
-,
....атомних шарах, внаслідок чого на них
утворюються вакансії (дірки) (рис.15.3).
Це означає, що чим складніший атом (чим
більше його
,
тим більше в ньому заповнених електронами
шарів, і тим більше він має критичних
потенціалів
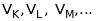 – потенціалів збудження вакансій.
– потенціалів збудження вакансій.
Рис.
15.3. Схема збудження К
лінії: 1 – електрон збуджує вакансію,
2- вилітає електрон, 3- вакансія в К-шарі
заповнюється електроном із L- шару з
емісією кванта h.
 Згідно закону Пуассона, електричне поле
в даній точці створюють лише ті заряди,
які знаходяться у внутрішній частині
об’єму, на поверхні якого розташована
ця точка. Тому на електрон, що переходить
із периферичної оболонки на глибинну
з вакансією (діркою), діє електричне
поле заряду, локалізованого між ядром
та електронною оболонкою, на яку
переходить електрон. Наприклад, якщо
розглядати вакансію на К-шарі, то
ефективний заряд ядра буде визначатись
Згідно закону Пуассона, електричне поле
в даній точці створюють лише ті заряди,
які знаходяться у внутрішній частині
об’єму, на поверхні якого розташована
ця точка. Тому на електрон, що переходить
із периферичної оболонки на глибинну
з вакансією (діркою), діє електричне
поле заряду, локалізованого між ядром
та електронною оболонкою, на яку
переходить електрон. Наприклад, якщо
розглядати вакансію на К-шарі, то
ефективний заряд ядра буде визначатись
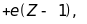 бо на К-шарі є ще один електрон, що екранує
ядро. Тому в полі цього екранованого
ядра з
бо на К-шарі є ще один електрон, що екранує
ядро. Тому в полі цього екранованого
ядра з
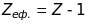 буде спостерігатись
одноелектронний
перехід. Цей перехід майже еквівалентний
електронному переходу в одноелектронному
атомі з
буде спостерігатись
одноелектронний
перехід. Цей перехід майже еквівалентний
електронному переходу в одноелектронному
атомі з
 ,
для якого можна використовувати
узагальнену формулу Бальмера.
,
для якого можна використовувати
узагальнену формулу Бальмера.
Рис.
15.4.
Залежність
довжин хвиль ліній 3-х серій від атомного
номера.
 (15.1)
(15.1)
і тому виконується закон Мозлі (рис.15.4).
Величина
 називається сталою
екранування.
Вона слабко залежить від атомного номера
у
межах однієї серії. В таблиці 15.1 наведені
значення
називається сталою
екранування.
Вона слабко залежить від атомного номера
у
межах однієї серії. В таблиці 15.1 наведені
значення
 для К - і L – серій.
для К - і L – серій.
Таблиця
15.1. Значення
|
|||
Лінія |
|
|
|
|
1 |
1 |
2 |
|
1 |
1 |
3 |
|
7,5 |
2 |
3 |
Видно,
що величина
 збільшується для спектральних серій
зі збільшенням головного квантового
числа
.
Більш точні вимірювання показали, що
закон Мозлі наближений, бо спостерігаються
відхилення від лінійної залежності
збільшується для спектральних серій
зі збільшенням головного квантового
числа
.
Більш точні вимірювання показали, що
закон Мозлі наближений, бо спостерігаються
відхилення від лінійної залежності
 але
для К - і L – серій відхилення від лінійної
залежності незначні.
але
для К - і L – серій відхилення від лінійної
залежності незначні.
Розглянемо
тепер схему енергетичних рівнів для
рентгенівських переходів. На перший
погляд здається, що енергетичний рівень
шару з електронною вакансією повинен
бути дуже широким, бо
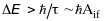 ,
де
,
де
 – коефіцієнт спонтанного випромінювання
Ейнштейна пропорційний
– коефіцієнт спонтанного випромінювання
Ейнштейна пропорційний
 .
Але, згідно (12.6) і (12.14), він залежить ще
й від квадрата матричного елементу
потенціалу електронної взаємодії
.
Але, згідно (12.6) і (12.14), він залежить ще
й від квадрата матричного елементу
потенціалу електронної взаємодії
 ,
який внаслідок відносно слабкої
електронної взаємодії дуже малий. Тому
- середній час перебування атома у
збудженому стані (середній час життя
вакансії) досить значний, що обмежує
розширення енергетичного рівня. Таким
чином, стан атома з вакансією на глибокому
шарі можна наближено розглядати як
дискретний рівень «квазістаціонарного»
стану, який називається рентгенівським
термом [6]. Назви рентгенівських термів
збігаються з назвою шару, на якому
утворюється вакансія.
,
який внаслідок відносно слабкої
електронної взаємодії дуже малий. Тому
- середній час перебування атома у
збудженому стані (середній час життя
вакансії) досить значний, що обмежує
розширення енергетичного рівня. Таким
чином, стан атома з вакансією на глибокому
шарі можна наближено розглядати як
дискретний рівень «квазістаціонарного»
стану, який називається рентгенівським
термом [6]. Назви рентгенівських термів
збігаються з назвою шару, на якому
утворюється вакансія.
На відміну від оптичної системи термів, у рентгенівському діапазоні прийнято будувати обернену систему термів, тобто терм К-шару має найбільшу енергію (рис.15.5). Причина цього лежить в різниці механізму виникнення оптичних і рентгенівських спектрів. Оптичні спектри виникають при збудженні валентного електрона зі стану з найбільшою енергію зв’язку та найменшим головним квантовим числом до стану з меншим значенням енергії зв'язку і більшим квантовим числом. Тому на енергетичній діаграмі для оптичних спектрів терми вказуються знизу вверх зі збільшенням головного квантового числа, враховуючи, що енергія зв’язку має від’ємне значення. У випадку рентгенівських спектрів збудження атома виникає внаслідок звільнення електрона з того чи іншого шару. Перехід електрона, наприклад, з L- шару до K- шару супроводжується випромінюванням фотона – кванта рентгенівських променів, енергія якого дорівнює різниці енергії зв'язку на K- і L- шарі. Оскільки енергія зв’язку електрона в К- шарі більше чим на L- шарі, тому терм К- шару малюється вище ніж терм L- шару.
На
рис.15.5 наведена схема рентгенівських
термів і переходи між ними. Розглянемо,
як будується схема рентгенівських
термів. Якщо після збудження К-шару і
утворення вакансії на ньому
залишається
один електрон, то цей стан атома має
електронну конфігурацію
 …
Цей стан відповідає терму
…
Цей стан відповідає терму
 .
При іонізації L-шару
і утворенні на ньому вакансії можливі
такі електронні конфігурації:
.
При іонізації L-шару
і утворенні на ньому вакансії можливі
такі електронні конфігурації:

 .
Згідно
векторної моделі
атома таким електронним конфігураціям
відповідають наступні терми:
.
Згідно
векторної моделі
атома таким електронним конфігураціям
відповідають наступні терми:
 При іонізації М-шара
і
утворенні на ньому вакансії
можливі такі електронні конфігурації:
При іонізації М-шара
і
утворенні на ньому вакансії
можливі такі електронні конфігурації:

 ;
;
 .
Згідно векторної моделі атома цим
електронним конфігураціям відповідають
наступні терми:
.
Згідно векторної моделі атома цим
електронним конфігураціям відповідають
наступні терми:
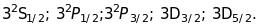 Як видно з рис. 15.5,
К-терм синглетний, L-терм потрійний ( LI,
LII,
LIII),
M-терм складається з 5 термів (МI,
MII,
MIII,
MIV,
MV),
N-терм із 7 термів. Мультиплетність
рентгенівських термів впливає на
відповідну мультиплетність критичних
потенціалів, які також матимуть “тонку
структуру”,
а також на мультиплетність спектральних
ліній.
Як видно з рис. 15.5,
К-терм синглетний, L-терм потрійний ( LI,
LII,
LIII),
M-терм складається з 5 термів (МI,
MII,
MIII,
MIV,
MV),
N-терм із 7 термів. Мультиплетність
рентгенівських термів впливає на
відповідну мультиплетність критичних
потенціалів, які також матимуть “тонку
структуру”,
а також на мультиплетність спектральних
ліній.
Для того, щоб отримати рентгенівські спектральні серії, необхідно використати правила відбору при дипольних переходах
 .
.
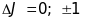 . (15.2)
. (15.2)
Ми бачимо, що, хоча через спін-орбітальну та електростатичну взаємодії мультиплетність рентгенівських термів подібна до мультиплетності квазіодноелектронного атома, але спектральні рентгенівські лінії внаслідок правил відбору мають більш складну структуру: K-серії дублетні, L- серія складається з 7 компонент і розбивається на окремі підсерії. LI і LII - підсерії дублетні, а лінії LIII - підсерії триплетні.
Рис.
15.5. Схема рентгенівських термів і
переходів між ними.

 у
(15.1) для К- і L
-
ліній.
у
(15.1) для К- і L
-
ліній.



