
- •Глава 2. Корпускулярні та хвильові властивості частинок
- •2.1. Відкриття корпускул
- •2.2. Вимірювання заряду електрона. Досліди Міллікена
- •Таким чином, у цих дослідах вдалося виміряти найменший від’ємний заряд речовини і його приписали зарядові електрона. За ці класичні досліди Мілікен у 1923 році був відзначений Нобелівською премією.
- •2.3. Маси атомів. Ізотопи
- •2.4. Релятивістські частинки. Рівняння їх руху
- •2.5. Зв’язок між масою, енергією та імпульсом
- •Розсіяння електронів розрідженими газами
- •2.7. Класичний розгляд розсіяння
- •- Кут розсіяння, - прицільна відстань, :
- •2.8. Зміна інтенсивності потоку частинок внаслідок розсіяння в речовині
- •2.9. Довжина вільного пробігу частинки в речовині
- •2.11. Ефект Рамзауера
- •На атомах Ar.
- •2.12. Неможливість пояснення процесів розсіяння електронів на основі класичних уявлень про електрон, як корпускулу
- •Висновки
- •Глава 3. Експериментальні передумови сучасної теорії атома
- •3.1. Досліди Резерфорда з розсіяння -частинок
- •3.2. Формула Резерфорда
- •3.3. Планетарна модель атома, труднощі її пояснення на підставі класичних уявлень
- •3.4. Загальні характеристики атомних спектрів
- •3.5. Спектральні терми
- •3.6. Комбінаційний принцип (Рідберга-Рітца)
- •3.7. Спектр атомів водню
- •3.8. Досліди Франка і Герца
- •3.9. Визначення потенціалів іонізації атомів
- •3.10. Висновки
- •Глава 4. Атом водню в моделі бора
- •4.1.Постулати Бора
- •4.2. Рівні енергії та стаціонарні орбіти
- •4.3. Позитроній та мезоатом
- •4.4. Еліптичні орбіти. Головне та орбітальне квантові числа.
- •4.5. Висновки
- •Глава 5. Хвильова природа матерії
- •5.1. Передумови пізнання хвильової природи матерії
- •5.1.1. Квантова природа випромінювання світла
- •Квантова природа поглинання світла
- •Короткохвильова границя неперервного спектра рентгенівських променів
- •Суцільного спектра рентгенівських променіввід енергії електронів .
- •5.1.4. Ефект Комптона
- •Розсіяних рентгенівських променів при різних кутах розсіяння .
- •В ефекті Комптона.
- •5.1.5. Некогерентне розсіяння квантів на електронах
- •5.1.6. Оптико-механічна аналогія
- •5.2. Гіпотеза та формула де Бройля
- •5.3. Експериментальне обґрунтування хвильової природи матерії
- •5.3.1. Досліди Рамзауера
- •5.3.2. Досліди Девісона та Джермера з відбиття електронів від граней монокристалів
- •Розсіяних електронів поверхнями речовини: а) аморфної, б) кристалічної, в-ж) кристалічної при різних енергіях електронів.
- •Променями, що відбиваються від двох сіткових площин:
- •5.3.3. Досліди Томсона по проходженню електронів крізь тонкі плівки речовини
- •5.4. Дифракція та інтерференція інших частинок та атомів
- •5.5. Дифракція поодиноких електронів
- •5.6.Визначення довжини хвилі де Бройля матеріальних частинок із дослідів по дифракції електронів на кристалах
- •5.7. Електронографія та нейтронографія
- •5.8. Висновки
- •Глава 6. Хвильова функція електронів та її фізичний зміст
- •6.1. Хвильова функція плоскої хвилі де Бройля
- •6.2. Хвильовий пакет, як модель частинки та її недосконалість
- •6.3. Фізичний зміст хвильової функції
- •Співвідношення невизначеностей
- •6.5. Висновки
- •Глава 7. Рівняння шредінґера
- •7.1. Рівняння Шредінґера
- •7.2. Найпростіші випадки розв’язку рівнянь Шредінґера
- •Частинка в потенціальній ямі з нескінченними стінками
- •7.2.2. Частинка в потенціальній ямі зі скінченними стінками
- •7.3. Гармонічний осцилятор
- •7.4. Прозорість потенціального бар’єра (тунелювання)
- •7.5. Оператори
- •7.6. Висновки
- •Глава 8. Уявлення про будову атома водню у квантовій механіці
- •8.1. Схема розв’язку рівняння Шредінґера для атома водню
- •8.2. Кутова частина рівняння Шредінґера
- •8.3. Кутовий розподіл густини ймовірності знайти електрон в атомі водню. Електронна хмара.
- •8.4. Атомні орбіталі атома водню
- •8.5. Фізичний зміст квантових чисел та
- •8.6. Просторове квантування
- •8.7. Радіальна частина хвильової функції електрона атома водню
- •8.8. Радіальний розподіл електронної хмари атома водню
- •Густини стану атому н: а) ; б) контурна карта;
- •8.9. Квантові числа та їх фізичний зміст
- •8.10. Правила відбору квантових чисел
- •8.11. Висновки
- •Глава 9. Експериментальні дані про будову та властивості складних атомів
- •9.1. Структура атомів лужних металів, валентний електрон
- •9.2. Зняття виродження за квантовим числом
- •9.3. Спектральні серії атомних спектрів лужних металів
- •9.4. Дублетна структура термів та спектральних ліній атомів лужних металів
- •9.5. Спін електрона
- •9.6. Сума моментів кількості руху
- •9.7. Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії
- •На ядрі, б) – початок координат на електроні, в) – розщеплення рівнів.
- •Особливості тонкої структури атомних спектрів лужних металів
- •Надтонка структура спектральних термів атомів лужних металів
- •9.10. Висновки
- •Глава 10. Тонка структура атомного спектра водню
- •10.1. Тонка структура спектральних ліній атомного спектра водню. Спін-орбітальна взаємодія
- •10.2. Надтонка структура ліній атомного спектра водню
- •10.3. Досліди Лемба і Різерфорда з вимірювання зміщення енергетичних рівнів атомів водню
- •Частоти електромагнітних хвиль, що опромінюють потік збуджених атомів водню.
- •Зсув та надтонка структура основного терму за рахунок впливу спіну ядра.
- •10.4. Поняття про нульові коливання та поляризацію вакууму як причини лембівського зсуву
- •10.5. Висновки
- •Глава 11. Векторна модель атома
- •11.1. Векторна модель атома. Типи зв’язку
- •11.2. Нормальний (l-s) або Рассел-Саундеровський зв’язок
- •11.3. Квантові числа складних атомів
- •11.4. Правила відбору
- •11.5. Правила Хунда (Гунда)
- •11.6. Систематика спектрів складних атомів з нормальним зв’язком
- •11.7. Приклади застосування векторної моделі атома
- •11.9. Висновки
- •12. Атом гелію
- •12.1. Рівняння Шредінґера для двохелектронного атома
- •12.2. Метод збурень
- •12.3. Принцип Паулі
- •12.4. Вплив антисиметричності хвильових функцій на стаціонарні стани атому Не
- •12.5. Висновки
- •Глава 13. Інтенсивність та ширина спектральних ліній
- •Ймовірність переходів
- •Золоте правило Фермі
- •Сила осцилятора
- •13.4. Поглинання світла
- •13.5. Інтенсивність спектральних ліній
- •13.6. Ширина спектральних ліній
- •13.7. Принципи генерації електромагнітних коливань (лазери)
- •- Дзеркала резонатора, 2-робоче тіло,
- •Рубіновий лазер
- •13.8. Висновки
- •Глава 14. Будова та заповнення оболонок складних атомів. Теорія періодичної системи елементів д.І. Менделєєва
- •14.1. Послідовність заповнення електронних
- •Оболонок атомів
- •14.2. Періодична система елементів
- •14.3. Недоліки квантової моделі періодичної системи елементів
- •14.4. Прикінцеві зауваження
- •Глава 15. Рентгенівські промені
- •15.1. Характеристичний спектр рентгенівських променів
- •Спектри поглинання рентгенівських променів
- •15.4. Висновки
- •Глава 16. Магнітні властивості атомів
- •16.1. Орбітальний та спіновий магнетизм. Магнетон Бора
- •Сумарний магнітний момент кількості руху. Множник Ланде
- •Розкладемо вектор на паралельну і перпендикулярну складові
- •Просторове квантування
- •Гіромагнітні ефекти
- •Досліди Штерна й Герлаха
- •16.6. Сучасні методи визначення атомних магнітних моментів
- •16.6.1. Електронний парамагнітний резонанс (епр)
- •Таким чином метод епр дозволяє отримувати такі результати:
- •16.6.2. Надтонка структура ліній епр
- •У магнітному полі з урахуванням ядерного спіну.
- •16.6.3. Резонансний метод Рабі дослідження магнітних моментів атомних ядер
- •16.6.4. Ядерний магнітний резонанс (ямр).
- •16.7. Значення магніто-резонансних методів для визначення атомних магнітних моментів
- •Висновки
- •Глава 17. Вплив магнітного та електричного полів на атоми
- •17.1. Ефект Зеємана
- •(Частота Лармора)
- •17.2. Аномальний ефект Зеємана і його квантова теорія
- •Ефект Пашена і Бака
- •17.4. Поляризація світла при ефекті Зеємана
- •Ефект Штарка
- •Сукупність атомів у магнітному полі
- •17.6.А. Парамагнетизм
- •17.6.Б. Діамагнетизм речовини. Теорема Лармора
- •17.7. Циклотронний резонанс
- •(А) та ділянки спектра поглинання при ньому (б, в і г).
- •17.8. Висновки
- •Глава 18. Природа хімічного зв'язку
- •18.1. Вступ
- •18.2. Іонний зв’язок
- •При ця задача, як і в главі 13, розділяється на дві незалежних задачі для не взаємодіючих атомів водню, для яких існує розв’язок у вигляді: , ; , .
- •18.4. Сили Ван-дер-Ваальса
- •18.5. Водневий зв’язок
- •18.6. Метод валентного зв’язку
- •18.7. Метод молекулярних орбіталей
- •18.8. Гібридизація орбіталей
- •18.9. Висновки
- •Глава 19. Спектри молекул
- •19.1. Загальна характеристика
- •19.2. Обертальні спектри молекул
- •Обертального спектру.
- •19.3. Коливальні спектри молекул
- •19.4. Коливально-обертальні спектри молекул
- •19.5. Електронні стани
- •Принцип Франка-Кондона. Якісне пояснення інтенсивності ліній молекулярних спектрів
- •19.7. Комбінаційне розсіяння світла
- •Висновки
- •Глава 20. Квантові властивості твердих тіл
- •20.1. Вступ
- •20.2. Електрон у полі періодичного потенціалу
- •20.3. Модель Кроніга – Пені
- •20.4. Зони Бріллюена
- •20.5. Заповнення зон електронами
- •20.6. Густина станів
- •(А) та його енергетичні рівні (б).
- •20.7. Динаміка електронів, ефективна маса, електрони та дірки
- •20.8. Ефект Холла
- •20.9. Електропровідність металів
- •20.10. Особливості власних напівпровідників
- •20.11. Домішкові напівпровідники
- •I(V) характеристика.
- •20.13. Магнітні властивості твердих тіл
- •20.14. Обмінний гамільтоніан Гeйзенберга. Спонтанна намагніченість, феромагнетизм та антиферомагнетизм
- •20.15. Феромагнітні домени, стінки Блоха
- •20.16. Спінові хвилі
- •20.17. Надпровідність
- •20.18. Магнітні властивості надпровідників
- •20.19. Квантування магнітного потоку
- •20.20. Критичний струм і критичне магнітне поле
- •20.21. Ефекти Джозефсона
- •20.22. Високотемпературна надпровідність
- •20.23. Прикінцеві зауваження
2.3. Маси атомів. Ізотопи
Вивчення
траєкторії руху каналових променів у
магнітних полях дало змогу визначити
їхні питомі заряди
.
Вони виявились значно меншими, ніж
 електронів. Навіть для іонів найлегшого
атома водню
електронів. Навіть для іонів найлегшого
атома водню
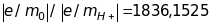 .
Якщо припустити, що заряд іонів водню
збігається з виміряним у дослідах
Мілікена елементарним зарядом е,
тобто вони однократно іонізовані, то
його маса дорівнює:
.
Якщо припустити, що заряд іонів водню
збігається з виміряним у дослідах
Мілікена елементарним зарядом е,
тобто вони однократно іонізовані, то
його маса дорівнює:
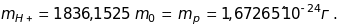
Ця
маса вважається масою позитивного
заряду іона атома водню, тобто масою
протона
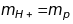 ,
бо
двічі іонізованого атома водню
не
існує. Маси інших іонів та атомів ще
більші, але кратні масі атому водню.
,
бо
двічі іонізованого атома водню
не
існує. Маси інших іонів та атомів ще
більші, але кратні масі атому водню.
Іони
складних атомів можуть бути кратно
іонізованими. Їх заряд дорівнює
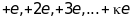 ,
де
,
де
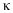 - кратність іонізації. Тому з
експериментальних значень
- кратність іонізації. Тому з
експериментальних значень
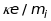 отримують ефективні маси іонів
отримують ефективні маси іонів
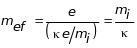 ,
які
відрізняються від маси іонів множником
.
,
які
відрізняються від маси іонів множником
.
Таким чином, за допомогою кількісного аналізу руху заряджених частинок у магнітних полях, можна визначити їхні ефективні маси. Методика визначення мас заряджених частинок називається мас-спектрометрією, а відповідні прилади називаються мас-спектрометрами. Велику роль в розробці мас-спектрометрів та в дослідженні ізотопів відіграв англійський вчений Астон.
Схема його мас-спектрометра наведена на рис.2.6
Рис.2.6.
Схема мас-спектрометра Астона: 1) –
джерело іонів, 2) – область дії електричного
поля, 3) область дії магнітного поля, 4)
– фотоплатівка з зображенням слідів
від дії іонів з масами
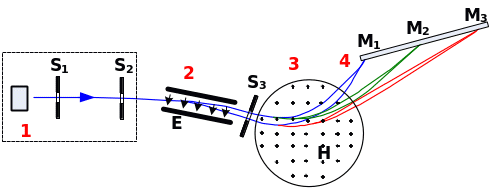
 .
.
Існує чимало різновидів мас-спектрометрів: статично-секторні, часопролітні, квадрупольні та інші.
На
рис.2.7 наведена схема будови одного з
різновидів статично секторного
мас-спектрометрів, що називається
мас-спектрометром
- типу. З іонного джерела (1), де створювались
іони атомів речовини, що досліджувались,
вилітають іони з певним розподілом
швидкостей
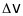 відносно
відносно
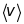 - їхньої середньої швидкості
- їхньої середньої швидкості
 .
Для зменшення розподілу швидкостей
іони пропускають крізь спеціальні
фільтри (монохроматори). Найпростішим
фільтром є простір, у якому створюються
однорідні взаємно перпендикулярні
електричне
.
Для зменшення розподілу швидкостей
іони пропускають крізь спеціальні
фільтри (монохроматори). Найпростішим
фільтром є простір, у якому створюються
однорідні взаємно перпендикулярні
електричне
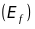 та магнітне
та магнітне
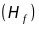 поля (рис.2.7.б).
На іони, що рухаються із швидкістю v
перпендикулярною до
поля (рис.2.7.б).
На іони, що рухаються із швидкістю v
перпендикулярною до
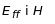 ,
діють сили: електростатична
,
діють сили: електростатична
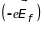 і сила Лоренца
і сила Лоренца
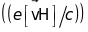 .
.
Вони
відхиляють іони в протилежних напрямках.
Тому крізь вихідну діафрагму фільтра
проходять лише іони, для яких ці сили
рівні, тобто при умові
 .
.
Рис.2.7.
Схема -мас-спектрометра
: 1 - джерело іонів, 2 - однорідне поле
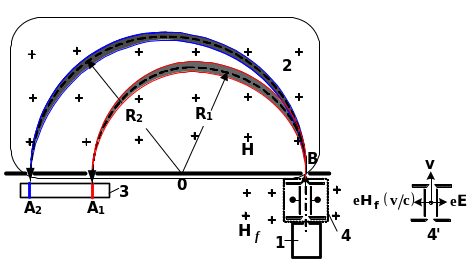
 ,
перпендикулярне до площини рис., 3 -
фотопластинка (детектор іонів),
,
перпендикулярне до площини рис., 3 -
фотопластинка (детектор іонів),
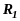 1
і
1
і
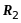 - радіуси траєкторій іонів з масами
- радіуси траєкторій іонів з масами
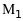 1
і
1
і
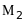 ,
4 і 4’ – фільтр швидкостей.
,
4 і 4’ – фільтр швидкостей.
 і
і
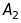 – точки на фотопластинці, у які
потрапляють іони з масами
– точки на фотопластинці, у які
потрапляють іони з масами
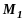 і
,
і
,
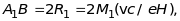
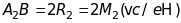 .
.
Іони
із сталою швидкістю
надходять крізь діафрагму В до камери,
в якій діє перпендикулярне до площини
рис.2.7
однорідне магнітне поле
.
Воно створює силу Лоренца, що діє на іон
у напрямку перпендикулярному до його
швидкості. Під дією цієї сили іон починає
рухатись по колу з радіусом R,
який визначається з рівності
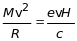 (доцентровою силою є сила Лоренца).
(доцентровою силою є сила Лоренца).
Внаслідок
цього іон певної маси надходить до
фотопластинки в точці А, що знаходиться
на відстані від вхідної діафрагми
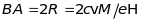 .
Таким чином, знаючи
i
та
вимірявши відстань
.
Таким чином, знаючи
i
та
вимірявши відстань
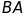 ,
можна знаходити масу іонів за формулою
,
можна знаходити масу іонів за формулою
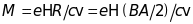 .
Однією
з особливостей мас-спектрометрів є
фокусування іонних пучків, що розходяться
на малі кути. Воно схематично наведено
на рис.2.6 і рис.2.7. Фокусування збільшує
величину вихідного сигналу, тобто
збільшує чутливість приладу. Важливими
характеристиками мас-спектрометрів є
лінійна дисперсія, чутливість та
роздільна здатність.
.
Однією
з особливостей мас-спектрометрів є
фокусування іонних пучків, що розходяться
на малі кути. Воно схематично наведено
на рис.2.6 і рис.2.7. Фокусування збільшує
величину вихідного сигналу, тобто
збільшує чутливість приладу. Важливими
характеристиками мас-спектрометрів є
лінійна дисперсія, чутливість та
роздільна здатність.
Лінійна
дисперсія визначається як
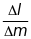 ,
де
,
де
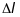 - відстань між піками інтенсивності, що
відповідають частинкам з масами
та
- відстань між піками інтенсивності, що
відповідають частинкам з масами
та
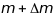 .
.
Чутливість
– це відношення сили струму, створюваного
іонами даної маси досліджуваної речовини
до тиску цієї речовини в іонному джерелі.
Для різних типів мас-спектрометрів
чутливість має порядок
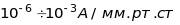 .
Максимальна чутливість мас-спектрометрів
порядку
.
Максимальна чутливість мас-спектрометрів
порядку
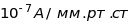 .
.
Відносна
чутливість – це мінімальна концентрація
речовини, яку може виявити мас-спектрометр
в суміші речовин. Для сучасних
мас-спектрометрів відносна чутливість
![]()
Роздільна здатність мас-спектрометра визначається формулою:
 ,
,
де
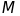 - атомна (молекулярна) маса,
- атомна (молекулярна) маса,
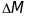 - різниця двох мас
і
- різниця двох мас
і
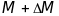 ,
регістраційні піки яких перетинаються
на рівні 10% від максимуму піка.
,
регістраційні піки яких перетинаються
на рівні 10% від максимуму піка.
Роздільна
здатність залежить від принципу дії
мас-спектрометра. Роздільна здатність
вважається задовільною, якщо
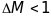 в одиницях а.о.м. Наприклад, якщо
розділяються іони
в одиницях а.о.м. Наприклад, якщо
розділяються іони
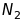 (28,0134 ) і
(28,0134 ) і
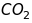 (27,9949), то роздільна здатність
мас-спектрометра порядку
(27,9949), то роздільна здатність
мас-спектрометра порядку
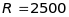 .
Кращі мас-спектрометри мають
.
Кращі мас-спектрометри мають
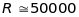 .
Показником
якості мас-спектрометрів вважають
можливість дослідження іонів з найбільшою
масою, при якій досягається розділення
двох мас з
.
Показником
якості мас-спектрометрів вважають
можливість дослідження іонів з найбільшою
масою, при якій досягається розділення
двох мас з
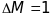 (одиниця розділення). Якщо, наприклад,
розділяються маси 600 і 601, то говорять,
що мас-спектрометр має „одиничну
роздільну здатність” 600. Роздільна
здатність мас-спектрометрів з подвійним
фокусуванням дорівнює
(одиниця розділення). Якщо, наприклад,
розділяються маси 600 і 601, то говорять,
що мас-спектрометр має „одиничну
роздільну здатність” 600. Роздільна
здатність мас-спектрометрів з подвійним
фокусуванням дорівнює
 .
.
За допомогою мас-спектрометрії отримані такі результати.
По-перше, ефективні маси іонів різних елементів виявились кратними масі протона.
По-друге, ефективні маси іонів різних елементів збільшуються майже пропорційно їх атомній вазі (атомній масі2). Проте ця залежність була не зовсім точною, тому що атомна вага (атомна маса), здебільшого, дробове число, на відміну від ефективних мас, визначених по відношенню до маси протона, які були цілими числами.
По-третє, мас-спектрометричні вимірювання ефективних мас окремих елементів показали, що вони, як правило, мають декілька ефективних мас. Наприклад, природній газ неон з атомною вагою 20,183 мав у своєму складі три сорти іонів з ефективними масами 20 (90,92%), 21 (0,257%) і 22 (9,823%), появу яких у каналових променях електричного розряду в неоні не можна пояснити кратністю іонізації атоміф неону. Це дало змогу дійти до висновку, що прості речовини елементів, які мають дробові значення атомної ваги (атомної маси), складаються із суміші ізотопів з цілими значеннями ефективних мас.
Ізотопами
(від
грец. іsos-рівний, однаковий і topos -місце)
називаються різновиди атомів однакового
хімічного елемента з однаковим атомним
номером
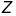 у періодичній системі елементів, котрі
мають майже однакові хімічні властивості
й дуже близькі за фізичними властивостями.
Їх
атомні ядра мають однакову кількість
протонів але різну кількість нейтронів.
Наприклад,
ізотопи
найлегшого елементу водню протій
у періодичній системі елементів, котрі
мають майже однакові хімічні властивості
й дуже близькі за фізичними властивостями.
Їх
атомні ядра мають однакову кількість
протонів але різну кількість нейтронів.
Наприклад,
ізотопи
найлегшого елементу водню протій
 ,
дейтерій
,
дейтерій
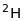 і
і
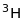 - тритій дуже сильно відрізняються за
масою, хімічними і фізичними властивостями.
- тритій дуже сильно відрізняються за
масою, хімічними і фізичними властивостями.
По-четверте,
наступні більш точні дослідження мас
іонів інших заряджених частинок і
відкриття ізотопів примусило змінити
атомну одиницю маси.
Атомною
одиницею маси (1а.о.м.),
що використовується сучасною атомною
і ядерною фізикою з 1984 року для визначення
мас елементарних частинок, атомів і
молекул, вибрана
одиниця маси рівна 1/12 маси ізотопу
вуглецю
 і рівна
і рівна
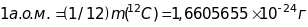
Вона
дуже близька до маси протона й маси
атома водню, хоча й відрізняється від
них. (Сучасна атомна одиниця маси
відрізняється від хімічної одиниці
маси, за яку було в свій час прийнято
1/16 маси ізотопу кисню
 і від одиниці атомної ваги, за яку було
вибрано 1/16 атомної маси природного
кисню, який є сумішшю трьох ізотопів
і від одиниці атомної ваги, за яку було
вибрано 1/16 атомної маси природного
кисню, який є сумішшю трьох ізотопів
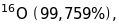
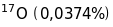 і
і
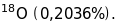 Сучасна
Сучасна
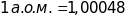 старої фізичної одинці маси і 0,999725 від
одиниці атомної ваги.)
старої фізичної одинці маси і 0,999725 від
одиниці атомної ваги.)
У
зв’язку з тим, що атомні маси ізотопів
не відрізняються цілими числами, то для
атомів елементів уводиться, так зване,
масове
число
 .
Воно є найближчим цілим числом до атомної
маси. У літературі масове число
.
Воно є найближчим цілим числом до атомної
маси. У літературі масове число
 позначається вгорі біля символу хімічного
елемента, наприклад,
,
,
позначається вгорі біля символу хімічного
елемента, наприклад,
,
,
 ,
тощо. Значення
не треба плутати з атомною масою. У
розділі ядерної фізики масове число
буде визначено як сумарне число нуклонів
(протонів і нейтронів) у складі атомного
ядра.
Це одна з найважливіших характеристик
атомного ядра (нукліда).
,
тощо. Значення
не треба плутати з атомною масою. У
розділі ядерної фізики масове число
буде визначено як сумарне число нуклонів
(протонів і нейтронів) у складі атомного
ядра.
Це одна з найважливіших характеристик
атомного ядра (нукліда).
