
- •1. Теплота и работа. Первое начало термодинамики.
- •2. Первое начало термодинамики при изохорическом, изобарическом и изотермическом процессах.
- •3. Теплоёмкость тела и вещества.
- •4. Адиабатический процесс. Уравнение Пуассона.
- •5. Политропические процессы.
- •6. Второе начало термодинамики. Обратимые и необратимые термодинамические процессы.
- •7. Круговой процесс. Тепловые и холодильные машины.
- •8. Идеальная тепловая машина Карно и её кпд.
- •9.Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики. Теорема Нернста.
- •10. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
- •11. Экспериментальные изотермы реального газа. Опыт Эндрюса.
- •1 2. Понятие фазовых переходов. Критические параметры и их связь с поправками Ван-дер-Ваальса.
- •13. Внутренняя энергия реального газа.
- •14. Эффект Джоуля-Томпсона.
- •15. Электрический заряд. Свойства электрического заряда. Закон сохранения электрического заряда. Закон Кулона.
- •16. Электростатическое поле. Напряженность электростатического поля. Силовые линии. Принцип суперпозиции электростатических полей.
- •17. Поток вектора напряженности электростатического поля. Теорема Гаусса для электростатического поля в вакууме в интегральной и дифференциальной формах.
- •18. Работа по перемещению электрического заряда в электростатическом поле.
- •19. Теорема о циркуляции вектора напряженности электростатического поля в интегральной и дифференциальной формах.
- •20. Потенциал. Разность потенциалов. Принцип суперпозиции для электростатических потенциалов.
- •22. Электрический диполь. Электрический момент диполя. Напряженность и потенциал поля диполя.
- •23. Диполь во внешних однородном и неоднородном электростатических полях. Энергия диполя во внешнем электростатическом поле.
- •26. Вектор поляризации. Диэлектрическая восприимчивость полярных и неполярных диэлектриков.
- •27. Теорема Гаусса для электростатического поля в диэлектрике. Вектор электрического смещения.
- •28. Диэлектрическая проницаемость среды. Условия на границе раздела двух диэлектрических сред.
- •29. Сегнетоэлектрики. Диэлектрический гистерезис. Температура Кюри.
- •30. Электрическое поле внутри проводника и вблизи его поверхности. Электростатическая защита.
- •31. Электроемкость уединенного проводника и конденсатора. Электроемкость уединенного проводящего шара.
- •32. Конденсаторы (плоский, сферический, цилиндрический) и их соединения.
- •33. Энергия системы зарядов, проводника и конденсатора. Объемная плотность энергии электрического поля.
- •34. Условия существования и характеристики постоянного электрического тока.
- •35. Законы Ома в интегральной и дифференциальной формах.
- •36. Работа и мощность тока. Закон Джоуля-Ленца в интегральной и дифференциальной формах.
- •37. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции.
- •38. Принцип суперпозиции магнитных полей. Закон Био-Савара-Лапласа.
- •39. Расчет магнитных полей прямого проводника с током бесконечной и конечной длины.
- •40. Магнитное поле движущегося электрического заряда.
- •41. Циркуляция вектора магнитной индукции. Теорема и циркуляции вектора магнитной индукции в вакууме в интегральной и дифференциальной форме.
- •42. Магнитное поле тороида и соленоида.
- •43. Магнитный поток. Теорема Гаусса для магнитного поля в интегральной и дифференциальной формах.
- •44. Сила Ампера. Взаимодействие параллельных проводников с током.
- •45. Магнитный момент контура с током. Механический момент, действующий на контур с током в однородном магнитном поле.
- •46. Работа перемещения проводника и контура с током в магнитном поле.
- •47. Сила Лоренца. Масс-спектрометрия.
- •48. Эффект Холла.
- •49. Опыты Фарадея. Закон электромагнитной индукции. Вихревое электрическое поле. Токи Фуко.
- •50. Явление самоиндукции. Индуктивность.
- •51. Энергия контура с током. Энергия и объёмная плотность энергии магнитного поля.
- •52. Атом в магнитном поле. Магнитные моменты электронов и атомов. Орбитальный и спиновой магнитные моменты.
- •53. Намагниченность. Микротоки и макротоки. Магнитная восприимчивость и магнитная проницаемость среды.
- •54. Типы магнетиков. Магнитная восприимчивость диамагнетиков и парамагнетиков.
- •55. Элементарная теория диа- и парамагнетизма.
- •56. Ферромагнетики. Магнитный гистерезис. Точка Кюри.
- •57. Вихревое электрическое поле. Ток смещения. Первое и второе уравнения Максвелла в интегральной форме.
- •58. Полная система уравнений Максвелла для электромагнитного поля в интегральной и дифференциальной формах. Материальные уравнения. Граничные условия.
- •59. Электромагнитные волны. Волновое уравнение. Основные свойства электромагнитной волны.
- •60. Энергия электромагнитной волны. Вектор Умова — Пойнтинга.
- •61. Интенсивность света при суперпозиции двух монохроматических волн. Интерференция света.
- •62. Время и длина когерентности. Способы получения когерентных волн.
- •6 3. Интерференция света на тонких пленках. Интерференционные приборы.
- •64. Явление дифракции света и условия её наблюдения. Принцип Гюйгенса-Френеля.
- •65. Метод зон Френеля.
- •66. Дифракция Френеля на круглом отверстии и диске.
- •67. Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •68. Дифракция рентгеновских лучей на кристаллической решетке.
- •69. Спектральные приборы. Разрешающая способность оптических приборов.
- •70. Естественный и поляризованный свет. Поляризация света при отражении и преломлении. Закон Брюстера.
- •71. Двойное лучепреломление. Поляризаторы. Закон Малюса.
4. Адиабатический процесс. Уравнение Пуассона.
Адиабатический
процесс
- протекающий без теплообмена с окружающей
средой. Так как по условию Q
= 0, то первое начало термодинамики можно
записать в следующем виде 0
= А
+ dU
A
= −dU.
Работа газа при адиабатическом процессе
происходит за счет убыли внутренней
энергии.
Учитывая,
что
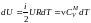 ,
а A
= pdV,
получим
,
а A
= pdV,
получим
 .Выразим
давление из уравнения Менделеева − Клапейрона
.Выразим
давление из уравнения Менделеева − Клапейрона
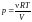 =>
=>
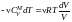
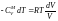 .
Приведем полученное выражение к виду
.
Приведем полученное выражение к виду
 .Проинтегрируем
выражение в пределах от Т1
до T2 ,
и от V1
до V2:
.Проинтегрируем
выражение в пределах от Т1
до T2 ,
и от V1
до V2:
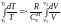
 .
.
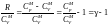
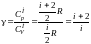 ,
где
− адиабатическая
постоянная.
,
где
− адиабатическая
постоянная.
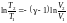


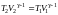 или
TV −1
= const.
Перейдем от этого уравнения к уравнению
в переменных p,
V.
Для этого выразим из уравнения
Менделеева − Клапейрона
температуру:
или
TV −1
= const.
Перейдем от этого уравнения к уравнению
в переменных p,
V.
Для этого выразим из уравнения
Менделеева − Клапейрона
температуру:
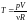 =>
=>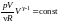
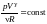 .
Учитывая, что
и R
− постоянные величины, получим
pV
= const
- уравнение
Пуассона. Теперь
перейдем к уравнению в переменных p,
T.
Из уравнения Менделеева − Клапейрона
выразим объем
.
Учитывая, что
и R
− постоянные величины, получим
pV
= const
- уравнение
Пуассона. Теперь
перейдем к уравнению в переменных p,
T.
Из уравнения Менделеева − Клапейрона
выразим объем
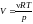 .
=>
.
=>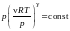 .
Так как
и R
− постоянные, получим
.
Так как
и R
− постоянные, получим
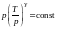 или
или
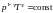 .Определим
работу, совершаемую газом при адиабатическом
процессе. Так как при адиабатическом
процессе A
= −dU,
и учитывая, что
.Определим
работу, совершаемую газом при адиабатическом
процессе. Так как при адиабатическом
процессе A
= −dU,
и учитывая, что
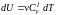 ,
получим
,
получим
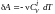 .Проинтегрировав
полученное выражение от T1
до T2 ,
получим:
.Проинтегрировав
полученное выражение от T1
до T2 ,
получим: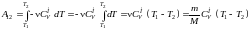 .
.
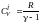 ,
а
,
а
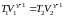 .
Отсюда
.
Отсюда
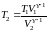 .
=>
.
=>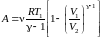 или
или
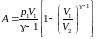 ,
учитывая, что RT1
= p1 V1 .
,
учитывая, что RT1
= p1 V1 .
5. Политропические процессы.
Процесс,
при котором теплоемкость тела остается
постоянной называется политропическим.
C
= const.
Найдем уравнение политропы для идеального
газа. Для этого запишем уравнение первого
начала термодинамики для идеального
газа в виде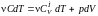 .
В полученное уравнение входят все три
параметра: p,
V
и T.
Исключим параметр Т,
и получим уравнение политропы в переменных
p,
V.
Для этого продифференцируем соотношение
pV
= RT:
d(pV)
= RdT
pdV
+ Vdp
= RdT.
Выразим dT
и подставим
.
В полученное уравнение входят все три
параметра: p,
V
и T.
Исключим параметр Т,
и получим уравнение политропы в переменных
p,
V.
Для этого продифференцируем соотношение
pV
= RT:
d(pV)
= RdT
pdV
+ Vdp
= RdT.
Выразим dT
и подставим
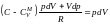 .
.
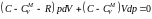 .
Заменив в данном уравнении
.
Заменив в данном уравнении
 через
через
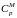 и разделив на pV,
придем к дифференциальному уравнению
вида:
и разделив на pV,
придем к дифференциальному уравнению
вида:
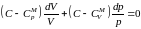
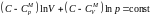 .Разделив
данное соотношение на
.Разделив
данное соотношение на
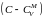 (что возможно, если
(что возможно, если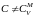 ),
получаем
),
получаем

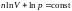 ,
,
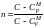 − показатель
политропы.
Произведя
потенцирование, получим pVn
= const
− уравнение
политропы.
При
− показатель
политропы.
Произведя
потенцирование, получим pVn
= const
− уравнение
политропы.
При
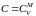 получим (
получим (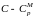 )ln V
= const
V
= const.
Откуда следует, что это
изохорический процесс. При этом процессе
показатель политропы n
.
Для
изобарического процесса n
=
0, для изотермического n
= 1, для адиабатического n
=
.
Определим
работу, которая совершается при
политропическом процессе. Выразим
давление через объем, применив уравнение
политропы
)ln V
= const
V
= const.
Откуда следует, что это
изохорический процесс. При этом процессе
показатель политропы n
.
Для
изобарического процесса n
=
0, для изотермического n
= 1, для адиабатического n
=
.
Определим
работу, которая совершается при
политропическом процессе. Выразим
давление через объем, применив уравнение
политропы
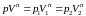 ,
где p1 ,
V1
и p2 ,
V2
− значения давления и объема газа
соответственно в начальном и конечном
состояниях; p
и V
− давление и объем в любом промежуточном
состоянии. Отсюда
,
где p1 ,
V1
и p2 ,
V2
− значения давления и объема газа
соответственно в начальном и конечном
состояниях; p
и V
− давление и объем в любом промежуточном
состоянии. Отсюда
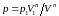 .
Тогда работа равна
.
Тогда работа равна
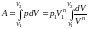 .
Для случая, когда n
1,
.
Для случая, когда n
1,
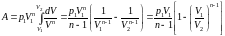 ,
или учитывая, что
,
или учитывая, что
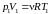 ,
получим
,
получим
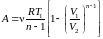 .
.
6. Второе начало термодинамики. Обратимые и необратимые термодинамические процессы.
Основываясь на первом законе термодинамики, можно было бы попытаться построить периодически действующий двигатель, совершающий работу за счет непрерывного охлаждения одного и того же источника теплоты, например за счет внутренней энергии океанов. Однако такой процесс, хотя он и удовлетворяет первому началу термодинамики, реализовать невозможно, что равноценно утверждению о невозможности построения так называемого вечного двигателя второго рода. Неоднократные попытки создания такого двигателя привели к открытию второго начала термодинамики:
1. Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от менее нагретого тела более нагретому (формулировка Клаузиуса).
2. Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную работу (формулировка Кельвина).
Второй закон термодинамики указывает на неравноценность двух форм передачи энергии − работы и теплоты. Этот закон учитывает тот факт, что процесс перехода энергии упорядоченного движения тела как целого (механической энергии) в энергию неупорядоченного движения его частиц (тепловую энергию) необратим. Термодинамический процесс называется обратимым, если он может быть проведен как в прямом, так и в обратном направлении через одни и те же состояния. При этом в окружающих термодинамическую систему телах никаких изменений не должно произойти. В противном случае процесс называется необратимым.
В качестве примера обратимого процесса в механике можно привести движения математического маятника. При отсутствии сил трения в подвесе и сопротивления среды колебательное движение маятника обратимо во времени. Механические процессы при наличии сопротивления и трения необратимы, поскольку связаны с необратимыми изменениями состояния окружающей среды.
Примерами необратимых процессов в молекулярной физике могут служить расширение газа в пустоту и переход теплоты от более нагретого тела к менее нагретому. Если с помощью каких-то механизмов осуществить эти процессы в обратном направлении и вернуть систему в исходное состояние, то в окружающих телах обязательно возникнут изменения, связанные с превращением некоторого количества механической энергии в тепловую.
