
- •1. Теплота и работа. Первое начало термодинамики.
- •2. Первое начало термодинамики при изохорическом, изобарическом и изотермическом процессах.
- •3. Теплоёмкость тела и вещества.
- •4. Адиабатический процесс. Уравнение Пуассона.
- •5. Политропические процессы.
- •6. Второе начало термодинамики. Обратимые и необратимые термодинамические процессы.
- •7. Круговой процесс. Тепловые и холодильные машины.
- •8. Идеальная тепловая машина Карно и её кпд.
- •9.Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики. Теорема Нернста.
- •10. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
- •11. Экспериментальные изотермы реального газа. Опыт Эндрюса.
- •1 2. Понятие фазовых переходов. Критические параметры и их связь с поправками Ван-дер-Ваальса.
- •13. Внутренняя энергия реального газа.
- •14. Эффект Джоуля-Томпсона.
- •15. Электрический заряд. Свойства электрического заряда. Закон сохранения электрического заряда. Закон Кулона.
- •16. Электростатическое поле. Напряженность электростатического поля. Силовые линии. Принцип суперпозиции электростатических полей.
- •17. Поток вектора напряженности электростатического поля. Теорема Гаусса для электростатического поля в вакууме в интегральной и дифференциальной формах.
- •18. Работа по перемещению электрического заряда в электростатическом поле.
- •19. Теорема о циркуляции вектора напряженности электростатического поля в интегральной и дифференциальной формах.
- •20. Потенциал. Разность потенциалов. Принцип суперпозиции для электростатических потенциалов.
- •22. Электрический диполь. Электрический момент диполя. Напряженность и потенциал поля диполя.
- •23. Диполь во внешних однородном и неоднородном электростатических полях. Энергия диполя во внешнем электростатическом поле.
- •26. Вектор поляризации. Диэлектрическая восприимчивость полярных и неполярных диэлектриков.
- •27. Теорема Гаусса для электростатического поля в диэлектрике. Вектор электрического смещения.
- •28. Диэлектрическая проницаемость среды. Условия на границе раздела двух диэлектрических сред.
- •29. Сегнетоэлектрики. Диэлектрический гистерезис. Температура Кюри.
- •30. Электрическое поле внутри проводника и вблизи его поверхности. Электростатическая защита.
- •31. Электроемкость уединенного проводника и конденсатора. Электроемкость уединенного проводящего шара.
- •32. Конденсаторы (плоский, сферический, цилиндрический) и их соединения.
- •33. Энергия системы зарядов, проводника и конденсатора. Объемная плотность энергии электрического поля.
- •34. Условия существования и характеристики постоянного электрического тока.
- •35. Законы Ома в интегральной и дифференциальной формах.
- •36. Работа и мощность тока. Закон Джоуля-Ленца в интегральной и дифференциальной формах.
- •37. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции.
- •38. Принцип суперпозиции магнитных полей. Закон Био-Савара-Лапласа.
- •39. Расчет магнитных полей прямого проводника с током бесконечной и конечной длины.
- •40. Магнитное поле движущегося электрического заряда.
- •41. Циркуляция вектора магнитной индукции. Теорема и циркуляции вектора магнитной индукции в вакууме в интегральной и дифференциальной форме.
- •42. Магнитное поле тороида и соленоида.
- •43. Магнитный поток. Теорема Гаусса для магнитного поля в интегральной и дифференциальной формах.
- •44. Сила Ампера. Взаимодействие параллельных проводников с током.
- •45. Магнитный момент контура с током. Механический момент, действующий на контур с током в однородном магнитном поле.
- •46. Работа перемещения проводника и контура с током в магнитном поле.
- •47. Сила Лоренца. Масс-спектрометрия.
- •48. Эффект Холла.
- •49. Опыты Фарадея. Закон электромагнитной индукции. Вихревое электрическое поле. Токи Фуко.
- •50. Явление самоиндукции. Индуктивность.
- •51. Энергия контура с током. Энергия и объёмная плотность энергии магнитного поля.
- •52. Атом в магнитном поле. Магнитные моменты электронов и атомов. Орбитальный и спиновой магнитные моменты.
- •53. Намагниченность. Микротоки и макротоки. Магнитная восприимчивость и магнитная проницаемость среды.
- •54. Типы магнетиков. Магнитная восприимчивость диамагнетиков и парамагнетиков.
- •55. Элементарная теория диа- и парамагнетизма.
- •56. Ферромагнетики. Магнитный гистерезис. Точка Кюри.
- •57. Вихревое электрическое поле. Ток смещения. Первое и второе уравнения Максвелла в интегральной форме.
- •58. Полная система уравнений Максвелла для электромагнитного поля в интегральной и дифференциальной формах. Материальные уравнения. Граничные условия.
- •59. Электромагнитные волны. Волновое уравнение. Основные свойства электромагнитной волны.
- •60. Энергия электромагнитной волны. Вектор Умова — Пойнтинга.
- •61. Интенсивность света при суперпозиции двух монохроматических волн. Интерференция света.
- •62. Время и длина когерентности. Способы получения когерентных волн.
- •6 3. Интерференция света на тонких пленках. Интерференционные приборы.
- •64. Явление дифракции света и условия её наблюдения. Принцип Гюйгенса-Френеля.
- •65. Метод зон Френеля.
- •66. Дифракция Френеля на круглом отверстии и диске.
- •67. Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •68. Дифракция рентгеновских лучей на кристаллической решетке.
- •69. Спектральные приборы. Разрешающая способность оптических приборов.
- •70. Естественный и поляризованный свет. Поляризация света при отражении и преломлении. Закон Брюстера.
- •71. Двойное лучепреломление. Поляризаторы. Закон Малюса.
13. Внутренняя энергия реального газа.
У
идеального газа внутренняя энергия Uид
равна
средней энергии поступательного,
вращательного и колебательного движений
его молекул. Внутренняя энергия идеального
газа определяется соотношением
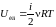 .(1)
В
случае реальных газов внутренняя энергия
равна сумме средней энергии поступательного,
вращательного и колебательного движений
его молекул и потенциальной энергии их
взаимодействия. С достаточной степенью
точности можно считать, что кинетическая
энергия теплового движения молекул
реального газа определяется выражением
(1).
.(1)
В
случае реальных газов внутренняя энергия
равна сумме средней энергии поступательного,
вращательного и колебательного движений
его молекул и потенциальной энергии их
взаимодействия. С достаточной степенью
точности можно считать, что кинетическая
энергия теплового движения молекул
реального газа определяется выражением
(1).
 .
(2)
Учтем
потенциальную энергию взаимодействия
всех молекул. Вклад сил отталкивания в
потенциальную энергию определяется
поправкой b,
которая
считается независящей от Т
и
V.
Поэтому
этот вклад во внутреннюю энергию можно
не учитывать. Среднее значение энергии
притяжения равно работе, которую нужно
затратить, чтобы разнести все молекулы
на бесконечно большие расстояния.
Внутреннее давление в уравнении
Ван-дер-Ваальса как раз и учитывает
действие сил притяжения, поэтому
потенциальная энергия взаимодействия
равна
.
(2)
Учтем
потенциальную энергию взаимодействия
всех молекул. Вклад сил отталкивания в
потенциальную энергию определяется
поправкой b,
которая
считается независящей от Т
и
V.
Поэтому
этот вклад во внутреннюю энергию можно
не учитывать. Среднее значение энергии
притяжения равно работе, которую нужно
затратить, чтобы разнести все молекулы
на бесконечно большие расстояния.
Внутреннее давление в уравнении
Ван-дер-Ваальса как раз и учитывает
действие сил притяжения, поэтому
потенциальная энергия взаимодействия
равна
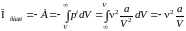 .(3)
Полная
внутренняя энергия реального газа
.(3)
Полная
внутренняя энергия реального газа
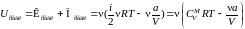 .
(4)
Из
формулы (4) видно, что внутренняя энергия
реального газа зависит не только от
температуры, но и от объема. Поэтому для
адиабатического процесса (Q
=
0), когда dU
= −pdV,
с
учетом выражения (4) получим
.
(4)
Из
формулы (4) видно, что внутренняя энергия
реального газа зависит не только от
температуры, но и от объема. Поэтому для
адиабатического процесса (Q
=
0), когда dU
= −pdV,
с
учетом выражения (4) получим
 .(5)
Отсюда
следует, что изменение температуры dT
реального
газа определяется не только работой
сил давления газа при расширении
(сжатии), но и изменением потенциальной
энергии взаимодействия молекул газа.
Этот тепловой эффект проявляется при
расширении газа в пустоту, а также в
опыте Джоуля − Томсона
по дросселированию газа через пористую
перегородку.
.(5)
Отсюда
следует, что изменение температуры dT
реального
газа определяется не только работой
сил давления газа при расширении
(сжатии), но и изменением потенциальной
энергии взаимодействия молекул газа.
Этот тепловой эффект проявляется при
расширении газа в пустоту, а также в
опыте Джоуля − Томсона
по дросселированию газа через пористую
перегородку.
14. Эффект Джоуля-Томпсона.
Э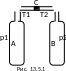 тот
опыт был проведен Джоулем совместно с
Томсоном. В соединительную трубку между
сосудами А
и
В
помещалась
пробка из пористого вещества С
(13.5.1).
Трубка окружалась теплоизолирующим
веществом. В А
и
В
давления
газа поддерживались постоянными. Газ
протекал по трубке с перепадом давлений
в месте, где расположена пробка. По обеим
сторонам пробки - чувствительные
термометры. Была обнаружена незначительная
разность температур, показываемых
обоими термометрами. Для большинства
газов температура с той стороны пробки,
куда газ расширялся, была несколько
ниже. Для водорода изменение температуры
оказалось обратным: при расширении
водород нагревался. Этот эффект,
заключающийся в изменении температуры
газа при расширении (без теплообмена),
носит название эффекта
Джоуля − Томсона.
Он
является следствием отступления свойств
реальных газов от свойств идеального
газа. Эффект Джоуля − Томсона,
сводящийся к охлаждению газа при его
расширении, принято называть положительным,
а
сводящийся к нагреванию − отрицательным.
а) Предположим,
что газ находится в таком состоянии,
когда вкладом от сил притяжения можно
пренебречь по сравнению со вкладом от
сил отталкивания (параметр а
= 0,
а параметр b
0).
Тогда уравнение Ван-дер-Ваальса
упростится, причем внутренняя энергия
будет содержать только кинетическую
энергию
p(V
− b)
= RT,
U
=
T.=>
тот
опыт был проведен Джоулем совместно с
Томсоном. В соединительную трубку между
сосудами А
и
В
помещалась
пробка из пористого вещества С
(13.5.1).
Трубка окружалась теплоизолирующим
веществом. В А
и
В
давления
газа поддерживались постоянными. Газ
протекал по трубке с перепадом давлений
в месте, где расположена пробка. По обеим
сторонам пробки - чувствительные
термометры. Была обнаружена незначительная
разность температур, показываемых
обоими термометрами. Для большинства
газов температура с той стороны пробки,
куда газ расширялся, была несколько
ниже. Для водорода изменение температуры
оказалось обратным: при расширении
водород нагревался. Этот эффект,
заключающийся в изменении температуры
газа при расширении (без теплообмена),
носит название эффекта
Джоуля − Томсона.
Он
является следствием отступления свойств
реальных газов от свойств идеального
газа. Эффект Джоуля − Томсона,
сводящийся к охлаждению газа при его
расширении, принято называть положительным,
а
сводящийся к нагреванию − отрицательным.
а) Предположим,
что газ находится в таком состоянии,
когда вкладом от сил притяжения можно
пренебречь по сравнению со вкладом от
сил отталкивания (параметр а
= 0,
а параметр b
0).
Тогда уравнение Ван-дер-Ваальса
упростится, причем внутренняя энергия
будет содержать только кинетическую
энергию
p(V
− b)
= RT,
U
=
T.=>
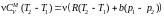
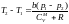
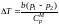 .
Поскольку р1
> р2 ,
то
газ нагревается в процессе прохождения
через пористую перегородку (T
> 0 − отрицательный
эффект Джоуля − Томсона).
б) Рассмотрим
другую ситуацию, когда а
0, а
поправка b
= 0. В этом случае
.
Поскольку р1
> р2 ,
то
газ нагревается в процессе прохождения
через пористую перегородку (T
> 0 − отрицательный
эффект Джоуля − Томсона).
б) Рассмотрим
другую ситуацию, когда а
0, а
поправка b
= 0. В этом случае
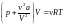
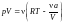 ;
;
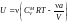 .
.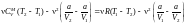
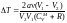
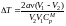 .
Поскольку при дросселировании V2
> V1,
то
T
<
0 (газ охлаждается − положительный
эффект Джоуля − Томсона).
В
случае, когда нельзя пренебречь ни той,
ни другой поправкой, аналогичные
преобразования приводят к следующей
формуле
.
Поскольку при дросселировании V2
> V1,
то
T
<
0 (газ охлаждается − положительный
эффект Джоуля − Томсона).
В
случае, когда нельзя пренебречь ни той,
ни другой поправкой, аналогичные
преобразования приводят к следующей
формуле
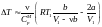 .
Кривая (рис. 13.5.3) разделяет плоскость
первоначальных состояний V1 ,
Т1
на
две области (T
>
0 и T
< 0),
в пределах которых наблюдается при
дросселировании либо положительный,
либо отрицательный эффект Джоуля − Томсона.
Совокупность параметров Т1
и
V1 ,
при
которых имеет место изменение знака
эффекта Джоуля − Томсона,
образует кривую
инверсии.
.
Кривая (рис. 13.5.3) разделяет плоскость
первоначальных состояний V1 ,
Т1
на
две области (T
>
0 и T
< 0),
в пределах которых наблюдается при
дросселировании либо положительный,
либо отрицательный эффект Джоуля − Томсона.
Совокупность параметров Т1
и
V1 ,
при
которых имеет место изменение знака
эффекта Джоуля − Томсона,
образует кривую
инверсии.
П оложительный
эффект (T
< 0)
используется в машинах Дьюара − Линде
для получения низких температур и
сжижения газов (переход газ − жидкость).
оложительный
эффект (T
< 0)
используется в машинах Дьюара − Линде
для получения низких температур и
сжижения газов (переход газ − жидкость).
3
