
- •1. Теплота и работа. Первое начало термодинамики.
- •2. Первое начало термодинамики при изохорическом, изобарическом и изотермическом процессах.
- •3. Теплоёмкость тела и вещества.
- •4. Адиабатический процесс. Уравнение Пуассона.
- •5. Политропические процессы.
- •6. Второе начало термодинамики. Обратимые и необратимые термодинамические процессы.
- •7. Круговой процесс. Тепловые и холодильные машины.
- •8. Идеальная тепловая машина Карно и её кпд.
- •9.Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики. Теорема Нернста.
- •10. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
- •11. Экспериментальные изотермы реального газа. Опыт Эндрюса.
- •1 2. Понятие фазовых переходов. Критические параметры и их связь с поправками Ван-дер-Ваальса.
- •13. Внутренняя энергия реального газа.
- •14. Эффект Джоуля-Томпсона.
- •15. Электрический заряд. Свойства электрического заряда. Закон сохранения электрического заряда. Закон Кулона.
- •16. Электростатическое поле. Напряженность электростатического поля. Силовые линии. Принцип суперпозиции электростатических полей.
- •17. Поток вектора напряженности электростатического поля. Теорема Гаусса для электростатического поля в вакууме в интегральной и дифференциальной формах.
- •18. Работа по перемещению электрического заряда в электростатическом поле.
- •19. Теорема о циркуляции вектора напряженности электростатического поля в интегральной и дифференциальной формах.
- •20. Потенциал. Разность потенциалов. Принцип суперпозиции для электростатических потенциалов.
- •22. Электрический диполь. Электрический момент диполя. Напряженность и потенциал поля диполя.
- •23. Диполь во внешних однородном и неоднородном электростатических полях. Энергия диполя во внешнем электростатическом поле.
- •26. Вектор поляризации. Диэлектрическая восприимчивость полярных и неполярных диэлектриков.
- •27. Теорема Гаусса для электростатического поля в диэлектрике. Вектор электрического смещения.
- •28. Диэлектрическая проницаемость среды. Условия на границе раздела двух диэлектрических сред.
- •29. Сегнетоэлектрики. Диэлектрический гистерезис. Температура Кюри.
- •30. Электрическое поле внутри проводника и вблизи его поверхности. Электростатическая защита.
- •31. Электроемкость уединенного проводника и конденсатора. Электроемкость уединенного проводящего шара.
- •32. Конденсаторы (плоский, сферический, цилиндрический) и их соединения.
- •33. Энергия системы зарядов, проводника и конденсатора. Объемная плотность энергии электрического поля.
- •34. Условия существования и характеристики постоянного электрического тока.
- •35. Законы Ома в интегральной и дифференциальной формах.
- •36. Работа и мощность тока. Закон Джоуля-Ленца в интегральной и дифференциальной формах.
- •37. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции.
- •38. Принцип суперпозиции магнитных полей. Закон Био-Савара-Лапласа.
- •39. Расчет магнитных полей прямого проводника с током бесконечной и конечной длины.
- •40. Магнитное поле движущегося электрического заряда.
- •41. Циркуляция вектора магнитной индукции. Теорема и циркуляции вектора магнитной индукции в вакууме в интегральной и дифференциальной форме.
- •42. Магнитное поле тороида и соленоида.
- •43. Магнитный поток. Теорема Гаусса для магнитного поля в интегральной и дифференциальной формах.
- •44. Сила Ампера. Взаимодействие параллельных проводников с током.
- •45. Магнитный момент контура с током. Механический момент, действующий на контур с током в однородном магнитном поле.
- •46. Работа перемещения проводника и контура с током в магнитном поле.
- •47. Сила Лоренца. Масс-спектрометрия.
- •48. Эффект Холла.
- •49. Опыты Фарадея. Закон электромагнитной индукции. Вихревое электрическое поле. Токи Фуко.
- •50. Явление самоиндукции. Индуктивность.
- •51. Энергия контура с током. Энергия и объёмная плотность энергии магнитного поля.
- •52. Атом в магнитном поле. Магнитные моменты электронов и атомов. Орбитальный и спиновой магнитные моменты.
- •53. Намагниченность. Микротоки и макротоки. Магнитная восприимчивость и магнитная проницаемость среды.
- •54. Типы магнетиков. Магнитная восприимчивость диамагнетиков и парамагнетиков.
- •55. Элементарная теория диа- и парамагнетизма.
- •56. Ферромагнетики. Магнитный гистерезис. Точка Кюри.
- •57. Вихревое электрическое поле. Ток смещения. Первое и второе уравнения Максвелла в интегральной форме.
- •58. Полная система уравнений Максвелла для электромагнитного поля в интегральной и дифференциальной формах. Материальные уравнения. Граничные условия.
- •59. Электромагнитные волны. Волновое уравнение. Основные свойства электромагнитной волны.
- •60. Энергия электромагнитной волны. Вектор Умова — Пойнтинга.
- •61. Интенсивность света при суперпозиции двух монохроматических волн. Интерференция света.
- •62. Время и длина когерентности. Способы получения когерентных волн.
- •6 3. Интерференция света на тонких пленках. Интерференционные приборы.
- •64. Явление дифракции света и условия её наблюдения. Принцип Гюйгенса-Френеля.
- •65. Метод зон Френеля.
- •66. Дифракция Френеля на круглом отверстии и диске.
- •67. Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •68. Дифракция рентгеновских лучей на кристаллической решетке.
- •69. Спектральные приборы. Разрешающая способность оптических приборов.
- •70. Естественный и поляризованный свет. Поляризация света при отражении и преломлении. Закон Брюстера.
- •71. Двойное лучепреломление. Поляризаторы. Закон Малюса.
11. Экспериментальные изотермы реального газа. Опыт Эндрюса.
Д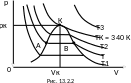 ля
проверки уравнения состояния реального
газа и выяснения физического смысла
характера изотерм Ван-дер-Ваальса удобно
воспользоваться результатами опыта
Эндрюса
- экспериментировал
с углекислым газом (СО2).
Под поршнем цилиндра помещался моль
CO2.
Давление и объем газа по манометру М
и
шкале объемов V.
Через
герметически застекленное окошко О
можно
было видеть пространство, занятое газом.
Весь цилиндр помещался в термостат -
устанавливал и поддерживал необходимую
температуру газа. Эндрюс провел с
углекислым газом ряд изотермических
процессов при различных температурах.
Результаты - рис. 13.2.2. До тех пор пока
газ сжимался при высоких температурах
(> 304 К), в пространстве под поршнем не
происходило никаких видимых
процессов,
когда же сжатие производилось при низких
температурах (
304 К), Эндрюс увидел, что на некоторой
стадии сжатия под поршнем появлялись
капельки жидкости (туман), оседающие на
стенки и стекающие на дно цилиндра. =>
весь цилиндр заполнился жидкой
углекислотой. Давление на всей этой
стадии, которой соответствуют
горизонтальные участки изотерм,
оставалось неизменным. Таким образом,
горизонтальные
участки - стадии сжижения газа,
совершающегося при постоянном давлении.
ля
проверки уравнения состояния реального
газа и выяснения физического смысла
характера изотерм Ван-дер-Ваальса удобно
воспользоваться результатами опыта
Эндрюса
- экспериментировал
с углекислым газом (СО2).
Под поршнем цилиндра помещался моль
CO2.
Давление и объем газа по манометру М
и
шкале объемов V.
Через
герметически застекленное окошко О
можно
было видеть пространство, занятое газом.
Весь цилиндр помещался в термостат -
устанавливал и поддерживал необходимую
температуру газа. Эндрюс провел с
углекислым газом ряд изотермических
процессов при различных температурах.
Результаты - рис. 13.2.2. До тех пор пока
газ сжимался при высоких температурах
(> 304 К), в пространстве под поршнем не
происходило никаких видимых
процессов,
когда же сжатие производилось при низких
температурах (
304 К), Эндрюс увидел, что на некоторой
стадии сжатия под поршнем появлялись
капельки жидкости (туман), оседающие на
стенки и стекающие на дно цилиндра. =>
весь цилиндр заполнился жидкой
углекислотой. Давление на всей этой
стадии, которой соответствуют
горизонтальные участки изотерм,
оставалось неизменным. Таким образом,
горизонтальные
участки - стадии сжижения газа,
совершающегося при постоянном давлении.
Д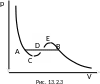 авление,
при котором начинается сжижение газа,
зависит от температуры - давление
насыщенного пара.
При
уменьшении объема большее количество
газа (точнее, насыщенного пара) переходит
в жидкость. Жидкость трудно сжимаема
=> левая ветвь изотермы, соответствующая
жидкой фазе, круто поднимается вверх.
Превращение
газа в жидкость: на изотермах Эндрюса
− участки плато, а на изотермах
Ван-дер-Ваальса − волнообразные участки.
EB
на
изотерме Ван-дер-Ваальса - пересыщенный
пар,
давление
которого больше
насыщенного
пара при данной температуре. AC
- перегретой
жидкости,
давление
над которой меньше
насыщенного
пара при данной температуре. При
проведении опыта получили EB
пересыщенного пара и AC
перегретой
жидкости. CB
и
DE
соответствуют
столь неустойчивому состоянию вещества,
что их не удается получить на опыте.
Опыт Эндрюса показывает, что уравнение
Ван-дер-Ваальса хорошо отражает
действительность и что его можно
рассматривать как уравнение состояния
реального газа, описывающее также
состояние жидкости и процесс перехода
газа в жидкость.
авление,
при котором начинается сжижение газа,
зависит от температуры - давление
насыщенного пара.
При
уменьшении объема большее количество
газа (точнее, насыщенного пара) переходит
в жидкость. Жидкость трудно сжимаема
=> левая ветвь изотермы, соответствующая
жидкой фазе, круто поднимается вверх.
Превращение
газа в жидкость: на изотермах Эндрюса
− участки плато, а на изотермах
Ван-дер-Ваальса − волнообразные участки.
EB
на
изотерме Ван-дер-Ваальса - пересыщенный
пар,
давление
которого больше
насыщенного
пара при данной температуре. AC
- перегретой
жидкости,
давление
над которой меньше
насыщенного
пара при данной температуре. При
проведении опыта получили EB
пересыщенного пара и AC
перегретой
жидкости. CB
и
DE
соответствуют
столь неустойчивому состоянию вещества,
что их не удается получить на опыте.
Опыт Эндрюса показывает, что уравнение
Ван-дер-Ваальса хорошо отражает
действительность и что его можно
рассматривать как уравнение состояния
реального газа, описывающее также
состояние жидкости и процесс перехода
газа в жидкость.
Из опыта Эндрюса выяснилось, что газ может быть переведен в жидкое состояние только при температурах, меньших некоторой определенной для данного газа температуры Тк ; при температурах, больших Тк , газ нельзя перевести в жидкое состояние никаким давлением. Температура Тк называется критической. Для углекислого газа Тк = 304 К. Критической называется такая температура, выше которой газ нельзя превратить в жидкость никаким давлением, а ниже которой газ можно превратить в жидкость при некотором давлении, тем меньшем, чем ниже температура. Газ, находящийся при температуре, меньшей критической - пар.
1 2. Понятие фазовых переходов. Критические параметры и их связь с поправками Ван-дер-Ваальса.
Изотерма
реального газа (рис. 13.2.2), соответствующая
критической температуре, точка перегиба
К
и
соответствующее ей состояние вещества,
объем и давление, соответствующие
критическому состоянию (координаты
точки К),
называются
критическими.
Параметры
критическое состояние вещества были
определены для многих газов и газовых
смесей.
Сравнивая
изотеры Эндрюса и Ван-дер-Ваальса (рис.
13.2.3) можно выразить критические параметры
через постоянные Ван-дер-Ваальса a
и b.
Получим эти соотношения. Уравнение
Ван-дер-Ваальса при критическом состоянии
имеет вид
 .
Приведем к кубическому
уравнению относительно V
.
Приведем к кубическому
уравнению относительно V
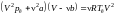
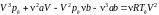

 .
Так как при критическом режиме только
один вещественный корень Vк ,
то данное кубическое уравнение можно
привести к виду
.
Так как при критическом режиме только
один вещественный корень Vк ,
то данное кубическое уравнение можно
привести к виду

 .
.
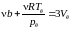 ;
;
 ;
;
 .
.
Vк = 3b.
 .
.
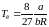 .
.
