
- •Гесса закон
- •2.1 Объясните изменение энтропии в процессах
- •Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
- •К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
- •Влияние температуры
- •Факторы влияющие на смещение равновесия химических реакций. Принцип Ле –Шателье
- •Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Периодическая система элементов д.И. Менделеева
- •Виды химической связи
- •Полярная ковалентная связь
- •Донорно-акцепторная связь
- •Водородные связи
- •Теория растворов электролитов. Сильные и слабые электролиты, основные положения теории сильных электролитов. Закон действия масс
- •Степень диссоциации. Сила электролитов.
- •Закон действия масс
- •Константы диссоциации некоторых слабых электролитов в водных растворах при 25°с
- •Коэффициенты активности ионов f при различных ионных силах раствора
- •Константы диссоциации некоторых сильных кислот в водных растворах при 25 °с
- •Ионно-молекулярные уравнения.
- •Растворимость важнейших солей в воде
- •1.1 Металлические покрытия
- •1.2 Гальванические покрытия.
- •1.3 Термодиффузионный метод покрытия
- •1.4 Горячий метод, или метод погружения в расплавленный металл
- •1.5 Металлизация напылением
- •1.2 Неметаллические покрытия
- •1.2.1 Неорганические покрытия
- •1.2.2 Фосфатирование
- •1.2.3 Пассивирование
- •1.2.1 Эмали
- •1.2.2 Органические покрытия
Теория растворов электролитов. Сильные и слабые электролиты, основные положения теории сильных электролитов. Закон действия масс
Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами. Электролитами являются соли, кислоты и основания.
При растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков, гидроксид-ионы. Диссоциация НС1 и NaCl выразится уравнением:
HCl = H+ + Cl+
NaCl =Na++ Cl+
Процесс диссоциации. В зависимости от структуры растворяющегося вещества в безводном состоянии ( ионная или полярная связь) его диссоциация протекает по-разному.
Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными.
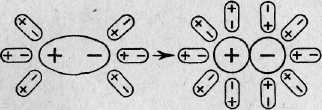
Рис. 1. Схема диссоциации полярных молекул в растворе
Иначе протекает диссоциация полярных молекул (рис. 1). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов — поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в молекуле, а также с тепловым движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. Ион водорода Н+ (протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода и азотной кислоты происходят процессы, которые можно выразить уравнениями
Н2О + НСl = Н3О+ + Сlˉ
Н2О + HNO3 =Н3О+ + NOˉ3
В результате этого процесса молекула НСl расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион Сlˉ, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидроксония Н3О+ .
Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В результате диссоциации образуются не свободные ионы, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, тем более, что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий.
Степень диссоциации. Сила электролитов.
Чаще всего в растворе лишь часть электролита диссоциирует на ионы, поэтому существует понятие степени диссоциации.
Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
В связи с этим электролиты можно разделить на две группы - сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, HCN, H2SiО3и NH4OH.
Степень диссоциации принято обозначать греческой буквой ά и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН ά = 0,013 (или 1,3%), а для 0,1 н. раствора HCN ά = 10ˉ4 (или 0,01%).
