- •Гесса закон
- •2.1 Объясните изменение энтропии в процессах
- •Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
- •К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
- •Влияние температуры
- •Факторы влияющие на смещение равновесия химических реакций. Принцип Ле –Шателье
- •Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Периодическая система элементов д.И. Менделеева
- •Виды химической связи
- •Полярная ковалентная связь
- •Донорно-акцепторная связь
- •Водородные связи
- •Теория растворов электролитов. Сильные и слабые электролиты, основные положения теории сильных электролитов. Закон действия масс
- •Степень диссоциации. Сила электролитов.
- •Закон действия масс
- •Константы диссоциации некоторых слабых электролитов в водных растворах при 25°с
- •Коэффициенты активности ионов f при различных ионных силах раствора
- •Константы диссоциации некоторых сильных кислот в водных растворах при 25 °с
- •Ионно-молекулярные уравнения.
- •Растворимость важнейших солей в воде
- •1.1 Металлические покрытия
- •1.2 Гальванические покрытия.
- •1.3 Термодиффузионный метод покрытия
- •1.4 Горячий метод, или метод погружения в расплавленный металл
- •1.5 Металлизация напылением
- •1.2 Неметаллические покрытия
- •1.2.1 Неорганические покрытия
- •1.2.2 Фосфатирование
- •1.2.3 Пассивирование
- •1.2.1 Эмали
- •1.2.2 Органические покрытия
Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
![]()
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
![]()
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
![]()
Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект составляет +179,2 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
10 - Влияние концентрации, температуры и давления на смещение химического равновесия
Факторы влияющие на смещение равновесия химических реакций. Принцип Ле –Шателье
Состояние химического равновесия сохраняется только до тех пор, пока остаются не измененными условия равновесия, т.е. концентрации реагирующих веществ и температура, а для реакций с участием газов – давление. Всякое изменение указанных условий приводит к нарушению равновесия. В системе ликвидируется равенство скоростей прямой и обратной реакций и начинает преобладать одна из них. Так продолжается до тех пор, пока снова не наступит равенство скоростей прямой и обратной реакций и опять не установится состояние равновесия, отвечающее новым условиям. Переход системы из одного состояния равновесия в другое называется смещением химического равновесия.
Правило смещения химического равновесия под влиянием изменения внешних условий было сформулировано Ле Шателье.
Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
Т.е если изменить одно из условий, при которых система находится в состоянии химического равновесия, например концентрацию, температуру или давление, то равновесие смещается в сторону той реакции, которая противодействует произведенному изменению.
Увеличение концентрации одного из участвующих в реакции веществ вызывает в системе процесс, ведущий к уменьшению концентрации этого вещества. Так, например, если в равновесную систему N2 + 3H2 - 2NH3 ввести дополнительное количество водорода, то такое воздействие приведет к ускорению реакции взаимодействия водорода с азотом.
Большое значение при промышленном использовании обратимых химических реакций имеют катализаторы. Однако катализаторы никогда не смещают равновесия. Они уменьшают время, необходимое для достижения равновесия. Во сколько раз катализаторы ускоряют прямую реакцию, во столько же – и обратную.
11 - Строение атома
СТРОЕНИЕ АТОМА |
|||||||||||||
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства. Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня. Квантовые числа электронов
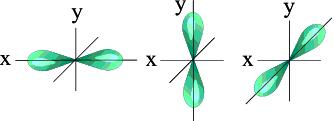
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси. Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним. Пример. Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5). Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем. Для l=0 s- подуровень, s- орбиталь – орбиталь сфера l=1 p- подуровень, p- орбиталь – орбиталь гантель l=2 d- подуровень, d- орбиталь – орбиталь сложной формы f-подуровень, f-орбиталь – орбиталь еще более сложной формы
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали - сферическая; на первом энергетическом только один подуровень - 1s. Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь - гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной формы. Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d. Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве. Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве. Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1. Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2. Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей. Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения. Принципы заполнения орбиталей
Полная электронная формула элемента Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
|
12 - Принцип Паули
ПАУЛИ ПРИНЦИП, фундаментальный принцип квантовой механику согласно к-рому у системы тождественных элементарных частиц с полуцелым спином (фер-мионов) каждое квантовое состояние м. б. заполнено не более чем одной частицей. В. Паули сформулировал этот принцип, названный им принципом запрета, в январе 1925, незадолго до того, как была создана квантовая механика (1925-26), для объяснения наблюдаемых закономерностей в электронных спектрах атомов, помещенных в магн. поле. Согласно этой формулировке, в атоме не может существовать двух или более электронов, для к-рых значения всех четырех квантовых чисел n, l, mi, и ms одинаковы (см. Атом). В то время понятие спина еще не было введено, поэтому четвертое квантовое число не описывалось В. Паули никакой моделью. Он назвал связанное с ним св-во "характерной двузначностью квантовых свойств электрона, которую нельзя описать классически".
Впоследствии было показано (П. Дирак, 1926), что Паули принцип является следствием антисимметричности волновой ф-ции системы относительно перестановок электронов. В случае системы из N невзаимодействующих электронов антисимметричная волновая ф-ция (1, 2, ..., N) м. б. представлена в виде определителя (детерминанта), составленного из волновых ф-ций электронов kp (i) в квантовых состояниях kp , характеризуемых каждое четырьмя квантовыми числами (i - совокупность пространств. координат и спина i-го электрона):
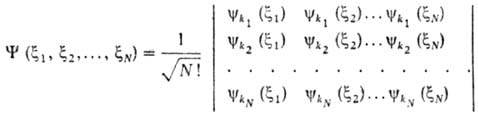
Если к.-л. две строки детерминанта совпадают, он тождественно обращается в нуль. Отсюда следует, что все наборы квантовых чисел kp должны быть разными, т. е. не м. б. двух электронов в одном состоянии.
В дальнейшем принцип запрета был сформулирован для всех известных частиц, а не только для электронов (В. Паули, 1940). А именно: в системе тождеств. частиц со спином s осуществляются только такие состояния, для к-рых полная волновая ф-ция при перестановке любой пары частиц умножается на (—1)2s, т.е. волновая ф-ция симметрична для целочисленных s (система частиц подчиняется статистике Бозе-Эйнштейна) и антисимметрична при полуцелых s (статистика Ферми-Дирака). Частицы с целыми значениями спина наз. бозонами, с полуцелыми - фер-мионами.
Принцип запрета относится и к перестановочной симметрии составных частиц, напр, атомных ядер. В зависимости от спина ядра можно говорить о ядрах-бозонах и ядрах-фермионах. Учет Паули принципа для ядер молекулы проявляется, в частности, во вращательных спектрах. Напр., в молекуле 16O2 ядра атомов 16O состоят из четного числа нуклонов-фсрмионов и потому имеют целочисл. спин (являются бозонами). Это означает, что волновая ф-ция молекулы 16O2 должна быть симметричной относительно перестановок ядер. Это приводит к запрету всех вращат. уровней энергии с нечетными значениями вращат. момента, что подтверждается наблюдаемыми закономерностями во вращат. спектрах.
Понятие квантового состояния частицы в системе справедливо в тех случаях, когда взаимод. между частицами можно заменить нек-рым эффективным полем, а каждую частицу можно характеризовать индивидуальным набором квантовых чисел; при строгом рассмотрении системы взаимод. частиц существуют только квантовые состояния всей системы в целом. Одночастичное приближение лежит в основе метода самосогласов. поля (метод Хартри-Фока; см. Молекулярных орбиталей методы), широко применяемого в теории атомных и мол. спектров, квантовой теории хим. связи, при описании оболочечных моделей атома и ядра и т.д.
Паули
принцип в рамках одночастичного
приближения позволяет обосновать
периодич. систему хим. элементов Д. И.
Менделеева, т.к. наличие в одном состоянии
только одного электрона
объясняет последовательность заполнения
электронных оболочек и связанную с этой
последовательностью периодичность
св-в элементов. Макс. число электронов
в оболочке с главным квантовым числом
n определяется, согласно Паули принципу,
числом разл. наборов квантовых чисел
l, ml,
и ms,
т. е. равно
![]() 2(2l
+ 1) = 2n2.
Отсюда получаются числа заполнения
электронных оболочек в порядке возрастания
номера оболочки: 2, 8, 18, 32 ... Для эквивалентных
электронов
атома,
т. е. электронов
с одинаковыми n и l, в силу Паули принципа
осуществляются не все возможные
состояния, а лишь те, к-рые различаются
ml
или ms.
B частности, для электронной конфигурации
(пр)2
правило векторного сложения моментов
кол-ва движения дает шесть термов: 1,3S,
1,3P
1,3D,
из к-рых разрешены только три: 1S,
3P
и 1D,
т. к. для остальных трех термов наборы
квантовых чисел для двух электронов
совпадают. Учет Паули принципа необходим
также при нахождении разрешенных
электронных состояний молекул
и мол. комплексов. Паули принцип играет
фундам. роль в квантовой теории твердого
тела,
теории ядерных
реакций
и р-ций между элементарными
частицами.
2(2l
+ 1) = 2n2.
Отсюда получаются числа заполнения
электронных оболочек в порядке возрастания
номера оболочки: 2, 8, 18, 32 ... Для эквивалентных
электронов
атома,
т. е. электронов
с одинаковыми n и l, в силу Паули принципа
осуществляются не все возможные
состояния, а лишь те, к-рые различаются
ml
или ms.
B частности, для электронной конфигурации
(пр)2
правило векторного сложения моментов
кол-ва движения дает шесть термов: 1,3S,
1,3P
1,3D,
из к-рых разрешены только три: 1S,
3P
и 1D,
т. к. для остальных трех термов наборы
квантовых чисел для двух электронов
совпадают. Учет Паули принципа необходим
также при нахождении разрешенных
электронных состояний молекул
и мол. комплексов. Паули принцип играет
фундам. роль в квантовой теории твердого
тела,
теории ядерных
реакций
и р-ций между элементарными
частицами.
13 - Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом
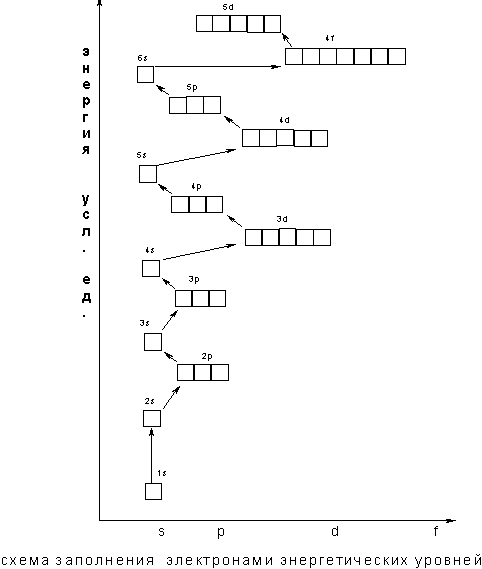
Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
И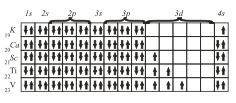 менно
поэтому в четвертом периоде сначала
заполняется подуровень 4s и
лишь после этого подуровень Зd.
менно
поэтому в четвертом периоде сначала
заполняется подуровень 4s и
лишь после этого подуровень Зd.

Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
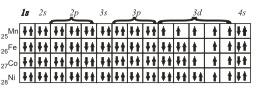
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
Наконец, последние восемь элементов четвертого периода имеют конфигурации
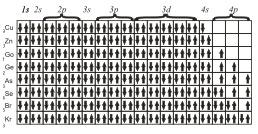
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией.
Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d104p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией.
Правило Клечковского: Заполнение орбиталей происходит в порядке увеличения суммы квантовых чисел n+l; при постоянной сумме n+l заполнение происходит в порядке возрастания n. Применение правила Клечковского дает последовательность возрастания энергии орбиталей.
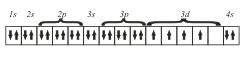
Правило Гунда: Электроны заполняют орбитали вначале в виде холостых с одинаковыми спинами, а затем в виде спаренных.
Рассмотрим заполнение трех орбиталей р-подуровня. Орбиталь принято обозначать графически в виде квадратиков или прямоугольников, называемых квантовыми ячейками, а электроны обозначают стрелками, направление которых связывают со спином. Первые три электрона заполнят три р-орбитали по-одному (холостые электроны) и с одинаковыми спинами (параллельные электроны) (рис.4.2,а). Последующие электроны будут заполнять эти же орбитали, но будут иметь противоположные спины (рис.4.2, б-г). Два электрона с противоположными спинами, занимающие одну орбиталь, называют спаренными, антипараллельными электронами. Неполностью заполненный подуровень или уровень называют ненасыщенным, а полностью заполненный – насыщенным.
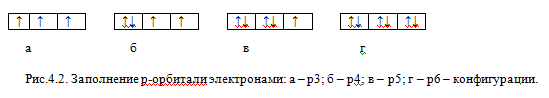
14 - Правило Хунда.
ХУНДА ПРАВИЛА, приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров. Формулировка Хунда правил предполагает, что состояние многоэлектронного атома можно описать, указав т. наз. электронную конфигурацию - набор тех состояний, в к-рых находятся отдельные электроны. В общем случае данной электронной конфигурации отвечает неск. разных энергетич. состояний атома. Каждое из них в силу сферич. симметрии атома можно классифицировать по суммарному орбитальному моменту (квантовое число L = 0, 1, 2, ... отвечает соотв. состояниям S, Р, D-типов), суммарному спину (квантовое число S) и полному моменту импульса атома как целого (квантовое число J, к-рое при заданных L и S меняется от L + S до |L - S | с шагом 1). Напр., атом С в низших состояниях можно описать электронной конфигурацией Is22s22p2; общее число состояний, отвечающих такой конфигурации, с учетом вырожденности нек-рых уровней равно 15. При стандартном обозначении символом 2S+lLj состояния атома С - 1S0,3P0,3Р1, 3Р2, 1D2. Наиб. распространены след. Хунда правил: 1. Из состояний атома с заданной электронной конфигурацией ниже по энергии те, к-рые отвечают большим значениям S. 2. Из состояния атома с заданной конфигурацией и заданным спином S ниже по энергии те, к-рые отвечают большему значению L. С Хунда правилами тесно связан важный для теории мол. орбиталей принцип заполнения: из неск. конфигураций молекулы ниже по энергии те, для к-рых сумма значений орбитальных энергий атомов меньше. Хунда правила ограничены в осн. низколежащими состояниями атомов при условии, что влияние электронной корреляции (взаимной обусловленности движений электронов) достаточно мало и не нарушает границ применимости одноконфигурационного приближения (см. Конфигурационного взаимодействия метод). Основанием для выполнения первого правила является тесная связь между симметрией пространств. части волнoвой ф-ции атома и симметрией ее спиновой части, существующая согласно Паули принципу. По этой же причине первое Хунда правило обычно выполняется и для молекул. Второе Хунда правило имеет более ограниченную применимость и определяется в осн. тем, насколько значимо межэлектронное отталкивание в анализируемых состояниях. Это правило выполняется иногда и для линейных молекул (при замене L на модуль проекции момента кол-ва движения на ось молекулы). Для нек-рых типов состояний удается найти дополнит. правила, отвечающие изменению энергии атома при данной конфигурации и данных L и S в зависимости от J. Эти правила связаны со спин-орбитальным взаимодействием и др. тонкими эффектами. Напр., если в конфигурации есть лишь одна частично заполненная оболочка, то при заполнении оболочки менее чем на половину ("нормальный мультиплет") энергия растет с повышением J. В остальных случаях с ростом J энергия убывает ("обращенный мультиплет"). Так, для атома С описанные правила подтверждаются эксперим. значениями энергий возбуждения из основного состояния 3Р0: энергия перехода в, состояние 3Р1 равна 0,2 кДж/моль, в состояния 3Р2 - 0,5, 1D2 - 121,9, 1S0 - 259,0 кДж/моль. Хунда правила часто нарушаются, т. к. одноконфигурационные модели атомов и молекул довольно редко бывают надежны. С появлением прецизионных эксперим. данных о спектрах атомов они теряют свое значение.
15 - Правила Клечковского.
Правило Клечковского — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
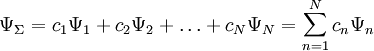 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
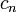 .
.
Правило n+l предложено в 1936 г. немецким физиком Э. Маделунгом; в 1951 г. было вновь сформулировано В. М. Клечковским.