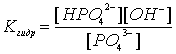- •Гесса закон
- •2.1 Объясните изменение энтропии в процессах
- •Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
- •К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
- •Влияние температуры
- •Факторы влияющие на смещение равновесия химических реакций. Принцип Ле –Шателье
- •Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Периодическая система элементов д.И. Менделеева
- •Виды химической связи
- •Полярная ковалентная связь
- •Донорно-акцепторная связь
- •Водородные связи
- •Теория растворов электролитов. Сильные и слабые электролиты, основные положения теории сильных электролитов. Закон действия масс
- •Степень диссоциации. Сила электролитов.
- •Закон действия масс
- •Константы диссоциации некоторых слабых электролитов в водных растворах при 25°с
- •Коэффициенты активности ионов f при различных ионных силах раствора
- •Константы диссоциации некоторых сильных кислот в водных растворах при 25 °с
- •Ионно-молекулярные уравнения.
- •Растворимость важнейших солей в воде
- •1.1 Металлические покрытия
- •1.2 Гальванические покрытия.
- •1.3 Термодиффузионный метод покрытия
- •1.4 Горячий метод, или метод погружения в расплавленный металл
- •1.5 Металлизация напылением
- •1.2 Неметаллические покрытия
- •1.2.1 Неорганические покрытия
- •1.2.2 Фосфатирование
- •1.2.3 Пассивирование
- •1.2.1 Эмали
- •1.2.2 Органические покрытия
Ионно-молекулярные уравнения.
НСI + NaOH = NaCl + Н2О
HNO3 + КОН = KNO3 + Н2О
Реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу — к образованию молекул воды из ионов водорода и гидроксид-ионов.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением
Н+ + ОНˉ ↔ Н2О
Однако, как мы увидим ниже, вода — очень слабый электролит и диссоциирует лишь в ничтожно малой степени. Иначе говоря, равновесие между молекулами воды и ионами сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца. Это и есть ионно-молекулярное уравнение реакции.
При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой ее соли всегда образуется характерный белый творожистый осадок хлорида серебра:
AgNO3 + НС1 = AgCl↓ + HNO3
Ag2SO4 + CuCl2 = 2AgCl↓ + CuSO4
Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме, а вещество, находящееся в осадке, в молекулярной:
Ag+ + NOˉ 3 + Н+ + Сlˉ = AgCl↓ + Н+ + NOˉ 3
Как видно, ионы Н+ и NOˉ3 не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение еще раз:
Ag+ + Сlˉ → AgCl↓
Это и есть ионно-молекулярное уравнение рассматриваемого процесса. Вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования AgCl из ионов практически доходит до конца.
Для составления ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие нерастворимы. Общая характеристика растворимости в воде важнейших солей приведена в табл. 4
Таблица 4
Растворимость важнейших солей в воде
Анионы и катионы |
Растворимость солей |
NOˉ 3 Clˉ
SO2ˉ 4 CO2ˉ 3
PO3ˉ 4 Na+, K+, NH+ 4 |
Растворимы все соли Растворимы все соли, кроме AgNO3, CuCl, PbCl2 Hg2Cl2 Растворимы все соли, кроме BaSO4, SrSO4, PbSO4; малорастворим CaSO4 Из средних солей растворимы только соли натрия, калия и аммония То же
Растворимы почти все соли
|
24 - Произведение растворимости
Определение Поместим в химический стакан какую-либо труднорастворимую соль, например, AgCl и добавим к осадку дистиллированной воды. При этом ионы Ag+ и Cl-, испытывая притяжение со стороны окружающих диполей воды, постепенно отрываются от кристаллов и переходят в раствор. Сталкиваясь в растворе, ионы Ag+ и Cl- образуют молекулы AgCl и осаждаются на поверхности кристаллов. Таким образом, в системе происходят два взаимно противоположных процесса, что приводит к динамическому равновесию, когда в единицу времени в раствор переходит столько же ионов Ag+ и Cl-, сколько их осаждается. Накопление ионов Ag+ и Cl- в растворе прекращается, получается насыщенный раствор. Следовательно, мы будем рассматривать систему, в которой имеется осадок труднорастворимой соли в соприкосновении с насыщенным раствором этой соли. При этом происходят два взаимно противоположных процесса: 1) Переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной при неизменной температуре: V1 = K1; 2) Осаждение ионов из раствора. Скорость этого процесса V2 зависит от концентрации ионов Ag+ и Cl-. По закону действия масс: V2 = k2
[Ag+] [Cl-]
Так как данная система находится в состоянии равновесия, то V1 = V2 k2 = k1
[Ag+] [Cl-]
[Ag+]
[Cl-] = k2 / k1 = const (при T = const)
Таким образом, произведение концентраций ионов в насыщенном растворе труднорастворимого электролита при постоянной температуре является постоянной величиной. Эта величина называется произведением растворимости (ПР). В приведенном примере ПРAgCl = [Ag+] • [Cl-]. В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрация этих ионов, при вычислении произведения растворимости должна быть возведена в соответствующую степень. Например, ПРAg2S = [Ag+]2
[S2-]; ПРPbI2 = [Pb2+] [I-]2
В общем случае выражение произведения растворимости для электролита AmBn ПРAmBn = [A]m [B]n. Значения произведения растворимости для разных веществ различны. Например, ПРCaCO3 = 4,8
10-9; ПРAgCl = 1,56 10-10.
ПР легко вычислить, зная раcтворимость соединения при данной t°. Пример 1 Растворимость CaCO3 равна 0,0069 или 6,9
10-3 г/л. Найти ПРCaCO3.
Решение Выразим растворимость в молях: SCaCO3 = (6,9
· 10-3) / 100,09 = 6,9 • 10-5 моль/л
MCaCO3 Так как каждая молекула CaCO3 дает при растворении по одному иону Ca2+ и CO32-, то [Ca2+] = [ CO32-] = 6,9
10-5 моль/л,
следовательно, ПРCaCO3 = [Ca2+
]
[CO32-] = 6,9 10-5 6,9 10-5 = 4,8 10-9
Зная величину ПР, можно в свою очередь вычислить растворимость вещества в моль/л или г/л. Пример 2 Произведение растворимости ПРPbSO4 = 2,2
10 -8 г/л.
Чему равна растворимость PbSO4? Решение Обозначим растворимость PbSO4 через X моль/л. Перейдя в раствор, X молей PbSO4 дадут X ионов Pb2+ и X ионов SO42-, т.е.: [Pb2+] = [SO42-] = X ПРPbSO4 = [Pb2+] = [SO42-
] = X
X = X2
X = \e(ПРPbSO4) = \e(2,2
10-8) = 1,5 10-4 моль/л.
Чтобы перейти к растворимости, выраженной в г/л, найденную величину умножим на молекулярную массу, после чего получим: 1,5
10-4 303,2 = 4,5 10-2 г/л.
Образование осадков Если [Ag+]
[Cl-] < ПРAgCl - ненасыщенный раствор
[Ag+
]
[Cl-] = ПРAgCl - насыщенный раствор
[Ag+]
[Cl-] > ПРAgCl - перенасыщенный раствор
Осадок образуется в том случае, когда произведение концентраций ионов малорастворимого электролита превысит величину его произведения растворимости при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли. Пример 3 Выпадает ли осадок при смешении равных объемов 0,2 M растворов Pb(NO3)2 и NaCl. ПРPbCl2
= 2,4
10-4.
Решение При смешении объем раствора возрастает вдвое и концетрация каждого из веществ уменьшится вдвое, т.е. станет 0,1 M или 1,0
10-1 моль/л. Таковы же будут концентрации Pb2+ и Cl-. Следовательно, [Pb2+] [Cl-]2 = 1 10-1 (1 10-1)2 = 1 10-3. Полученная величина превышает ПРPbCl2 (2,4 10-4). Поэтому часть соли PbCl2 выпадает в осадок. Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков.
Влияние концентрации растворов Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадок PbCl2 не будет выпадать при смешении равных объемов 0,1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0,1 / 2 = 0,05 M или 5
10-2 моль/л. Ионное произведение [Pb2+] [Cl1-]2 = 5 10-2 (5 10-2)2 = 12,5 10-5. Полученная величина меньше ПРPbCl2, следовательно выпадения осадка не произойдет.
Влияние количества осадителя Для возможно более полного осаждения употребляют избыток осадителя. Например, осаждаем соль BaCO3: BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl. После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР. Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона. Влияние одноименного иона Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПРBaSO4 (1,1
10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Влияние температуры ПР является постоянной величиной при постоянной температуре. С увеличением температуры ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов. Растворение осадков Правило произведения растворимости важно для переведения труднорастворимых осадков в раствор. Предположим, что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3. Это означает, что [Ba2+
]
[CO32-] = ПРBaCO3.
Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты: 2H+ + CO32- ® H2CO3 ® H2O + CO2 Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПРBaCO3. Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3 перейдет в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине ионное произведение малорастворимого электролита становится меньше величины ПР. Для того, чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать малодиссоциированное соединение с одним из ионов труднорастворимого электролита. Этим объясняется растворение труднорастворимых гидроксидов в кислотах Fe(OH)3 + 3HCl ® FeCl3 + 3H2O Ионы OH- связываются в малодиссоциированные молекулы H2O. Таблица. Произведение растворимости (ПР) и растворимость при 25°С некоторых малорастворимых веществ
Формула |
Растворимость |
ПР моль / л |
AgBr |
7,94 • 10-7 |
6,3 • 10-13 |
AgCl |
1,25 • 10-5 |
1,56 • 10-10 |
AgI |
1,23 • 10-8 |
1,5 • 10-16 |
Ag2CrO4 |
1,0 • 10-4 |
4,05 • 10-12 |
BaSO4 |
7,94 • 10-7 |
6,3 • 10-13 |
CaCO3 |
6,9 • 10-5 |
4,8 • 10-9 |
PbCl2 |
1,02 • 10-2 |
1,7 • 10-5 |
PbSO4 |
1,5 • 10-4 |
2,2 • 10-8 |
25 - Гидролиз солей
Общие понятия. Определение: Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах). Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают. Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
Как катион может взаимодействовать с водой? Учитель сам должен решить, рассматривать ли ему этот вопрос в общем виде, или, в менее сильном классе, на конкретном примере. Отмечаем, что катион это положительная частица, а молекула воды полярна, условно можно представить ее состоящей из положительно поляризованного атома водорода и отрицательно поляризованной гидроксильной группы. Какую же часть молекулы воды оторвет и присоединит к себе катион? Ученики с удовольствием отвечают: “гидроксильную группу!” Ответ подтверждаем записью уравнения, отмечая обратимость реакции: |
Главная страница Статьи |
|
Men+ + H-OH MeOH(n-1)+ + H+ Написав формулу образовавшейся частицы, тут же обсуждаем, что это за частица, будет ли она иметь заряд и какой, приходим к выводу, что, как правило, это гидроксокатион. А что останется от молекулы воды? Какую реакцию водного раствора обуславливает избыток этих частиц? Какова будет реакция индикатора? А теперь проверим нашу гипотезу (следует демонстрация опыта). Теперь школьники могут самостоятельно сделать вывод: Гидролиз по катиону приводит к образованию гидроксокатионов и ионов водорода (среда раствора кислая). Отмечаем, что только иногда, при n=1, вместо гидроксокатионов получаем молекулы слабого основания. А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, и что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая, что даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза. Гидролиз по аниону разбираем аналогично, записываем уравнение: Ann– + H-OH HAn(n-1)– + OH– Подводим учеников к выводу: Гидролиз по аниону приводит к образованию гидроанионов и гидроксид-ионов (среда раствора щелочная). Совместный гидролиз. Из самого названия следует, что в этом случае в растворе протекают две выше рассмотренные реакции. Предлагаем школьникам проанализировать их и сделать вывод о реакции среды. Опровергаем (можно экспериментом) представление о том, что среда будет нейтральной. Одинаковое число ионов водорода и гидроксид-ионов только на бумаге. На самом деле здесь протекают две независимые обратимые реакции, и каких ионов в растворе окажется больше, зависит от степени протекания каждой реакции. А это, в свою очередь, зависит от того, что слабее, кислота или основание. Если слабее основание, то в большей степени будет протекать гидролиз по катиону и среда раствора будет кислой. Если слабее основание – наоборот. Как исключение, возможен случай, когда среда будет почти нейтральной, но это только исключение. Одновременно обращаем внимание учащихся на то, что связывание гидроксид-ионов и ионов водорода в воду приводит к уменьшению их концентрации в растворе. Предлагаем вспомнить принцип Ле Шателье и подумать, как это повлияет на равновесие. Подводим их к выводу, что при совместном гидролизе степень его протекания будет значительно выше, и, в отдельных случаях, это может привести к полному гидролизу. Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза, уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно, сколько то растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты. Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3. В таблице растворимости для полностью гидролизующихся солей стоит прочерк. Однако прочерк может стоять по другим причинам: вещество не изучено, разлагается в ходе окислительно-восстановительной реакции, и т.п. Некоторые прочерки в таблице растворимости вызывают удивление. Так. сульфид бария хорошо известен и растворим (как и сульфиды других щелочноземельных металлов). Гидролиз этих солей протекает только по аниону. Алгоритм написания уравнений гидролиза. Когда школьники поняли суть реакции гидролиза, даем (а лучше составляем вместе с ними) алгоритм написания уравнений гидролиза. Рассмотрим его на конкретных примерах. 1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли. Можно дать им “правило цепочки”: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита. Пример 1. Гидролиз сульфата меди(II): CuSO4 = Cu2+ + SO42– Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Гидролиз по катиону. 2. Пишем ионное уравнение гидролиза, определяем среду Cu2+ + H-OH CuOH+ + H+; образуется катион гидроксомеди(II) и ион водорода, среда кислая 3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем: 2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4 Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названия аниона и названия катиона, в данном случае соль назовем сульфат гидроксомеди(II). (Приставка “ди” не нужна, не говорим же мы “сульфат динатрия”). Называть эту соль “гидроксосульфат меди”, на наш взгляд, значит нарушать всю логику номенклатуры солей. Разве есть в растворе, или в узлах кристаллической решетки частица “гидроксосульфат”? Нет! А катион гидроксомеди есть. В дальнейшем этот подход распространяется на номенклатуру комплексных солей. Пример 2. Гидролиз ортофосфата рубидия. 1. Определяем тип гидролиза. Rb3PO4 = 3Rb+ + PO43– Рубидий – щелочной металл, его гидроксид сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов – слабая кислота. Гидролиз по аниону. 2. Пишем ионное уравнение гидролиза, определяем среду PO43– + H-OH HPO42– + OH– Продукты: гидрофосфат-ион и гидроксид-ион среда щелочная. 3. Составляем молекулярное уравнение. Rb3PO4 + H2O Rb2HPO4 + RbOH Получили кислую соль – гидрофосфат рубидия. Пример 3. Ацетат алюминия 1. Определяем тип гидролиза. Al(CH3COO)3 = Al3+ + 3CH3COO– Соль слабого основания и слабой кислоты – совместный гидролиз. 2. Ионные уравнения гидролиза, среда. Al3+ + H-OH AlOH2+ + H+; CH3COO– + H-OH CH3COOH + OH– Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону, следовательно, в растворе будет избыток ионов водорода и среда будет кислая. Не стоит пытаться составлять здесь “суммарное" уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно. 3. Составляем молекулярное уравнение. Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH Тоже как формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия. Факторы, влияющие на степень гидролиза. Поскольку гидролиз обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, практически не влияет давление. Исключается из рассмотрения вода, так как ее концентрация в водных растворах практически постоянна (~55 моль/л). Так для наших примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает. Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода (для примера 1) приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной в примере 2. Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов (пример 2), равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое. Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу придем из рассмотрения константы гидролиза. Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди (пример 1) раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди. Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. Гидролиз в заданиях ЕГЭ по химии. Вопрос А26. (2003г) Фенолфталеин можно использовать для обнаружения в водном растворе соли 1) ацетата алюминия 2) нитрата калия 3) сульфата алюминия 4) силиката натрия Фенолфталеин – индикатор на щелочную среду, в которой он принимает малиновую окраску (возможно, для многих камнем преткновения в этом вопросе стало незнание окрасок индикаторов: фенолфталеина, лакмуса, метилоранжа). В растворе соли щелочная среда может возникнуть при гидролизе по аниону.. Анализируем: 1) ацетат алюминия, рассмотрено выше, совместный гидролиз, среда слабокислая; 2) нитрат калия, кислота и основание сильные, гидролиз не идет, среда нейтральная; 3) сульфат алюминия, сильная кислота и слабое основание, гидролиз по катиону, среда кислая; 4) силикат натрия, слабая кислота и сильное основание, гидролиз по аниону, среда щелочная: SiO32– + H2O HSiO3– + OH – . Правильный ответ: 4. Вопрос A29 (демонстрационный вариант 2005 г) Среда раствора карбоната калия 1) щелочная 2) кислая 3) нейтральная 4) слабокислая Рассматриваем аналогично, Правильный ответ: 1. Вопрос B5. (демонстрационный вариант 2005 г) Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли.
Пример не слишком удачного вопроса. С одной стороны, трудно на него не ответить, исходя из простого сопоставления формул в левой и правой колонке. Про гидролиз можно при этом ничего не знать. С другой стороны, оба ионных уравнений для катиона меди можно считать правильными. Второе уравнение мы бы назвали суммарным для двух стадий гидролиза, и отметили бы, что степень протекания реакции по нему чрезвычайно мала. Только на основе этого мы выберем первое уравнение. Окончательный ответ: ВГАБ Вопрос В3. (2004 г) Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.
Используя установленные выше закономерности, придем к правильному ответу: БААБ С1. (2004 г) Как скажется на состоянии химического равновесия в системе Zn2+ + H2O ZnOH+ + H+ – Q 1) добавление H2SO4 2) добавление KOH 3) нагревание раствора? Ответ обоснуйте. При ответе на этот вопрос надо учитывать, что добавляемые вещества – электролиты. Поставляемые ими ионы могут, как непосредственно влиять на равновесие, так и взаимодействовать с одним из ионов, участвующих в обратимой реакции. 1) добавление H2SO4: H2SO4 =2H+ + SO42– ; повышение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе влево. 2) добавление KOH: KOH= K+ + OH– ; H+ + OH– =H2O; гидроксид-ионы связывают ионы водорода в малодиссоциирующее вещество, воду. Снижение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе вправо. 3) нагревание раствора. По принципу Ле Шателье, повышение температуры приводит к смещению равновесия в сторону протекания эндотермической реакции, т.е. – вправо. Ответ, включающий все три элемента, оценивался в 3 балла. Попробуйте самостоятельно ответить на следующие вопросы: Вопрос А26. (2003 г) Между собой водные растворы сульфата и фосфата натрия можно различить с помощью 1) гидроксида натрия 2) серной кислоты 3) фенолфталеина 4) фосфорной кислоты Вопрос В3. (2003 г). Установите соответствие между названиями солей и средой их растворов.
Вопрос В3. (2004 г) Установите соответствие между формулой соли и способностью этой соли к гидролизу.
Вопрос С1. (2003 г) Сульфид-ион – типичный протолит. Напишите уравнение протолиза (гидролиза) сульфид-иона в водном растворе по первой ступени. Укажите среду этого раствора. Как скажется добавление гидроксида натрия на степень протолиза сульфид-ионов? (3 балла) Подводя итог, отметим, что в рамках школьного курса в реакциях гидролиза солей нет ничего чрезмерно сложного для понимания школьника. Здесь используются общие правила написания ионных уравнений, общие представления о смещении химического равновесия, общий поход к номенклатуре солей, краткий и удобный алгоритм написания уравнений. Хочется надеяться, что изложенный материал поможет вам и вашим ученикам. |
26 – Окислительно-восстановительные реакции. Классификация
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителя или восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO3, H2SO4, HClO4, KMnO4, K2Cr2O7 и др.) или только восстановителями (NH3, H2S, галогеноводороды, Na2S2O3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H2O2, H2SO3 и др.).
Окислительно-восстановительные реакции разделяются на три основных типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К первому типу относятся процессы, в которых атомы элемента-окислителя и элемента-восстановителя входят в состав разных молекул (примеры см. в разделе 6.1).
Внутримолекулярными называются реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. Например, термическое разложение хлората калия по уравнению:
2 KClO3 2 KCl + 3 O2
Реакциями диспропорционирования называют процессы, в которых окислителем и восстановителем является один и тот же элемент в одной и той же степени окисления, которая в реакции одновременно как снижается, так и повышается, например:
3 HClO HClO3 + 2 HCl
Возможны также реакции обратного диспропорционирования. К ним относятся внутримолекулярные процессы, в которых окислителем и восстановителем является один и тот же элемент, но в виде атомов, находящихся в разной степени окисления и выравнивающих ее в результате реакции, например:
NH4NO2 N2 + 2 H2O.
27 - Метод электронного баланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
![]()
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
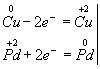
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
![]()
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
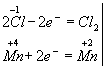
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
![]()
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
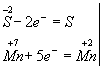
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
28 - Понятие об электродных потенциалах. Уравнение Нернста
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
E=E1-E2
где E - электродвижущая сила (ЭДС); E1 и E2 - потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
|
(1) |
где E0 - стандартный потенциал редокс-системы; R - универсальная газовая постоянная, равная 8,312 Дж/(моль К); T - абсолютная температура, К; F - постоянная Фарадея, равная 96485 Кл/моль; n - число электронов, принимающих участие в электродной реакции; aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы; [ox], [red] - их молярные концентрации; Гox, Гred - коэффициенты активности.
E=E0 при aox = ared = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении.
Подставляя T=298,15 и числовые значения констант в уравнение, получаем для 25 °C
|
(2) |
Однако потенциал отдельного электрода экспериментально определить невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Потенциал водородного электрода принят равным нулю при всех температурах, поэтому потенциал данного электрода - это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электрода.
Конструктивно стандартный водородный электрод представляет собой платинированную платиновую пластинку, омываемую газообразным водородом при давлении 1,013.105 Па (1 атм) и погруженную в раствор кислоты с активностью ионов H+, равной единице. При работе водородного электрода протекает реакция
H2(г) = 2H+ + 2e-
В практической работе вместо хрупкого и нередко капризного водородного электрода применяют специальные, более удобные в работе стабильные электроды сравнения, потенциал которых по отношению к стандартному водородному электроду точно известен.
Уравнение (2) можно переписать
|
(3) |
где
![]()
Величину E0' называют формальным потенциалом. Как видно, формальный потенциал характеризует систему, в которой концентрации (а не активности) всех участников равны 1,0 моль/л. Формальный потенциал включает в себя коэффициенты активности, т.е. зависит от ионной силы раствора. Если коэффициент активности равен 1, то E0'=E0, т.е. формальный потенциал совпадает со стандартным. Точность такого приближения для многих расчетов оказывается достаточной.
Природа возникновения потенциала различна. Можно выделить следующие три основные классы потенциалов, которые не исчерпывают, конечно, всего многообразия. Это:
Электродные потенциалы.
Редокс-потенциалы.
Мембранные потенциалы.
Хотя по термином "электродный потенциал" нередко имеют в виду любой потенциал, независимо от механизма его возникновения, в более узком понимании - это потенциал непосредственно связанный с материалом электрода. Например, цинковый электрод:
Zn2+ + 2e- = Zn
![]()
Активность свободного металла принимается равной единице. Электродные потенциалы отличаются от редокс-потенциалов, для которых материал электрода не имеет значения, так как они химически инертны по отношению ко всем веществам в растворе, и от мембранных, для которых разность потенциалов на мембране измеряется с помощью пары других (в принципе, возможно, одинаковых) электродов.
Потенциометрические методы анализа известны с конца прошлого века, когда Нернст вывел (1889) известное уравнение (1), а Беренд сообщил (1883) о первом потенциометрическом титровании. Интенсивное развитие потенциометрии в последние годы связано, главным образом, с появлением разнообразных типов ионоселективных электродов, позволяющих проводить прямые определения концентрации многих ионов в растворе, и успехами в конструировании и массовом выпуске приборов для потенциометрических измерений.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Методы прямой потенциометрии основаны на прямом применении уравнения Нернста (1) для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титровании точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи точки эквивалентности.
29 - Гальванические элементы
Гальванические элементы, единичные ячейки химических источников тока, предназначенных для однократного электрического разряда (непрерывного или прерывистого). После разряда гальванические элементы, в отличие от аккумуляторов, теряют работоспособность. Иногда термин "гальванические элементы" применяют и для обозначения единичных ячеек аккумуляторных батарей, которые предназначены для многократного использования, то есть после разряда могут быть снова заряжены. Главные составные части гальванические элементы: два электрода различной природы и электролит. Обычно электроды - это металлические пластинки или сетки, на которые нанесены реагенты ("активные вещества"); на отрицательный электрод - восстановитель (Zn, Li и др.), на положительный - окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал (окислительно-восстановительный потенциал данной электродной реакции); разность этих потенциалов в отсутствие тока называют напряжением разомкнутой цепи (НРЦ). При соединении электродов между собой с помощью внешней электрической цепи электроны начинают перетекать от отрицательного электрода к положительному - возникает электрический ток. Суммарная электрохимическая реакция на обоих электродах. называется токообразующей; по мере ее протекания восстановитель отдает, а окислитель присоединяет электроны. Ток прекращается при размыкании внешней цепи, а также после израсходования запаса хотя бы одного из реагентов. Побочные химические или электрохимические реакции приводят к саморазряду гальванические элементы, ограничивающему длительность их хранения, которая для лучших образцов может достигать 10 лет. Гальванические элементы применяют главным образом для питания переносной аппаратуры (например, транзисторных радиоприемников) и поэтому изготавливают преимущественно с невыливающимся электролитом (загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации.
Наиболее распространены марганцево-цинковые элементы (окислитель - МnО2, восстановитель - Zn) с солевым электролитом (р-р NH4Cl и др.) или щелочным (раствор КОН). Для них НРЦ 1,5-1,8 В, удельная энергия 10-80 Вт-ч/кг. Стоимость элементов сравнительно невелика, и их мировое производство достигает 8-10 млрд. штук в год. Элементы со щелочным электролитом дороже, но обладают лучшими характеристиками, особенно при низких температурах и повышенных токах разряда.
Для ртутно-цинковых элементов (окислитель-HgO) со щелочным электролитом НРЦ 1,35 В, удельная энергия до 400 Вт • ч/л. Их изготавливают в виде малогабаритных ("пуговичных") герметичных устройств и применяют для питания радиоприемников, кино- и фотоаппаратуры и т.п.
В воздушно-цинковых элементах окислителем вместо относительно дорогих оксидов металлов служит О2 воздуха, который участвует в реакции на электроде, изготовленном из каталитически активного угля. Специальное отверстие в крышке обеспечивает свободный доступ воздуха к электроду. Отсутствие заложенного запаса окислителя обеспечивает высокие значения удельной энергии - до 250 Вт*ч/кг. Недостатки этих элементов - небольшое значение разрядного тока и сравнительно быстрый саморазряд, что обусловлено взаимодействие щелочного электролита с окружающей атмосферой. В результате электролит высыхает либо взаимодействует с СО2 воздуха (карбонизируется). Поэтому такие элементы пока не получили широкого распространения.
В гальванических элементах с неводными электролитами возможно применение очень активных восстановителей (например, щелочных металлов) и окислителей, которые в водных растворах неустойчивы. При использовании расплавленных или твердых электролитов такие гальванические элементы могут работать при повышенных температурах. В литиевых элементах на основе апротонных растворителей восстановителем служит тонкий лист Li, напрессованный на пластину или сетку из Ni или Си. Окислители - главным образом твердые МnО2 или фторированный графит. Разработаны элементы с растворителями, выполняющими одновременно роль окислителя, - жидким SOCl2 или сжиженным SO2. Toкообразующие реакции приводят к непосредственному восстановлению молекул растворителя под действием Li; детальный механизм разряда окончательно не установлен. Благодаря высокому отрицательному потенциалу Li и его малому расходу литиевые элементы имеют высокие НРЦ (2,5-3,5 В) и удельную энергию (250-600 Вт*ч/кг). Литиевые элементы применяют преимущественно для питания кардиостимуляторов, микрокалькуляторов и других миниустройств.
Разновидность гальванических элементов - резервные элементы, в которых с целью снижения саморазряда электролит разобщен с электродами, или находится в твердом неионопроводящем состоянии. Непосредственно перед использованием таких гальванических элементов электроды приводят в контакт с электролитом или расплавляют электролит. Например, при изготовлении так называемых водоактивируемых гальванических элементов безводную щелочь или соль закладывают в мешочках в межэлектродное пространство; перед эксплуатацией в отверстие в крышке заливают воду, и образуется электролит требуемой концентрации.
30 – Аккумуляторы
31 - Электролиз. Законы Фарадея
Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит — плавленое ионное вещество (например, плавленая соль) или раствор, в котором присутствуют ионы. Электрический ток проходит через электролит от одного электрода к другому. Положительно заряженные ионы при этом движутся к отрицательному электроду, катоду, а отрицательно заряженные — к положительному электроду, аноду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений.
Электролиз — это важный промышленный процесс, используемый как при получении определенных металлов, так и при конечной обработке поверхностей методом нанесения гальванического покрытия. Примером электролиза в действии может быть электролитическое рафинирование меди после ее выделения из руды. Выступающие в качестве катода тонкие листы чистой меди опускают в электролит, содержащий раствор сульфата меди и серную кислоту, а слитки неочищенной меди подвешивают в этом же растворе, и они действуют как анод. При пропускании электрического тока анод начинает растворяться, и ионы меди, вместе с некоторым количеством ионов железа и цинка, поступают в электролит. Остальные спутники меди, содержавшиеся в слитках (включая значительное количество серебра, золота и платины), выпадают в осадок и накапливаются на дне электролитической ванны. Ионы меди через электролит направляются к катоду и осаждаются на нем. Цинк и железо остаются в растворе.
В промышленных масштабах в подобных ваннах за месяц можно очистить всего несколько тонн меди, но при этом получается продукт 99,96-процентной чистоты. Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
В описанном выше процессе рафинирования меди атом меди переходит в электролит в виде иона, теряя два электрона. Следовательно, на аноде он принимает два электрона, и ион снова превращается в нейтральный атом меди (можно представить себе, что эти два электрона бегут по проводу, как электрический ток). Согласно первому закону Фарадея, для того чтобы очистить в два раза больше меди, необходимо в два раза больше электронов.
32 - Свойства металлов
Механические свойства металлов
Большинство деталей машин, обрабатываемых на металлорежущих станках, изготавливается из металлов и их сплавов. Наибольшее распространение имеют чугуны и стали, в меньшей степени - цветные металлы. Для режущих инструментов широко применяются твердые сплавы и абразивные материалы. Обрабатываемость металлов резанием характеризуется их механическими свойствами: твердостью, прочностью, пластичностью. Твердость - способность металла оказывать сопротивление проникновению в него другого, более твердого тела. Наиболее распространены два способа определения твердости: Бринелля и Роквелла. Твердость по Бринеллю устанавливается вдавливанием в испытуемый металл стального закаленного шарика под определенной нагрузкой. Полученную этим способом твердость обозначают буквами HB и определяют делением нагрузки на площадь сферического отпечатка. Прибор Бринелля применяется для определения твердости сырых или слабо закаленных металлов, так как при больших нагрузках шарик деформируется и показания искажаются. Твердость по Роквеллу определяется вдавливанием в подготовленную ровную поверхность алмазного конуса или закаленного шарика. Значение твердости выражается в условных единицах и отсчитывается по черной или красной индикаторным шкалам прибора. Для очень твердых металлов незначительной толщины применяют алмазный конус с нагрузкой 588 Н, а значение твердости определяют по черной шкале и обозначают HRA. Твердость закаленных сталей определяют, вдавливая алмазный конус при нагрузке 1470 Н, по черной шкале и обозначают HRCэ. Испытание твердости шариком с нагрузкой 980 Н на приборе Роквелла предусмотрено для мягких незакаленных металлов. В этом случае отсчет показаний ведут по красной шкале, а твердость обозначают HRB. Прочность - способность металла сопротивляться разрушению под действием внешних сил. Для определения прочности образец металла установленной формы и размера испытывают на наибольшее разрушающее напряжение при растяжении, которое называют пределом прочности (временное сопротивление) и обозначают Σв (сигма). Пластичность - способность металла, не разрушаясь, изменять форму под нагрузкой и сохранять ее после прекращения действия нагрузки. При испытании на растяжение пластичность характеризуется относительным удлинением Δ (дельта), которое соответствует отношению приращения длины образца после разрыва к его первоначальной длине в процентах. Черные металлы Железоуглеродистые сплавы с примесями марганца, кремния, серы, фосфора и некоторых других элементов принято называть черными металлами. В зависимости от содержания углерода они делятся на две группы: чугуны и стали. Чугун - сплав железа с углеродом, содержащий свыше 2,3% углерода (практически от 2,5 до 4,5%). Углерод в нем может находится в химически связанном состоянии в виде карбида железа (цементита) и в свободном состоянии - в виде графита. В соответствии с этим чугуны делятся на белые - передельные и серые - литейные. В белом чугуне почти весь углерод находится в состоянии карбида железа (Fe3C), обладающего высокой твердостью. Такие чугуны имеют мелкозернистое строение с серебристо-белой поверхностью в изломе, высокую твердость, трудно поддаются обработке резанием, плохо заполняют форму и поэтому используются в основном для выплавки сталей. В сером чугуне большая часть углерода находится в свободном состоянии в виде мелких пластинок графита. Последние, разделяя структуру чугуна и действуя как надрезы, значительно уменьшают его прочность и увеличивают его хрупкость. Такие чугуны имеют в изломе серый цвет, обладают хорошими литейными свойствами, почти не дают усадку в отливках и сравнительно легко обрабатываются резанием. Однако, имея в своем составе твердые зерна цементита, серые чугуны значительно ускоряют изнашивание инструмента, что не позволяет обрабатывать их с высокими скоростями резания. Марки серого чугуна обозначаются буквами СЧ и числами, соответствующими его пределу прочности при растяжении в кгс/мм2. В промышленности также применяются отливки из высокопрочных и ковких чугунов. Высокопрочный чугун получают прибавлением к расплавленному чугуну присадок магния и ферросилиция, благодаря чему выделяющийся углерод приобретает шаровидную форму. Такой чугун обладает повышенной прочностью и пластичностью. Его применяют для деталей, работающих при значительных механических нагрузках. В ковком чугуне графит имеет хлопьевидную форму. Этот чугун получают длительным отжигом отливок из белого чугуна. Такие чугуны обладают повышенной прочностью и пластичностью и по своим свойствам занимают промежуточное положение между серым чугуном и сталью. Высокопрочные и ковкие чугуны маркируются буквами и цифрами: ВЧ - высокопрочный чугун, КЧ - ковкий чугун; первые две цифры - предел прочности при растяжении в кгс/мм2 (1кгс/мм2 = 9,608МПа ? 10МПа). Сера и фосфор - вредные примеси. Сера придает хрупкость чугуну, делает его густотекучим и пузырчатым. Фосфор увеличивает хрупкость чугуна, но делает его жидкотекучим. Сталь - это сплав железа с углеродом, содержащий до 1,8% углерода. Стали относятся к пластичным металлам, которым деформированием можно придать необходимую форму. По химическому составу они делятся на углеродистые и легированные; по назначению - на конструкционные, инструментальные, особого назначения (нержавеющие, жаропрочные и др.). Углеродистые конструкционные стали подразделяются на обыкновенного качества, качественные и автоматные. Стали обыкновенного качества обозначаются буквами Ст и цифрами о 0 до 7. Качественные имеют меньше посторонних примесей. Они маркируются цифрами 08, 10, 15, 20 и так далее до 60, указывающие содержание углерода в сотых долях процента. Выпускаются две группы таких сталей: I - с нормальным и II - с повышенным содержанием марганца. Последние в конце маркировки имеют букву Г - марганец. Качественные стали группы II обладают повышенной прочностью и упругостью. Легированные конструкционные стали, кроме обычного состава, содержат хром, ванадий, вольфрам, никель, алюминий и др. Эти элементы придают стали определенные свойства: прочность, твердость, прокаливаемость, износостойкость и т.д. Марки легированных сталей обозначают буквами и цифрами. Первые две цифры указывает среднее содержание углерода в сотых долях процента; затем следуют цифры, обозначающие легирующий элемент; цифры после букв - примерное содержание легирующего элемента в процентах. Если содержание элемента близко к 1%, цифра после буквы не ставится. В маркировке приняты следующие буквенные обозначения элементов: Г - марганец, С - кремний, Х - хром, Н - никель, М - молибден, В - вольфрам, Ф - ванадий, К - кобальт, Ю - алюминий, Т - титан, Д - медь. Буква А в конце марки означает, что сталь высококачественная. Инструментальные стали делятся на углеродистые, легированные и быстрорежущие. Углеродистые инструментальные стали содержат углерода от 0,65 до 1,35%, обладают высокой прочностью, твердостью в закаленном состоянии 63-65 HRCэ и теплостойкостью до 200-250 градусов С. Они делятся на качественные и высококачественные. Последние содержат меньше серы, фосфора и остаточных примесей. Марки этих сталей обозначают буквой У - углеродистая, а цифры после нее указывают среднее содержание углерода в десятых долях процента. У высококачественных сталей в конце маркировки указывается буква А. Углерод существенно влияет на свойства стали. С повышением его содержания твердость, износостойкость и хрупкость стали увеличиваются, но вместе с тем ухудшается его обработка резанием. Легированную инструментальную сталь получают введением в высокоуглеродистую сталь хрома, вольфрама, ванадия и других элементов, которые повышают ее режущие свойства. Благодаря легирующим элементам эта сталь приобретает повышенную вязкость и износостойкость в закаленном состоянии, меньшую склонность к деформациям и трещинам при закалке, более высокую теплостойкость (до 300-350 градусов С) и твердость в состоянии поставки. Легированные инструментальные стали маркируются аналогично конструкционным с той лишь разницей., что первая цифра в начале марки означает содержание углерода в десятых долях процента. Быстрорежущие стали представляют собой легированные инструментальные стали с высоким содержанием вольфрама (до 18%). После термообработки (закалки и многократного отпуска) они приобретают высокую красностойкость до 600 градусов С, твердость 63-66 HRCэ и износостойкость. Быстрорежущие стали маркируются буквами и цифрами. Первая буква Р означает, что сталь быстрорежущая. Цифры после нее указывают среднее содержание вольфрама в процентах. Остальные буквы и цифры означают то же, что и в марках легированных сталей. Быстрорежущие стали, легированные ванадием и кобальтом, имеют повышенные режущие свойства. Они предусмотрены для труднообрабатываемых сталей и сплавов высокой прочности и вязкости. Структура быстрорежущей стали (рисунок слева) - мелкие, твердые, однородно распределенные карбиды и мартенсит, легированный для теплостойкости вольфрамом и (или) молибденом
Примерное назначение и свойства быстрорежущих сталей
Марка стали, прочность, износостойкость, особенности стали |
Назначение |
Р18. Удовлетворительная прочность и повышенная шлифуемость, широкий интервал закалочных температур |
Для всех видов инструментов, особенно подвергаемых значительному шлифованию, при обработке конструкционных материалов прочностью до 1000 МПа |
Р9 Повышенная износостойкость, более узкий интервал оптимальных закалочных температур, повышенная пластичность при горячей пластической деформации. |
Для изготовления инструментов простой формы, не требующих большого объема шлифования, применяемых для обработки конструкционных материалов |
Р6М5 Повышенная прочность, более узкий интервал закалочных температур, повышенная склонность к обезуглероживанию. Шлифуемость удовлетворительная. |
Для всех видов инструментов при обработке конструкционных материалов прочностью до 1000 МПа. |
Р12Ф3 Повышенная износостойкость, удовлетворительная прочность. Шлифуемость пониженная. |
Для чистовых инструментов (резцов, зенкеров, разверток, сверл, протяжек и др.) при обработке на средних режимах резания вязких аустенитных сталей, а также материалов, обладающих повышенными режущими свойствами. |
Р6М5Ф3 Повышенная износостойкость, удовлетворительная прочность. Шлифуемость пониженная. |
Для чистовых и получистовых инструментов (фасонных резцов, разверток, фрез, протяжек и др.). Предназначенных для работы на средних скоростях резания, преимущественно обрабатывающих углеродистые и легированные инструментальные стали. |
Р9К5, Р6М5К5, Р18К5Ф2 Повышенная вторичная твердость, теплостойкость, удовлетворительная прочность и вязкость. Шлифуемость пониженная. |
Для изготовления черновых и получистовых инструментов (фрез, долбяков, метчиков, сверл и т.п.), предназначенных для обработки углеродистых и легированных конструкционных сталей на повышенных режимах резания, а также некоторых труднообрабатываемых материалов |
Цветные металлы
Из цветных металлов наибольшее промышленное применение получили медь, алюминий и сплавы на их основе. Медь - мягкий пластичный металл розовато-красного цвета, обладающий высокой электропроводностью, теплопроводностью, коррозийной стойкостью. В отожженном состоянии она характеризуется пределом прочности при растяжении Σв= 19,6 - 23,6 МПа. Твердостью по Бринеллю 35 -45 НВ. Медные сплавы - латуни и бронзы по сравнению с медью более дешевы, имеют лучшие литейные свойства, большую прочность и хорошо обрабатываются резанием. Кроме свойств, присущих меди, они обладают способностью прирабатываться и противостоять изнашиванию. Это важное эксплуатационное качество - антифрикционность - обусловливает широкое применение медных сплавов, особенно бронз, в деталях машин, работающих в условиях повышенного трения (червячные колеса, гайки винтовых передач, вкладыши подшипников скольжения и др.). Латунь - медноцинковый сплав. Различают простые латуни, состоящие из меди и цинка, и специальные - содержащие дополнительно легирующие элементы, которые улучшают механические свойства латуни. Маркировка латуней: первая буква Л указывает на название сплава - латунь. Следующая за ней цифра обозначает среднее содержание меди в процентах. Специальные латуни маркируются дополнительно буквами, обозначающими легирующие элементы: А - алюминий, Мц - марганец, К - кремний, С - свинец, О - олово, Н - никель, Ж - железо. Первые две цифры, стоящие за буквами, указывают среднее содержание меди в процентах, последующие цифры - содержание других элементов; остальное в сплаве цинк. Буква Л - в конце марки указывает, что латунь литейная. Например, марка ЛАЖ60-1-1 - специальная, алюминиево-железистая латунь содержит 60% меди, 1% - алюминия, 1% - железа, остальное цинк. Бронза - сплав меди с оловом, марганцем, алюминием, фосфором, никелем и другими элементами. В зависимости от состава бронзы делятся на оловянистые и специальные (безоловянисые). Маркировка бронз основана на том же принципе, что и латуней. Впереди стоят буквы Бр - бронза, далее следуют буквенные обозначения элементов, входящих в состав сплава, и за ними - цифры, указывающие среднее содержание этих элементов в процентах. Алюминий - мягкий пластичный металл серебристо-белого цвета, отличается высокой электропроводностью, коррозийной стойкостью, малой плотностью и хорошо обрабатывается давлением. В отожженном состоянии алюминий обладает малой прочностью Σв=78,5 - 118 МПа и твердостью 15-25 НВ. Алюминиевые сплавы, имея положительные качества алюминия, обладают, кроме того, повышенной прочностью и лучшими технологическими свойствами. Благодаря малой плотности их принято называть легкими сплавами. В зависимости от состава и технологических свойств алюминиевые сплавы делятся на деформируемые и литейные. Их марки обозначаются буквами и цифрами. Так, например, деформируемые сплавы на основе алюминий - медь - магний (дюралюминий) маркируются буквой Д; алюминий - марганец : АМц, алюминий - магний: АМг; сплавы для поковок и штамповок - АК; литейные сплавы АЛ. Цифры после букв соответствуют порядковому номеру сплава. Лучшими литейными сплавами являются сплавы на основе алюминий - кремний, называемые силуминами.
Твердые сплавы
Твердые сплавы выпускаются в виде пластинок различных форм и размеров, получаемых методом порошковой металлургии (прессованием и спеканием). Основой для них служат порошки твердых зерен карбидов тугоплавких металлов (вольфрама, титана, тантала), сцементированных кобальтом. Промышленностью выпускаются три группы твердых сплавов: вольфрамовые - ВК, титановольфрамовые - ТК и титанотанталовольфрамовые - ТТК. В обозначении марок сплавов используются буквы: В - карбид вольфрама, К - кобальт, первая буква Т - карбид титана, вторая буква Т - карбид тантала. Цифры после букв указывают примерное содержание компонентов в процентах. Остальное в сплаве (до 100%) - карбид вольфрама. Буквы в конце марки означают: В - крупнозернистую структуру, М - мелкозернистую, ОМ - особомелкозернистую. Характерными признаками, определяющими режущие свойства твердых сплавов, являются высокая твердость, износостойкость и красностойкость до 1000 градусов С. Вместе с тем эти сплавы обладают меньшей вязкостью и теплопроводностью по сравнению с быстрорежущей сталью, что следует учитывать при их эксплуатации. При выборе твердых сплавов необходимо руководствоваться следующими рекомендациями. Вольфрамовые сплавы (ВК) по сравнению с титановольфрамовыми (ТК) обладают при резании меньшей температурой свариваемости со сталью, поэтому их применяют преимущественно для обработки чугуна, цветных металлов и неметаллических материалов. Сплавы группы ТК предназначены для обработки сталей. Титанотанталовольфрамовые сплавы (ТТК), обладая повышенной прочностью и вязкостью, применяются для обработки стальных поковок, отливок при неблагоприятных условиях работы. Для тонкого и чистового точения с малым сечением стружки следует выбирать сплавы с меньшим количеством кобальта и мелкозернистой структурой. Черновая и чистовая обработки при непрерывном резании выполняются в основном сплавами со средним содержанием кобальта. При тяжелых условиях резания и черновой обработке с ударной нагрузкой следует применять сплавы с большим содержанием кобальта и крупнозернистой структурой.
Основные марки вольфрамосодержащих твердых сплавов и области их применения
Применяемость по системе ISO |
Цвет маркировки |
Марка сплава |
Области применения |
|||
Группа |
Подгруппа |
|
Без покрытия |
С покрытием |
Обрабатываемый материал |
Рекомендуемое назначение |
Р |
01 |
Синий |
Т30К4 |
- |
Сталь и стальное литье |
Чистовое точение, развертывание, фрезерование с малым сечением среза |
|
10 |
Синий |
Т14К6 |
- |
То же |
Получерновое (непрерывное), чистовое (прерывистое) точение или фрезерование |
|
20 |
Синий |
Т14К8 |
- |
То же |
Черновое (непрерывное), получерновое (прерывистое) точение или фрезерование, черновое зенкерование |
|
25 |
Синий |
МС137 |
МС1460 |
Сталь и стальное литье, нержавеюща сталь |
Черновое (прерывистое) точение и фрезерование, в том числе прерывистых поверхностей, работы по корке |
|
30 |
Синий |
Т5К10, МС131 |
МС2210 |
То же |
То же |
|
40 |
Синий |
МС146 |
- |
Сталь и стальное литье |
Обработка в тяжелых условиях, в том числе по корке, при неравномерном сечении среза |
М |
20 |
Желтый |
МС221 |
МС2210 |
Стали аустенитного класса, жаропрочные, титановые стали и сплавы |
Черновая и получерновая обработка |
|
30 |
Желтый |
ВК10-ОМ |
- |
Высокопрочные чугуны |
То же |
K |
10 |
Красный |
ВК6-ОМ, МС313 |
МС3210 |
Серый чугун, закаленная сталь, отбеленный чугун |
Чистовая и получистовая обработка |
|
20 |
Красный |
МС318, ВК6МС321 |
- |
Серый чугун, цветные металлы и сплавы |
Черновое и получерновое точение, получистовое фрезерование |
|
30 |
Красный |
ВК8, ВК8М |
- |
То же |
Черновое точение и фрезерование, сверление, зенкерование, нарезание резьбы |
Минералокерамические материалы
В целях экономии дорогостоящих и редких материалов, входящих в состав твердых сплавов, создан минералокерамический материал - микролит марки ЦМ332 на основе корунда (оксида алюминия - Al2O3) в виде пластинок белого цвета. Микролит превосходит твердые сплавы по твердости и красностойкости (1300 градусов С), уступая им значительно по вязкости. Поэтому его применяют в основном для получистового и чистового точения при жесткой технологической системе и безударной нагрузке. Так же разработаны более прочные керамические материалы, в частности марки В3, в виде многогранных неперетачиваемых пластинок черного цвета, содержащих, кроме корунда, карбиды тугоплавких металлов. Как показывает практика, такие пластины успешно конкурируют с твердым сплавом при чистовой обработке сталей и высокопрочных чугунов. Сверхтвердые инструментальные материалы. Природные (А) и синтетические (АС) алмазы представляют собой кристаллическую модификацию чистого углерода. Они обладают самой большой из всех известных в природе материалов твердостью (по последним данным получены материалы, способные обрабатывать алмаз в твердых сечениях), теплостойкостью до 850 градусов С, низким коэффициентом трения и высокой теплопроводностью. Вместе с тем алмазы характеризуются хрупкостью и интенсивностью изнашивания при резании черных металлов. Последнее свойство объясняется диффузией углерода алмаза в железе при высокой температуре. Вследствие этого область применения алмазных резцов практически ограничивается тонким точением пластмасс и цветных металлов. Для обработки резанием цветных металлов создан новый синтетический материал - кубический нитрид бора (КНБ). Такие материалы выпускаются с размерами заготовок 4-8 мм под общим названием композиты трех марок: композит 01 (эльбор Р), композит 05 и композит 10 (гексанит Р). Обладая химической инертностью к углероду и железосодержащим материалам, композиты по твердости приближаются к алмазу, но примерно вдвое превосходят его по теплостойкости (1600 градусов С). Поэтому они способны резать не только сырые, но и закаленные до высокой твердости стали.
Основные характеристики и области применения безвольфрамовых твердых сплавов
Марка |
Основа |
Плотность, г/см3 |
Твердость HRA |
Области применения |
TH20 |
TiC |
5,5-6,0 |
90,0 |
Чистовая и получистовая обработка низколегитрованных и углеродистых сталей, цветных металлов и сплавов на основе меди, чугунов, никелевых сплавов, полиэтилена; области применения групп P01 - P10 при системе ISO |
KHT16, ЛЦК29 |
TiCN |
5,5-6,0 |
89,0 |
Получистовая и получерновая обработка тех же материалов; области применения групп P01 - P10 при системе ISO |
Основные характеристики и области применения пластин из минералокерамики
Марка |
Состав |
Плотность, г/см3 |
Твердость |
Предел прочности при изгибе Σи МПА |
Области применения |
ЦМ-322 |
Al2O3 |
3,96 - 3,98 |
До 2300 HV |
350-400 |
Чистовая и получистовая обработка закаленных (30-50 HRCэ) сталей, чугунов, цветных металлов и сплавов на основе меди. Работа без удара |
В3 |
Al2O3+TiC |
4,5 - 4,7 |
93 HRA |
650 |
То же |
ВОК60, ВОК71 |
Al2O3+TiC |
4,2 - 4,3 |
94 HRA |
650 |
Чистовая и получистовая обработка закаленных (45-60 HRCэ) сталей, чугунов с малыми сечениями среза |
Кортнинг |
Al2O3+TiN |
4,2 |
93 HRA |
750 |
Получистовая и чистовая обработка чугунов, в том числе в условиях прерывистого резания, обработка жаростойких никелевых сплавов |
Основные характеристики и области применения сверхтвердых синтетических материалов
Марка |
Состав |
Твердость |
Области применения |
Эльбор "Р" (композит 01) |
BN |
До 8000 HV |
Чистовая обработка закаленных (40-63 HRCэ), сталей, чугунов |
Гексанит, композит 10, композит 10Д |
BN |
6000 HV |
Чистовая обработка закаленных (40-68 HRCэ), сталей, чугунов, твердых сплавов |
Композит 05 |
BN+Al2O3 |
4500 HV |
Получистовая обработка чугунов, в том числе отбеленных, и других материалов, дающих стружку надлома |
Силинит |
Si3N4+Al2O3+добавки |
До 96 HRA |
Получистовая, чистовая обработка нержавеющих сталей, подкаленных сталей, чугунов |
33 - Способы получения чистых металлов и сплавов
материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов, из которых хотя бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других элементов. Самый распространенный способ получения сплавов - затвердевание однородной смеси их расплавленных компонентов. Существуют и другие методы производства - например, порошковая металлургия. В принципе, четкую границу между металлами и сплавами трудно провести, так как даже в самых чистых металлах имеются "следовые" примеси других элементов. Однако обычно под металлическими сплавами понимают материалы, получаемые целенаправленно добавлением к основному металлу других компонентов. Почти все металлы, имеющие промышленное значение, используются в виде сплавов (см. табл. 1, 2). Так, например, все выплавляемое железо почти целиком идет на изготовление обычных и легированных сталей, а также чугунов. Дело в том, что сплавлением с некоторыми компонентами можно существенно улучшить свойства многих металлов. Если для чистого алюминия предел текучести составляет всего лишь 35 МПа, то для алюминия, содержащего 1,6% меди, 2,5% магния и 5,6% цинка, он может превышать 500 МПа. Аналогичным образом могут быть улучшены электрические, магнитные и термические свойства. Эти улучшения определяются структурой сплава - распределением и структурой его кристаллов и типом связей между атомами в кристаллах. См. также МЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ; ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ. Многие металлы, скажем магний, выпускают высокочистыми, чтобы можно было точно знать состав изготавливаемых из него сплавов. Число металлических сплавов, применяемых в наши дни, очень велико и непрерывно растет. Их принято разделять на две большие категории: сплавы на основе железа и сплавы цветных металлов. Ниже перечисляются наиболее важные сплавы промышленного значения и указываются основные области их применения. Сталь. Сплавы железа с углеродом, содержащие его до 2%, называются сталями. В состав легированных сталей входят и другие элементы - хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно было бы перечислить. Малоуглеродистая сталь (менее 0,25% углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55%) идет на изготовление таких низкоскоростных режущих инструментов, как бритвенные лезвия и сверла. Легированные стали находят применение в машиностроении всех видов и в производстве быстрорежущих инструментов. См. также СТАНКИ МЕТАЛЛОРЕЖУЩИЕ. Чугун. Чугуном называется сплав железа с 2-4% углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей. В правильно выполненных отливках достигаются хорошие механические свойства материала. См. также МЕТАЛЛЫ ЧЕРНЫЕ. Сплавы на основе меди. В основном это латуни, т.е. медные сплавы, содержащие от 5 до 45% цинка. Латунь с содержанием от 5 до 20% цинка называется красной (томпаком), а с содержанием 20-36% Zn - желтой (альфа-латунью). Латуни применяются в производстве различных мелких деталей, где требуются хорошая обрабатываемость и формуемость. Сплавы меди с оловом, кремнием, алюминием или бериллием называются бронзами. Например, сплав меди с кремнием носит название кремнистой бронзы. Фосфористая бронза (медь с 5% олова и следовыми количествами фосфора) обладает высокой прочностью и применяется для изготовления пружин и мембран. Свинцовые сплавы. Обычный припой (третник) представляет собой сплав примерно одной части свинца с двумя частями олова. Он широко применяется для соединения (пайки) трубопроводов и электропроводов. Из сурьмяно-свинцовых сплавов делают оболочки телефонных кабелей и пластины аккумуляторов. Сплавы свинца с кадмием, оловом и висмутом могут иметь точку плавления, лежащую значительно ниже точки кипения воды (СПЛАВЫ70° C); из них делают плавкие пробки клапанов спринклерных систем противопожарного водоснабжения. Пьютер, из которого ранее отливали столовые приборы (вилки, ножи, тарелки), содержит 85-90% олова (остальное - свинец). Подшипниковые сплавы на основе свинца, называемые баббитами, обычно содержат олово, сурьму и мышьяк. Легкие сплавы. Современная промышленность нуждается в легких сплавах высокой прочности, обладающих хорошими высокотемпературными механическими свойствами. Основными металлами легких сплавов служат алюминий, магний, титан и бериллий. Однако сплавы на основе алюминия и магния не могут применяться в условиях высокой температуры и в агрессивных средах. Алюминиевые сплавы. К ним относятся литейные сплавы (Al - Si), сплавы для литья под давлением (Al - Mg) и самозакаливающиеся сплавы повышенной прочности (Al - Cu). Алюминиевые сплавы экономичны, легкодоступны, прочны при низких температурах и легко обрабатываемы (они легко куются, штампуются, пригодны для глубокой вытяжки, волочения, экструдирования, литья, хорошо свариваются и обрабатываются на металлорежущих станках). К сожалению, механические свойства всех алюминиевых сплавов начинают заметно ухудшаться при температурах выше приблизительно 175° С. Но благодаря образованию защитной оксидной пленки они проявляют хорошую коррозионную стойкость в большинстве обычных агрессивных сред. Эти сплавы хорошо проводят электричество и тепло, обладают высокой отражательной способностью, немагнитны, безвредны в контакте с пищевыми продуктами (поскольку продукты коррозии бесцветны, не имеют вкуса и нетоксичны), взрывобезопасны (поскольку не дают искр) и хорошо поглощают ударные нагрузки. Благодаря такому сочетанию свойств алюминиевые сплавы служат хорошими материалами для легких поршней, применяются в вагоно-, автомобиле- и самолетостроении, в пищевой промышленности, в качестве архитектурно-отделочных материалов, в производстве осветительных отражателей, технологических и бытовых кабелепроводов, при прокладке высоковольтных линий электропередачи. Примесь железа, от которой трудно избавиться, повышает прочность алюминия при высоких температурах, но снижает коррозионную стойкость и пластичность при комнатной температуре. Кобальт, хром и марганец ослабляют охрупчивающее действие железа и повышают коррозионную стойкость. При добавлении лития к алюминию повышаются модуль упругости и прочность, что делает такой сплав весьма привлекательным для авиакосмической промышленности. К сожалению, при своем превосходном отношении предела прочности к массе (удельной прочности) сплавы алюминия с литием обладают низкой пластичностью. Магниевые сплавы. Магниевые сплавы легки, характеризуются высокой удельной прочностью, а также хорошими литейными свойствами и превосходно обрабатываются резанием. Поэтому они применяются для изготовления деталей ракет и авиационных двигателей, корпусов для автомобильной оснастки, колес, бензобаков, портативных столов и т.п. Некоторые магниевые сплавы, обладающие высоким коэффициентом вязкостного демпфирования, идут на изготовление движущихся частей машин и элементов конструкции, работающих в условиях нежелательных вибраций. Магниевые сплавы довольно мягки, плохо сопротивляются износу и не очень пластичны. Они легко формуются при повышенных температурах, пригодны для электродуговой, газовой и контактной сварки, а также могут соединяться пайкой (твердым), болтами, заклепками и клеями. Такие сплавы не отличаются особой коррозионной стойкостью по отношению к большинству кислот, пресной и соленой воде, но стабильны на воздухе. От коррозии их обычно защищают поверхностным покрытием - хромовым травлением, дихроматной обработкой, анодированием. Магниевым сплавам можно также придать блестящую поверхность либо плакировать медью, никелем и хромом, нанеся предварительно покрытие погружением в расплавленный цинк. Анодирование магниевых сплавов повышает их поверхностную твердость и стойкость к истиранию. Магний - металл химически активный, а потому необходимо принимать меры, предотвращающие возгорание стружки и свариваемых деталей из магниевых сплавов. См. также СВАРКА. Титановые сплавы. Титановые сплавы превосходят как алюминиевые, так и магниевые в отношении предела прочности и модуля упругости. Их плотность больше, чем всех других легких сплавов, но по удельной прочности они уступают только бериллиевым. При достаточно низком содержании углерода, кислорода и азота они довольно пластичны. Электрическая проводимость и коэффициент теплопроводности титановых сплавов малы, они стойки к износу и истиранию, а их усталостная прочность гораздо выше, чем у магниевых сплавов. Предел ползучести некоторых титановых сплавов при умеренных напряжениях (порядка 90 МПа) остается удовлетворительным примерно до 600° C, что значительно выше температуры, допустимой как для алюминиевых, так и для магниевых сплавов. Титановые сплавы достаточно стойки к действию гидроксидов, растворов солей, азотной и некоторых других активных кислот, но не очень стойки к действию галогеноводородных, серной и ортофосфорной кислот. Титановые сплавы ковки до температур около 1150° C. Они допускают электродуговую сварку в атмосфере инертного газа (аргона или гелия), точечную и роликовую (шовную) сварку. Обработке резанием они не очень поддаются (схватывание режущего инструмента). Плавка титановых сплавов должна производиться в вакууме или контролируемой атмосфере во избежание загрязнения примесями кислорода или азота, вызывающими их охрупчивание. Титановые сплавы применяются в авиационной и космической промышленности для изготовления деталей, работающих при повышенных температурах (150-430° C), а также в некоторых химических аппаратах специального назначения. Из титанованадиевых сплавов изготавливается легкая броня для кабин боевых самолетов. Титаналюминиевованадиевый сплав - основной титановый сплав для реактивных двигателей и корпусов летательных аппаратов. В табл. 3 приведены характеристики специальных сплавов, а в табл. 4 представлены основные элементы, добавляемые к алюминию, магнию и титану, с указанием получаемых при этом свойств. Бериллиевые сплавы. Пластичный бериллиевый сплав можно получить, например, вкрапляя хрупкие зерна бериллия в мягкую пластичную матрицу, такую, как серебро. Сплав этого состава удалось холодной прокаткой довести до толщины, составляющей 17% первоначальной. Бериллий превосходит все известные металлы по удельной прочности. В сочетании с низкой плотностью это делает бериллий пригодным для устройств систем наведения ракет. Модуль упругости бериллия больше, чем у стали, и бериллиевые бронзы применяются для изготовления пружин и электрических контактов. Чистый бериллий используется как замедлитель и отражатель нейтронов в ядерных реакторах. Благодаря образованию защитных оксидных слоев он устойчив на воздухе при высоких температурах. Главная трудность, связанная с бериллием, - его токсичность. Он может вызывать серьезные заболевания органов дыхания и дерматит.
34 - Коррозия металлов
КОРРОЗИЯ
МЕТАЛЛОВ
(от позднелат. corrosio - разъедание), физ.-хим.
взаимодействие металлич. материала и
среды, приводящее к ухудшению эксплуатац.
св-в материала, среды или техн. системы,
частями к-рой они являются. В основе
коррозии металлов
лежит хим. р-ция между материалом и
средой или между их компонентами,
протекающая на границе раздела фаз.
Чаще всего это - окисление
металла,
напр.
3Fe+2О2=Fe3O4;
Fe+H2SO4=FeSO4+Н2
По стехиометрии
такие р-ции довольно просты, но по
механизму они относятся к наиб. сложным
гетерог. р-циям. Иногда при коррозии
металлов
происходит и восстановление
нек-рых компонентов материала; напр.,
при высоких давлениях
и т-рах карбиды
восстанавливаются в стали проникающим
водородом.
К коррозии металлов
нередко относят также нек-рые случаи
их растворения
в жидких металлах
(напр., растворение
сталей в жидкометаллич. теплоносителях
ядерных реакторов). Коррозия металлов
- самопроизвольный процесс, сопровождающийся
уменьшением энергии
Гиббса
системы конструкц. материал - среда. Для
р-ций коррозии металлов
изменения энергии
Гиббса
по порядку величины таковы же, как и для
самопроизвольно протекающих хим. р-ций.
Термодинамич. нестабильность системы
конструкц. металл
- среда является причиной широкой
распространенности коррозии металлов
во всех отраслях техники. Нормальная
эксплуатация оборудования, коммуникаций,
транспортных средств и т.п. часто возможна
лишь при достаточном замедлении коррозии
металлов,
достигаемом при помощи многообразных
способов и средств защиты
от коррозии.
Изменением состава материала или среды
или созданием особых условий можно
добиться того, что коррозия металлов
самотормозится из-за образования
поверхностных защитных слоев (см.
Пассивность
металлов,
Ингибиторы
коррозии,
Коррозионностойкие
материалы).
На нек-рых металлах
(Al, Ti и др.) защитные слои в ряде сред
образуются и без спец. мер. Несмотря на
успехи в борьбе с коррозией металлов,
ее проблемы обостряются из-за непрерывного
роста металлич. фонда и ужесточения
условий эксплуатации металлов.
Это связано с использованием
высокоагрессивных сред (хим. пром-сть,
ядерная и геотермальная области
энергетики,
разработка шельфа и др.), повышением
рабочих т-р, давления
и скоростей потоков, загрязнением
атмосферы
SO, и др. примесями и т.п. Новые конструкц.
материалы нередко подвергаются
малоизученным и трудно прогнозируемым
коррозионным разрушениям. Повышаются
экологич. требования к средствам и
технологиям защиты
от коррозии;
становится менее доступным сырье для
произ-ва ряда коpрозионностойких
материалов. В итоге возрастают как
безвозвратные потери металла,
стоимость к-рых входит в прямые убытки
от коррозии металлов,
так и затраты на защиту
от коррозии.
Однако наиб. велики косвенные убытки
от коррозии металлов,
связанные с простоями и снижением
фондоотдачи, потерями и ухудшением
качества продукции, авариями и т. п. В
сумме косвенные и прямые убытки от
коррозии металлов
и затраты на защиту [в соотношении
примерно (3-4):1:1] в промышленно развитых
странах достигают 4% национального
дохода и более.
Механизм
коррозии металлов
определяется
прежде всего типом агрессивной среды.
В сухих окислит. газах
при повыш. т-рах на пов-сти большинства
конструкц. металлов
образуется слой твердых продуктов
коррозии (окалина). При условии сплошности
этого слоя скорость коррозии металлов
чаще всего лимитируется диффузией
через него ионов
металла
к границе слой - газ
или окислителя
(напр., О2-)
к границе слой-металл (подробнее см.
Газовая
коррозия).
Иной механизм имеет очень распространенная
коррозия металлов
в электролитич. средах - р-рах электролитов
(в т.ч. в виде тонких
пленок
на пов-сти металла),
пропитанных электролитами
пористых и капиллярно-пористых телах
(почвы, бетоны,
нек-рые изоляц. материалы, рыхлые
отложения и др.), а также в расплавах
электролитов.
В таких средах суммарный процесс коррозии
металлов
можно записать в виде р-ции:
М+Ох=Мz++Red,
(1)
где М - металл.
Ох - частица окислителя.
Red - его восстановл. форма (Ох имеет заряд
+ze или Red - заряд -zе); здесь для упрощения
принято равенство всех стехиометрич.
коэффициентов. В преобладающем большинстве
случаев р-ция (1) протекает по т. наз.
электрохим. механизму: атом
М и частица Ох непосредственно не
контактируют, передача электронов
от М к Ох происходит через зону проводимости
М (рис. 1,а). Т. обр., процесс (1) фактически
состоит из двух р-ций: анодного
растворения металла
и катодного восстановления
окислителя:
М=Mz++ze,
(la) Ох+ze = Red. (16)
Скорость каждой из
р-ций м. б. определена соответствующим
кинетич. ур-нием (см. Электрохимическая
кинетика)
и в этом смысле они полностью независимы,
но при совместном протекании р-ции
связаны условием электронейтральности
системы. В нек-рых случаях возможно
влияние продуктов одной р-ции на скорость
другой.
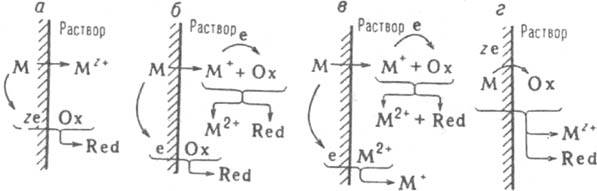 Рис.
1. Механизмы коррозии металлов:
электрохимический (а); электрохимическо-химический
(6); каталитический (в); предполагаемый
химический (г). Для механизмов "6"
и "в" принято зарядовое
число
z=2.
Рис.
1. Механизмы коррозии металлов:
электрохимический (а); электрохимическо-химический
(6); каталитический (в); предполагаемый
химический (г). Для механизмов "6"
и "в" принято зарядовое
число
z=2.
В
электролитич. среде с высокой электрич.
проводимостью (
металлич. пов-сть можно рассматривать
как эквипотенциальную, т.е. имеющую
одинаковый во всех точках электродный
потенциал
Е. Последний при стационарном протекании
электрохим. коррозии металлов
принимает, как правило, определенное
значение Eкор,
при к-ром одинаковы скорости анодной и
катодной р-ций, обычно выражаемые в
единицах плотности тока и обозначаемые
ia
и iк
соответственно. Потенциал Eкoр
наз. потенциалом коррозии или стационарным
потенциалом; соответствующая ему
величина плотности тока
ia=iк=iкор
(2)
наз. скоростью или током коррозии.
Коррозия металлов
всегда необратимый процесс, поэтому
значение Eкор
не м. б. определено на основании
термодинамич. соотношений и вычисляется
только из кинетич. ур-ний р-ций (1а) и
(16). В общем случае значения ia
и iк
зависят от потенциала E экспоненциально;
эти зависимости в упрощенной записи
имеют вид:
iа=kаехр(2,303Е/ba),
(За) iк=kкcOxeхр(-2,З0ЗЕ/bк),
(3б)
где cOx
- концентрация
окислителя
Ох; ka
и kк -
эмпирич. постоянные при данной т-ре,
к-рые, однако, могут зависеть от состава
среды (kк
не зависит от с0х);
ba
и bк -
постоянные Тафеля (см. Тафеля
уравнение)
для анодной и катодной р-ций соответственно.
В координатах E-lgi зависимости (За) и (36)
изображаются прямыми линиями (рис. 2,
А). точке пересечения к-рых отвечают
величины Екор
и iкор.
При этом из (За) и (36) следует:
![]()
 Рис.
2. Зависимость скорости i анодного
растворения металла
(l a) и катодного восстановления
окислителя
(1б) от электродного
потенциала
Е при элсюрохпм механизме коррозии. А
- катодный процесс протекает в истино
кинeтч. режиме. Б в режиме предельного
диффузионного
тока.
iкор
и Eкор
значения тока и потенциала коррозии
соотв.. iд
- предельный диффузионный
ток.
Рис.
2. Зависимость скорости i анодного
растворения металла
(l a) и катодного восстановления
окислителя
(1б) от электродного
потенциала
Е при элсюрохпм механизме коррозии. А
- катодный процесс протекает в истино
кинeтч. режиме. Б в режиме предельного
диффузионного
тока.
iкор
и Eкор
значения тока и потенциала коррозии
соотв.. iд
- предельный диффузионный
ток.
Ур-ния (За) и (36) отражают, в частности, кинетику типичной для неокислит. кислых сред электрохим. коррозии металлов с восстановлением. Н+ - ионов; в водных р-рах р-ция (16) имеет вид: 2Н3О++2е=Н2+2Н2О. Если для анодной р-ции выполняется ур-ние (За), а скорость катодной р-ции полностью определяется диффузионным подводом Ох к пов-сти М, то величина iк максимальна в режиме предельного диффузионного тока iд (рис. 2, Б); в этом случае ik=iд=iкор и Eкop=balg(iдka-1). (5) Соотношение (5) характерно для распространенной в нейтральных и нек-рых др. средах электрохим. коррозии с восстановлением растворенного кислорода, в водных р-рах р-ция (16) имеет вид: О2+2Н2О+4е=4ОН-. В большинстве случаев распределение на пов-сти металла точек мгновенного протекания р-ций (1а) и (1б) изменяется во времени статистически беспорядочно; соотв. средняя по времени скорость анодной р-ции (а значит. и скорость коррозии металлов) в любой точке пов-сти одинакова и совпадает со скоростью катодной р-ции (равномерная или сплошная коррозия металлов). Гетерогенность металла или среды, разл. условия подвода окислителя или отвода продуктов коррозии, не нарушая эквипотенциальноети пов-сти (при высоких значениях (), могут приводить к возникновению на ней участков устойчивого предпочтительного протекания одной из р-ций - (1а) или (16), в соответствии с локальными значениями kа и ba, kк, bк и сOх (или iд). Для таких участков уже не выполняется равенство (2), т. с. iaik, а в предельном случае на одних участках со скоростью iа протекает практически только анодная р-ция, на других, со скоростью iк, - только катодная. Требование электронейтральности системы приводит к условию: iaSa=iкSк, где S. и Sк - суммарные площади "анодных" и "катодных" участков соответственно. Чем больше значения iк и Sк/Sa, тем интенсивнее локальное растворение металла на анодных участках (в отсутствие пассивации). При возрастании такой предпочтит. локализации, как правило, возрастает опасность локальных коррозионных разрушений, к-рая в реальных условиях чаще всего превосходит опасность для системы равномерной коррозии металлов. Причины описанной локальной коррозии металлов многообразны: различия в составе зерна металла в объеме и на границе, концентрациях мех. напряжений, микровключения, разная природа контактирующих металлов, диффузионная неравнодоступность участков пов-сти и др. Участки пов-сти металла, на к-рых наблюдаются повыш. значения iа, м. б. макро- или микроскопическими. Первые наблюдаются обычно при контактной коррозии в месте соед. разнородных металлов, при щелевой коррозии (внутрищелевая пов-сть - анод, открытая - катод), на поздних стадиях питтинговой коррозии (питтинги в виде крупных язв); вторые - при межкристаллитной коррозии и на ранних стадиях питтинговой коррозии. Рост коррозионных трещин (см. Коррозия под напряжением) в ряде случаев объясняют тем, что анодный процесс локализуется в вершине (острие) трещин. В электролитич. среде с малой электрич. проводимостью ( за счет неоднородности металла или среды протяженная металлич. пов-сть м. б. неэквипотенциальной, т. е. для такой пов-сти характерно не одно значение Eкор, а нек-рое распределение потенциала. За исключением простейших по своей геометрии систем, теоретич. построение распределений потенциала и токов iа и iк при постоянстве ( требует решения дифференц. ур-ния Лапласа с разл. краевыми условиями. Однако кинетич. закономерности электрохим. коррозии металлов и для такой пов-сти остаются справедливыми. Искомые распределения потенциала м. б. найдены указанным способом лишь при известных для каждого участка пов-сти значениях kа и bа, kк, bк и сOх (или iд). Осн. электрохим. механизм коррозии металлов, выражаемый ур-ниями (1а) и (16), может иметь варианты. Р-ция (1а) при z/2 может протекать через одноэлектронные стадии, напр. при z=2: М=М++е, (6а) М+=М2++е. (6б) Катион промежут. валентности М+ в нск-рых случаях настолько устойчив, что может вступать в хим. р-цию 2М++Ох=2М2++Red (7) прежде, чем успевает произойти его электрохим. анодное доокисление по р-ции (6б). Если при этом одновременно протекает р-ция (16), реализуется т. наз. электрохимическо-хим. механизм, при к-ром коррозия металлов обусловлена электрохим. р-циями (6а) и (6б) и хим. р-цией (7) (рис. 1,6). Если на металлич. пов-сти вместо окислителя Ох, к-рый из-за р-ции (7) не достигает ее, восстанавливаются катионы М2+(М2++е=М+, рис. 1,в), осуществляется т. наз. каталитич. механизм коррозии металлов, при к-ром М+ играет роль катализатора р-ции (1). Эти варианты электрохим. механизма возможны в водных средах, но м. б. наиболее существенными при коррозии металлов в орг. средах. Для таких сред, обычно характеризующихся малыми значениями (, ранее считалось обязательным протекание коррозии металлов по т. наз. хим. механизму, когда передача всех z электронов от М к Ох происходит непосредственно, в одном элементарном акте (рис. 1, г). В действительности же для электрохим. коррозии металлов объемная величина х не имеет принципиального значения, по этому механизму протекает коррозия металлов во многих малоэлектропроводных орг. средах; возможность хим. механизма сейчас допускают лишь для р-ров на основе неполярных р-рителей. В то же время в электропроводных водных р-рах (кислых и слабокислых) для ряда металлов при электродных потенциалах более отрицательных, чем Eкор (а при повыш. т-рах - и вблизи Eкор), скорость растворения не зависит от Е (участок MN на кривой а, рис. 2), причем этот эксперим. факт не м. б. объяснен диффузионными ограничениями. Одной из возможных причин его существования считают протекание р-ции (1) по хим. механизму. Классификация коррозии металлов определяется конкретными особенностями среды и условиями протекания процесса (подводом окислителя, агрегатным состоянием и отводом продуктов коррозии, возможностью пассивации металла и др.). Обычно выделяют коррозию металлов в природных средах - атмосферную коррозию, морскую коррозию, подземную коррозию, биокоррозию; нередко особо рассматривают коррозию металлов в пресных водах (речных и озерных), гсотeрмальных, пластовых, шахтных и др. Еще более многообразны виды коррозии металлов в техн. средах; различают коррозию металлов в к-тах (неокислительных и окислительных), щелочах, орг. средах (напр., смазочноохлаждающих жидкостях, маслах, пищ. продуктах и др.), бетоне, расплавах солей, оборотных и сточных водах и др. По условиям протекания наряду с контактной и щелевой коррозией металлов выделяют коррозию по ватерлинии, коррозию в зонах обрызгивания, переменного смачивания, конденсации кислых паров; радиационную коррозию металлов, коррозию при теплопередаче, коррозию блуждающими токами и др. Особую группу образуют коррозионномех. разрушения, в к-рую входят помимо коррозионного растрескивания и коррозионной усталости фреттинг - коррозия, водородное охрупчивание, эрозионная коррозия (в пульпах и суспензиях с истирающими твердыми частицами), кавитационная коррозия (при одноврем. воздействии агрессивной среды и кавитации). В общем случае воздействие агрессивной среды и мех. факторов на разрушение неаддитивно. Напр., при эрозионной коррозии металлов потери металла вследствие разрушения защитной пленки м. 6. намного больше суммы потерь от эрозии и коррозии металлов по отдельности. Часто коррозию металлов классифицируют также по отдельным металлам и их группам, по конкретным отраслям, произ-вам и объектам. Коррозией часто наз. также происходящие при взаимод. со средами процессы разрушения неметаллич. материалов - полупроводников, бетона, полимеров, стеклопластиков и др. Представления о коррозии металлов, коррозионностойких материалах и защите от коррозии, коррозионных испытаниях, проводимых при разработках и выборе материалов и ср-в защиты, выделяются в самостоят, научно-техн. дисциплину - химическое сопротивление материалов
35 - Способы защиты металлов от коррозии

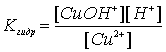 и
и