
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
Вопрос № 2
Характеристика элементарных ядерных частиц. Изотопы, изобары, изотоны.
Долгое время в науке господствовало мнения, что атомы неделимы, т. е. не содержат более простых составных частей. Считалось также, что атомы неизменны: атом данного элемента ни при каких условиях не может превращаться в атом какого-либо другого элемента.
Однако в конце XIX века был установлен ряд фактов, свидетельствующих о сложном составе атомов и о возможности их взаимопревращений. Сюда относится, прежде всего, открытие электрона английским физиком Дж. Томсоном в 1897 г.
Электрон – элементарная частица,
обладающая наименьшим существующим в
природе отрицательным электрическим
зарядом(1,602
 Кл).
Масса электрона равна
Кл).
Масса электрона равна
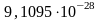 г.,
т.е. почти в 200 раз меньше массы атома
водорода. Было установлено, что электроны
могут быть выделены из любого элемента:
так, они служат переносчиками тока в
металлах, обнаруживаются в пламени,
испускаются многими веществами при
нагревании, освещении или рентгеновском
облучении. Отсюда следует, что электроны
содержатся в атомах всех элементов. Но
электроны заряжены отрицательно, а
атомы не обладают электрическим зарядом,
они электронейтральны. Следовательно,
в атомах, кроме электронов, должны
содержаться какие-то другие, положительно
заряженные частицы. Иначе говоря, атомы
представляют собой сложные образования,
построенные из более мелких структурных
единиц.
г.,
т.е. почти в 200 раз меньше массы атома
водорода. Было установлено, что электроны
могут быть выделены из любого элемента:
так, они служат переносчиками тока в
металлах, обнаруживаются в пламени,
испускаются многими веществами при
нагревании, освещении или рентгеновском
облучении. Отсюда следует, что электроны
содержатся в атомах всех элементов. Но
электроны заряжены отрицательно, а
атомы не обладают электрическим зарядом,
они электронейтральны. Следовательно,
в атомах, кроме электронов, должны
содержаться какие-то другие, положительно
заряженные частицы. Иначе говоря, атомы
представляют собой сложные образования,
построенные из более мелких структурных
единиц.
Большую роль в установлении сложной природы атома и расшифровке его структуры сыграло открытии и изучение радиоактивности.
Атом – электрононейтронная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Ядра атомов всех элементов, кроме водорода, состоят из протонов и нейтронов эти частицы называется НУКЛОНЫ.
А=z+N (N-число нейтронов, z-число протонов (порядковый номер) А – атомная масса, N=A-z).
Протон - устойчивая частица с положительным элементарным зарядом.
Электрон - наименьшая по массе устойчивая частица, имеющая отрицательный элементарный заряд.
В основе атомно – молекулярного учения лежит принцип дискретности вещества: всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц. Различие между веществами обусловлено различием между их частицами; частицы одного вещества одинаковы, частицы различных веществ различны. При всех условиях частицы вещества находятся в движении; чем выше температура тела, тем интенсивнее это движение.
Для большинства веществ частицы представляют собой молекулы. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы в свою очередь состоят из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Уже из опытов Резерфорда следовало, что
заряд ядра численно равен порядковом
номеру элемента в периодической системе.
Это было подтверждено Г. Мозли, установившем
в 1913 г. простую связь между длинами волн
определённых линий рентгеновского
спектра и его порядковым номером, и Д.
Чедвиком, с большой точнотью определившим
в 1920 г. заряды атомных ядер ряда элементов
по рассеиванию
 -
частиц.
-
частиц.
Был установлен физический смысл порядкового номера элемента в периодической системе: порядковый номер оказался важнейшей константой элемента, выражающей положительный заряд ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента.
В 1911г. Резерфорд открыл в ядре протон (
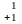 р)
р)
В 1932г. Чедвик открыл нейтрон (
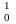 n).
n).
В 1933 была сформулирована протонно-нейтронная теория состава ядра (Гейзенберг, Иваненко): ядра атомов всех элементов, кроме водорода, состоят из протонов и нейтронов эти частицы протоны и нейтроны называются вместе НУКЛОНЫ.
А=z+N (N-число нейтронов, z-число протонов (порядковый номер) А – атомная масса, N=A-z).
Например, аммиак:
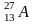 А=27
А=27
Z=13( р)
A-Z=N=14( n)
Наличия в ядрах атомов нейтронов объясняет существование изотопов.
Изотопы - это атомы одного и того же элемента, имеющие одинаковое зарядное число, но разную атомную массу.
H2O 0,017%
Протий дейтерий тритий
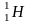
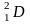

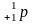 1 1 1
1 1 1
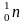 0 1 2
0 1 2
75,4 % 24,3%
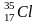
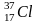
17 17 A(Cl)=35,453 а.е.м.
18 20
Дробное значение атомных масс в таблице Менделеева - это среднеарифметическое значение из атомных масс всех изотопов данного элемента. С учетом распространения изотопов в природе.
Изобары - это разновидность атомов различных элементов имеющих различное зарядовое число, но одинаковую атомную массу.

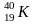
 18 19
18 19
20 21 40
Изотонны – атомы различных элементов, имеющих одинаковое число нейтронов.
A(Cl)=35 *0,754+37*0,245=35,453 а.е.м.

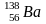
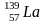
54 56 57
82 82 82
