- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Исследования изохорного процесса идеальных газов.
Изменение
состояния рабочего тела при постоянном
объеме называется изохорным процессом.
Напишем уравнение состояния для 1 кг
газа. p1v=RT1-для
начального состояния, p2v=RT2–для
конечного состояния. Разделив почленно
и учитывая v =const
получим
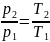 В изохорном процессе давление газа
прямо пропорционально температуре.
Изменение внутренней энергии
∆u=u2-u1=cv(T2-T1).
Внешняя работа при изохорном процессе
не совершается, т.к. v=const,
dv=0. => l=0.
В изохорном процессе давление газа
прямо пропорционально температуре.
Изменение внутренней энергии
∆u=u2-u1=cv(T2-T1).
Внешняя работа при изохорном процессе
не совершается, т.к. v=const,
dv=0. => l=0.
Тепло участвующее в процессе определяют по формуле q= ∆u= cv(T2-T1). Все подведенное тепло в изохорном процессе расходуется на изменение внутренней энергии газа. Коэффициент α=1, т.к. q= ∆u.
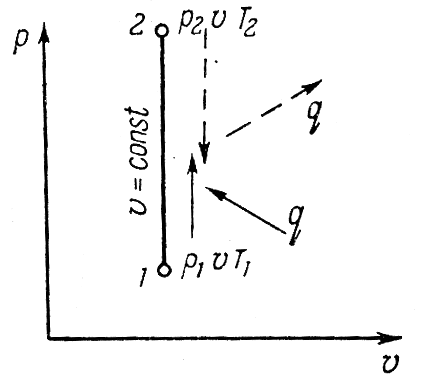
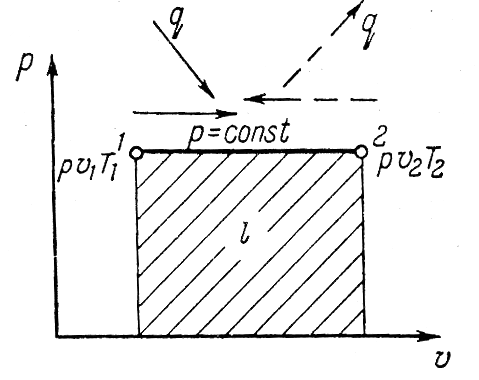
Исследование изобарного процесса идеальных газов.
Изменения
состояния рабочего тела при постоянном
давлении называется изобарным процессом.
Напишем уравнение состояния для 1 кг
газа. p1v=RT1-для
начального состояния, p2v=RT2–для
конечного состояния. Разделив почленно
и учитывая p =const
получим
 В изобарном процессе объемы газа прямо
пропорциональны температуре. Изменение
внутренней энергии ∆u=u2-u1=cv(T2-T1).
Внешняя работа
В изобарном процессе объемы газа прямо
пропорциональны температуре. Изменение
внутренней энергии ∆u=u2-u1=cv(T2-T1).
Внешняя работа
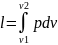 ,
т.к. p=const,
то
,
т.к. p=const,
то
 или l=R(T2-T1).
Если принять что температура увеличивается
на 1К, то l=R.,
Из этого следует, что газовая постоянная
R численно равна работе
расширения 1кг газа при нагреве его в
изобарном процессе на 1К.
или l=R(T2-T1).
Если принять что температура увеличивается
на 1К, то l=R.,
Из этого следует, что газовая постоянная
R численно равна работе
расширения 1кг газа при нагреве его в
изобарном процессе на 1К.
Тепло участвующее в процессе определяют
по формуле q=
cp(T2-T1).
Уравнение первого закона термодинамики
для этого процесса примет вид q=∆u
+l=
u2-u1+p(v2-v1)
или q=(u2+pv2)-(u1+pv1)
Т.к. u+pv=i
то q=i2-i1.
Все подведенное тепло в изобарном
процессе расходуется на увеличение его
энтальпии. Коэффициент
 , принимая, что для двухатомных газов
k=1.4, α=5/7. =>
5/7 теплоты идет на увеличение внутренней
энергии газа, 2/7 на совершение работы
, принимая, что для двухатомных газов
k=1.4, α=5/7. =>
5/7 теплоты идет на увеличение внутренней
энергии газа, 2/7 на совершение работы
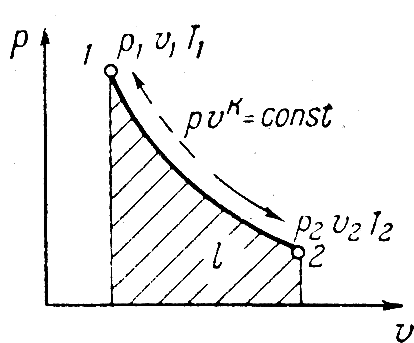
Исследование адиабатного процесса идеальных газов
Процесс
изменения состояния рабочего тела,
протекающий при отсутствии теплообмена
между газом и внешней средой, называется
адиабатным процессом. Пользуясь дифф.
уравнением П.З.Т., учитывая dq=0
уравнение процесса можно представить
в виде dq=du+dl=0.
Подставив du=сVdT,
dl=pdv =>
cVdT+pdv=0.
Т.к. сV=R/(k-1)
получим
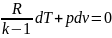 .
Продифференцировав уравнение идеального
газа pv=RT
получим pdv+vdp=RdT/
.
Продифференцировав уравнение идеального
газа pv=RT
получим pdv+vdp=RdT/
Подставляя
получим vdp+kpdv=0.
Разделим на pv получим
 .
Интегрируя и полагая k=cons.
Получим ln p
+klnv=const =>
pvk=const.
Адиабатный процесс в pv
отображается кривой. Т.к. k>1
адиабата круче изотермы и падение
давления происходит быстрее. Соотношения
между p,v,T^:
.
Интегрируя и полагая k=cons.
Получим ln p
+klnv=const =>
pvk=const.
Адиабатный процесс в pv
отображается кривой. Т.к. k>1
адиабата круче изотермы и падение
давления происходит быстрее. Соотношения
между p,v,T^:

Изменение внутренней энергии ∆u=сV(T2-T1). Работа может быть определена из q=∆u+l=0, т.к. q=0 =>
l=–∆u=–
сV(T2-T1)=
сV(T1-T2)=
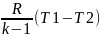 .
.
Видно, что при адиабатном расширении газа положительная работа происходит за счет уменьшения внутренней энергии газа. При адиабатном сжатии газа вся работа идет на увеличение внутренней энергии.
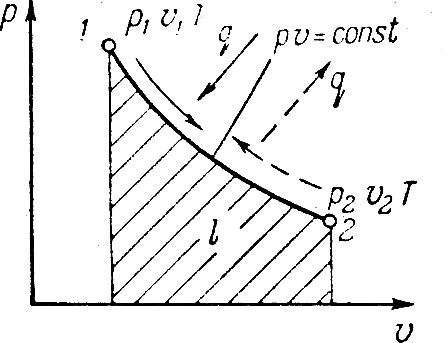
Исследования изотермического процесса идеальных газов.
Процесс,
протекающий при постоянной температуре
называют изотермическим. Уравнение
изотермического процесса pv=const.
На графике обозначается кривой
представляющей равнобокую гиперболу.
Связь между параметрами в начале и конце
процесса получается из уравнения
 В изотермическом процессе объемы газа
обратно пропорциональны давлениям
газа, а изменение внутренней энергии
равно нулю. Внешнюю работу в этом процессе
определяют
,
т.к. p=RT/v.
В изотермическом процессе объемы газа
обратно пропорциональны давлениям
газа, а изменение внутренней энергии
равно нулю. Внешнюю работу в этом процессе
определяют
,
т.к. p=RT/v.
 .
.
Теплоту,
затраченную на совершение процесса,
определяют из уравнения

В иотермическом
процессе при
 коэффициент α=
коэффициент α=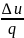 =0.
=0.
Теплота подводимая к га зу в изотермическом процессе расширения расходуется на внешнюю работу.