
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Основные законы идеальных газов. Уравнения состояния идеальных газов.
Идеальный газ – газ, у которого отсутствуют силы взаимодействия между молекулами, а молекулы рассматривают как лишенные объема, хотя они являются материальными частицами. Понятие идеальный газ упрощает термодинамические исследования и обеспечивает при низких давлениях и высоких температурах приемлемую точность практических результатов.
Основные газовые законы:
АВОГАДРО- в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Открыт в 1811 году итал. физиком А.Авогадро(1776-1856).
БОЙЛЯ-МАРИОТТА - для данной массы данного газа при постоянной температуре произведение давления на объем есть величина постоянная. Формула: pV=const. Описывает изотермический процесс. Графическая зависимость – изотерма.
ГЕЙ-ЛЮССАКА
для данной массы данного газа при
постоянном давлении отношение объема
к абсолютной температуре есть величина
постоянная
 ,где =1/273 К-1 - температурный
коэффициент объемного расширения.
Графическая зависимость – изобара.
,где =1/273 К-1 - температурный
коэффициент объемного расширения.
Графическая зависимость – изобара.
ДАЛЬТОНА - давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
ШАРЛЯ - давление данной массы идеального газа при постоянном объеме прямо пропорционально температуре: p = p0(1+gt), где р0 - давление газа при температуре t = 273,15 К.
Величина g называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов = 1/273 °С–1. Графическая зависимость – изохора.
ДАЛЬТОНА - давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
Уравнение состояния – уравнение, выражающее связь между параметрами равновесного состояния термодинамической системы.
Для любого идеального газа произведение давления на объем, деленное на абсолютную температуру газа, есть величина постоянная. Уравнение Клапейрона, называется уравнением состояния. pv=RT. R[Дж/кг*К] –справедливо для 1 кг массы. Для произвольного количества массы газа умножить обе части на m, тогда удельный объем станет полным.В технической термодинамике чаще применяется уравнение для одного моля.
Моль – количество вещества, масса которого, выраженная в килограммах, численно равна молекулярной массе.
 .
Если примем
.
Если примем
 ,
получим уравнение для 1 моля газа.
Уравнение Менделеева–Клапейрона.
,
получим уравнение для 1 моля газа.
Уравнение Менделеева–Клапейрона.
 .
Универсальная газовая постоянная
.
Универсальная газовая постоянная
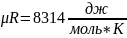 ,
откуда значение удельной газовой
постоянной для 1 кг любого газа
,
откуда значение удельной газовой
постоянной для 1 кг любого газа

Газовые смеси
Продукты сгорания топлива, атмосферный воздух и другие газы в теплотехнике не однородны по своему составу. Они являются смесями химически не связанных между собой газов.
Закон ДАЛЬТОНА -давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов. pсм=p1+p2+…+pi
Парциальное давление – давление, которое имел бы газ, входящий в состав газовой смеси, если бы один занимал объем, равный объему смеси, при той же температуре.
Состав газовой смеси может быть задан массовыми долями– это отношение массы данного компонента к массе всей смеси.. Следовательно массовая доля может быть определена долей килограмма данного компонента, содержащейся в 1 кг смеси. gi=Gi/GСМ
Объемными долями смеси называют отношения объемов отдельных газов, взятых при одинаковых давлениях и температурах к объему всей смеси при тех же условиях. ri=Vi/Vсм , Vi–приведенный объем газов в смеси.
Приведенный объем– объем отдельного газа, если его давление и температура равны давлению и температуре смеси. Приведенный объем вычисляется по формуле Vi=(pi/pсм )Vсм. Объем смеси равен сумме приведенных объемов. А сумма объемных долей равна 1.
Газовая смесь подчиняется уравнению состояния так же, как и отдельный газ => pсмVсм=GсмRсмTсм
Где Rсм – удельная газовая постоянная смеси. Rсм=g1R1+g2R2+…+giRi. Так же её можно определить через среднюю, или кажущуюся, молекулярную массу смеси. Rсм=8314/μсм
Средняя молек.масса–отношение массы всей смеси к общему числу её молей. Если смесь задана объемными долями, то μсм= μ1r1+ μ2r2+… (μ1молекулярная масса газов составляющих смесь)
В некоторых случаях состав смеси удобнее определять посредством мольных долей. Мольной долей компонента в смеси называется отношение количества молей рассматриваемого компонента к общему количеству молей смеси. Мольной долей компонента можно назвать долю молю данного компонента в одном моле смеси.
