
- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
3. Равновесие на границе раствор-электрод. Электрохимические цепи.
Активные металлы растворяются в воде даже при присутствии там ионов этих металлов. Неактивные металлы будут растворяться в воде, только если в ней не присутствуют ионы этих металлов, если же они присутствуют, но потенциалопределяющим будет процесс адсорбции ионов на поверхности металла.
Таким образом, активные Ме всегда приобретают отрицательный потенциал, а неактивные могут приобретать как отрицательный, так и положительный потенциал. Растворение металлов происходит под действием полярных молекул воды, а растворенные в воде соли лишь препятствуют процессу растворения Ме.
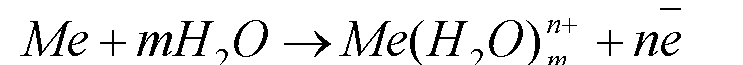
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются у отрицательно заряженной поверхности электрода. На границе «раствор-электрод» возникает двойной электрический слой. Соответственно между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом. Наряду с реакцией окисления идет реакция восстановления ионов Ме:
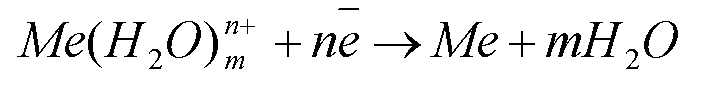
При некотором значении электродного потенциала устанавливается равновесие на границе «раствор-электрод»
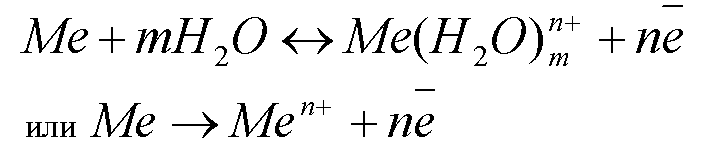
Равновесие имеет динамический характер. Процессы идут при равновесии с одинаковой скоростью в прямом и обратном направлениях. Установившийся потенциал называют равновесным электродным потенциалом.
*Электрохимической цепью называют совокупность последовательно соединенных проводников с ионной проводимостью (проводники 2-ого рода) и проводников с электронной проводимостью (1-ого рода) Пример электрохимической цепи:
![]()
4. Водородный электрод. Электродные реакции. Электродный потенциал.
*Водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в раствор, содержащий ионы водорода
В качестве классического электрода сравнения используется водородный электрод. При стандартных условиях (T=298K, P=101кПа, [H2SO4=1моль/л] потенциал водородного электрода принято считать равным 0. Следовательно, измерив ЭДС элемента, одним из электродов которого является водородный электрод, можно рассчитать стандартный электродный потенциал другого электрода.
![]()
На электроде происходит реакция окисления металла, которую можно условно записать
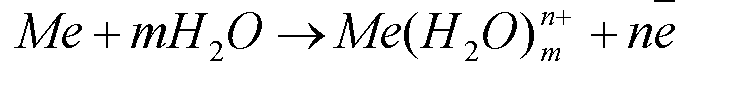
На границе «раствор-электрод» возникает двойной электрический слой. Соответственно между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом. Наряду с реакцией окисления идет и обратная реакция восстановления.
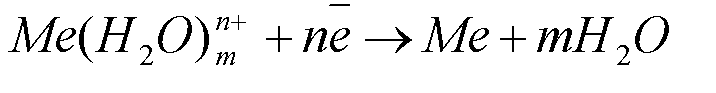
При некотором значении электродного потенциала устанавливается равновесие на границе «раствор-электрод»
![]()
Или в упрощенном виде
![]()
Установившийся потенциал называют равновесным электродным потенциалом.
*Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Измерение потенциалов
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
