
- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
1. Электролитическая диссоциация.
Сильные и слабые электролиты. Степень и константа диссоциации. Закон разведения Освальда.
*Растворы электролитов – растворы веществ, проводящие электрический ток. Обладают ионной проводимостью. Как правило – это растворы солей, кислот и оснований.
*Электрическая диссоциация – процесс распада вещества на ионы при растворении.
*Все электролиты делятся на слабые и сильные. Сильные электролиты характеризуются высокой степенью диссоциации.
Степень диссоциации:
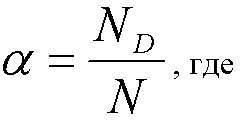
ND – число диссоциированных молекул
N – общее число растворенных молекул.
Для сильных электролитов α→1 Для слабых электролитов α<<1
К сильным электролитам относятся сильные кислоты (серная, соляная, азотная [H2SO4, HCl, HNO3]) и большая часть солей. К слабым электролитам относятся слабые кислоты, слабые основания и некоторые соли [H2SO3,H2S,CH3COOH].
Константа равновесия
в общем случае:
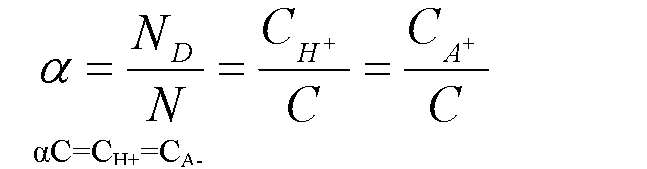
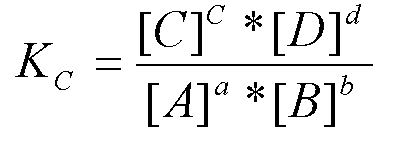
Для процесса диссоциации константа равновесия называется константой диссоциации и равна
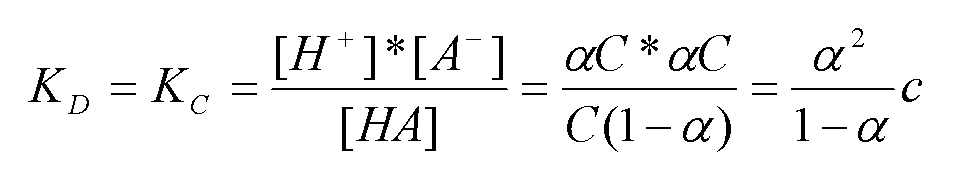
Это выражение называют законом разведения Освальда. Из него видно, что KD зависит от концентрации. Иногда вместо концентрации используют обратное значение – разведение. v=1/c
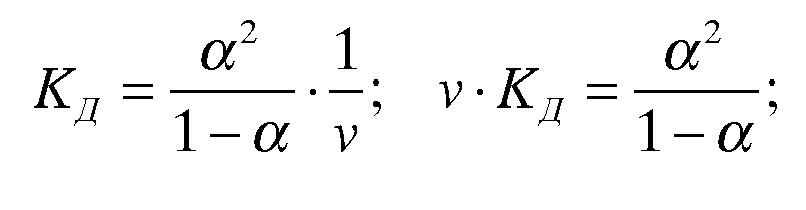
2. Электролитическая диссоциация воды. Ионное произведение воды.
Водородный показатель pH.
В незначительной степени, но всегда в чистой воде протекают такая реакция:
H2O↔H++OH-
эта реакция называется реакцией автопротолиза воды. Ион водорода H+ сразу же присоединяется к молекуле воды и образует ион гидроксония H++H2O->H3O+. Для простоты говорят о присоединении в воде ионов H+.
В воде всегда присутствуют ионы H+.
константа диссоциации может быть вычислена по формуле
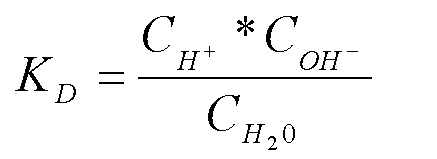
Зная, что масса моля воды – 18г, а масса одного литра воды – 1000г, найдем молярную концентрацию воды:
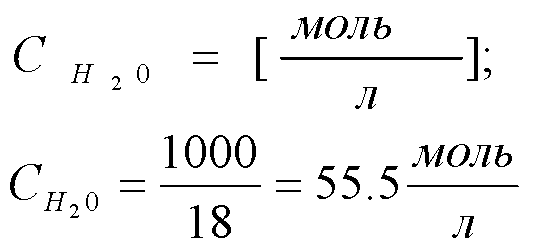
тогда
![]()
- ионное произведение воды.
При температуре Т=298К ионное произведение воды КВ=1,008-14. В чистой воде
![]() ,
если же среда не нейтральная, то
,
если же среда не нейтральная, то
![]() ,
но
,
но
![]() выполняется ВСЕГДА!!!
выполняется ВСЕГДА!!!
*Активность. а=γС . Коэффициент активности γ - поправка, которая вводится для того, чтобы законы, верные для идеальных растворов были верными для реальных. Коэффициент зависит от концентрации. При С→1 γ→1 и тогда
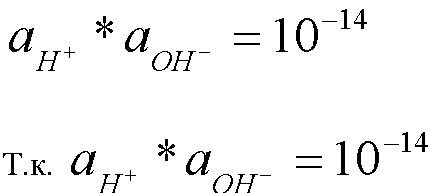 -всегда
-всегда
Однозначность этой связи позволяет для определения кислотности или щелочности можно использовать величину, которую называют - водородным показателем pH=-lg(aH+)
*Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов совпадает с концентрацией) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
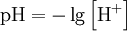
pH>7 – щелочная среда
pH<7 – кислая среда
pH=7 – нейтральная среда
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
