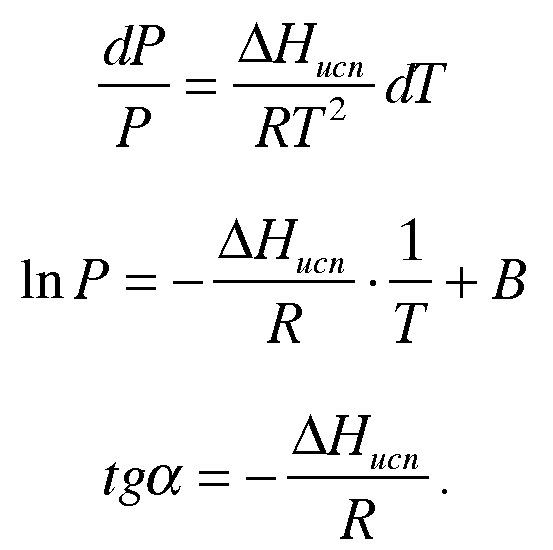- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
ФАЗОВОЕ РАВНОВЕСИЕ, сосуществование термодинамические равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства т-ры всех частей системы (термич. равновесие), равенства давления во всем объеме системы (мех. равновесие) и равенство хим. потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n = 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 - f (см. Фаз правило).[Равновесие процесса перехода в-ва из одной фазы в другую без изменения хим. состава – фаз. равновесие]
В общем виде условие Ф. р., согласно принципу равновесия Гиббса, сводится к максимуму энтропии S системы при постоянстве внутр. энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамич. потенциалов: внутр. энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента. Ф.р. могут быть стабильными и метастабильными.
Твердое
кристаллическое тело![]() Жидкость; В
этом
случае изменения объема и
Жидкость; В
этом
случае изменения объема и
энтальпии: |
По уравнению Клапейрона-Клаузиуса:
|
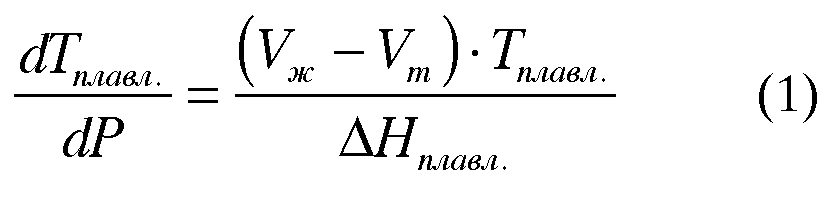
Как правило, объем жидкости превышает объем твердого тела:
![]()
В
выражении
(1)
![]() -
величина большая, поэтому
-
величина большая, поэтому
 ,
но величина малая.
,
но величина малая.
Для каждого вещества существует свой барический коэффициент температуры плавления.
Например, для бензола ΔT/ΔP=0.00285 K/атм. Это значит, что если твердый бензол сжать до давления в 1000 атм., то температура плавления изменится на 2,85 К.
25. Фазовое равновесие: жидкость — пар.
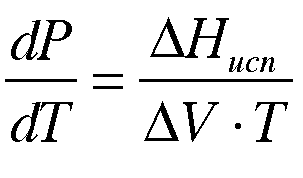 -
уравнение Клайперона-Клаузиуса.
-
уравнение Клайперона-Клаузиуса.
Соответственно
![]() неизвестны
для химической термодинамики, известно
лишь изменение
энтальпии
неизвестны
для химической термодинамики, известно
лишь изменение
энтальпии
![]() Определим
зависимость давления насыщенного пара
от температуры
Определим
зависимость давления насыщенного пара
от температуры![]() .
Примем три допущения для решения
уравнения
Клаузиуса-Клапейрона:
.
Примем три допущения для решения
уравнения
Клаузиуса-Клапейрона:
![]() Это легко показать: 1 моль
Это легко показать: 1 моль
![]() весит
18 г, а занимает
объем V
=
22,4л.
2) В
узком
температурном интервале тепловой эффект
испарения ΔНисп
не
зависит от температуры. 3)
Считаем пар идеальным газом, для 1 моля
которого выполняется закон
Менделеева-Клапейрона
весит
18 г, а занимает
объем V
=
22,4л.
2) В
узком
температурном интервале тепловой эффект
испарения ΔНисп
не
зависит от температуры. 3)
Считаем пар идеальным газом, для 1 моля
которого выполняется закон
Менделеева-Клапейрона
![]() Тогда,
учитывая допущения, уравнение
Клаузиуса-Клайперона примет
вид:
Тогда,
учитывая допущения, уравнение
Клаузиуса-Клайперона примет
вид:
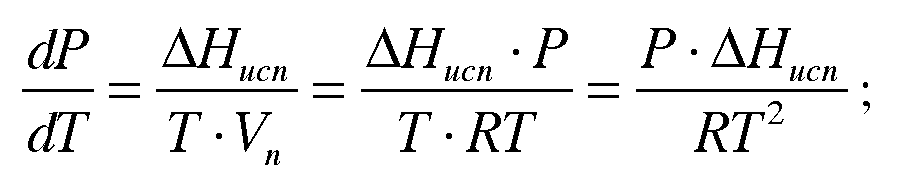
разделим переменные:
|
рисунок 2
Давление насыщенного пара над жидкостью не зависит от количества жидкости и определяется только температурой. Значения давления насыщенного пара для различных жидкостей сведены в таблицы. Кипение - это процесс парообразования (испарения) по всему объему жидкости, а не только с ее поверхности. Кипение имеет место, когда P н.п = Р внеш. (рис 1)
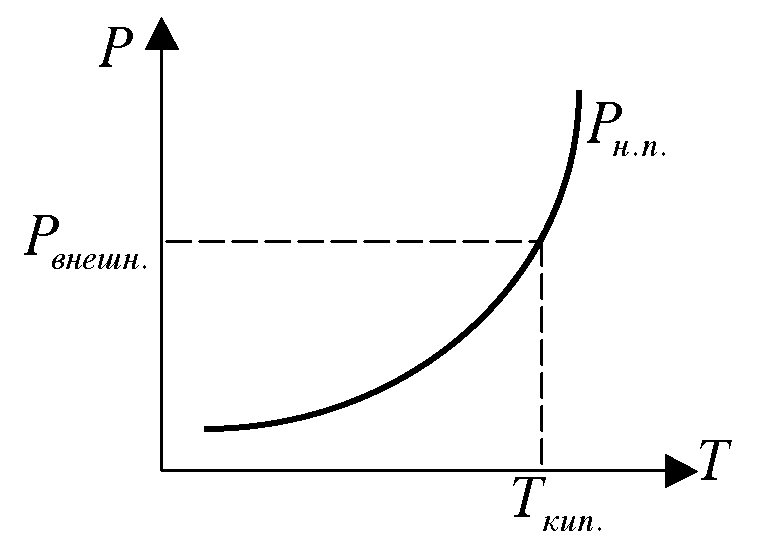
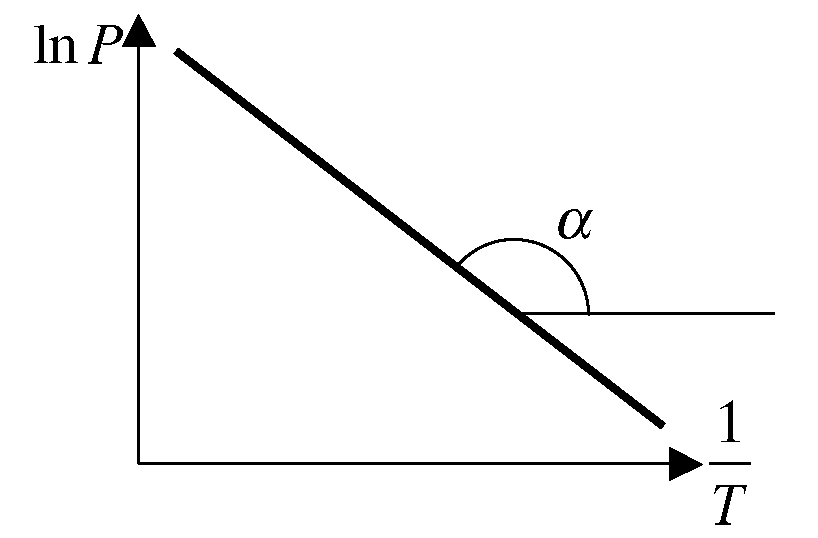
рис 1 рис 2