
- •10. Реакции электрофильного присоединения в алкенах. Правило Марковникова с электронной точки зрения.
- •11. Рекция окисления, полимеризации алкенов. Использование продуктов полимеризации в ветеринарии, с/х( полипропилен, полиэтилен и др.).
- •13. Диеновые углеводороды с сопряженными связями. Строение. Дать понятие сопряжению. Способы получения.
- •14. Алкадиены с сопряженными связями. Особенности их поведения в химических реакциях 1,4- и 1,2- присоединения.
- •15. Строение тройной углерод-углеродной связи, ее реакционная способность
- •16. Гомологический ряд алкинов. Способы получения. Физические свойства. Физиологическое действие алкинов. Реакции замещения в Алкинах.
- •17. Взаимодействие алкинов с галогенами, водой, галогеноводородами. Использование продуктов реакции.
- •18. Бензол- ароматическая система. Дать понятия ароматичности. Ее влияние на реакционную способность соединения. Привести примеры ароматических соединений из других классов.
- •Число изомеров в ряду спиртов быстро растет: с5-восемь изомеров, с6- семнадцать, с10- пятьсот семь.
- •30. Реакционная способность глицерина. Применение продуктов реакции.
- •31. Простые и сложные эфиры на основе этанола. Их реакционная способность, практическое применение.
- •32. Способы получения фенолов, использование их в ветеринарии.
- •33. Реакционная способность фенола. Показать взаимное влияние гидроксильной группы и бензольного кольца на их реакционную способность.
- •34. Классификация альдегидов, кетонов. Номенклатура, изомерия. Физические свойства. Строение карбонильной группы. Реакционные центры.
- •35. Получение альдегидов и кетонов. Распространение в природе. Использование в ветеринарии и медицине.
- •36. Реакции замещения в альдегидах и кетонах по функциональной группе и по радикалу.
- •37. Реакции присоединения, идущие в альдегидах. Кетонах. Использование и распространение в природе продуктов реакции.
- •38. Получение полуацеталей (полукеталей). Значение этих реакций в химии углеводов.
- •39. Реакции полимеризации и конденсации альдегидов и кетонов. Их отличие.
- •64.Простые липиды(жиры). Классиф-я, распр-ние в природе,хим.Св-ва. Применение.
- •70. Аминоспирты. Строение. Распространение в природе. Холин. Коламин. Химические свойства.
- •71. Диамины. Путресцин. Кадаверин. Способы получения из аминокислот. Физ и хим свойства.
- •72. Анилин – ароматический амин. Физ и хим свойства. Использование производных анилина в ветеринарии, медицине. Сульфаниламидные препараты.
- •73. Амиды карбоновых кислот. Мочевина. Свойства, применение в сельском хозяйстве. Строение глутамина и аспарагина.
- •74. Аминокислоты. Строение. Биполярность аминокислот. Амфотерные свойства аминокислот. Строение и свойства глутамина и аспарагина. Электрофорез.
- •75. Химические свойства а-аминокислот. Реакции, идущие по nh2-группе.
- •76. Химические свойства аланина. Реакции, идущие по карбоксильной группе.
- •77. Отношение к нагреванию а,в,V аминокислот (дигидратация). Лактамы. Дикетопиперазины.
- •78. Белки. Общие представления о строении белков. Структурная организация белков. Денатурация.
- •79. Белки. Классификация. Протеины. Протеиды. Биологическая роль белков.
- •80. Пиридин как представитель шестичленных азотистых гетероциклов. Свойства. Биологически активные соединения на его основе. Никотиновая кислота.
- •81. Конденсированные азотистые гетероциклы. Индол и биологически активные соединения на его основе(триптофан, индолилуксусная кислота, триптамин).
- •82. Пиримидиновые азотистые основания и нуклеотиды на их основе.
- •83. Шестичленные азотистые гетероциклы с двумя гетероатомами. Пиримидин, цитозин, урацил, тимин.
- •84. Нуклеиновые кислоты. Нуклеозид, нуклеотид. Строение. Привести пример динуклеотида.
74. Аминокислоты. Строение. Биполярность аминокислот. Амфотерные свойства аминокислот. Строение и свойства глутамина и аспарагина. Электрофорез.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомовводорода заменены на аминные группы.
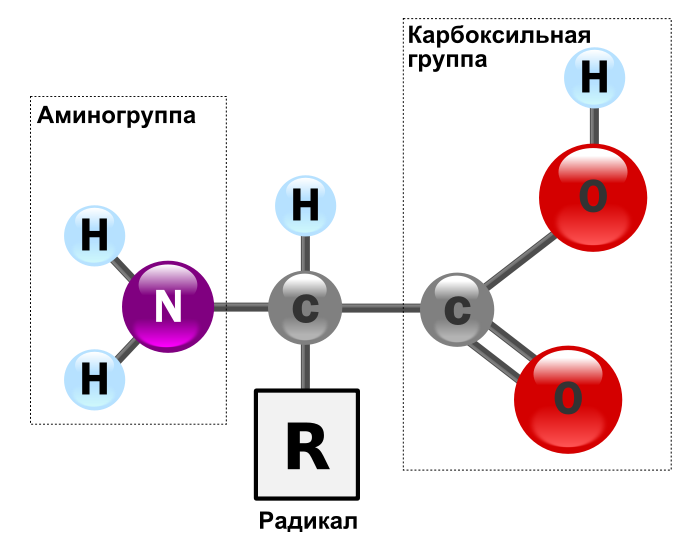
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так иосновные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NH2 —CH2COOH
![]() N+H3 —CH2COO-
N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Биполярность аминокислот обеспечивает ряд очень важных их свойств, таких, как высокая растворимость в воде, а также высокие дипольные моменты их молекул. Относительно высокие температуры плавления обусловлены тем, что их кристаллы обладают ионной решеткой. В водных растворах аминокислоты ведут себя либо как кислоты, либо как основания, проявляя тем самым амфотерные свойства.
В водных растворах при определеннойкислотности (щёлочности, pH) раствора каждая аминокислота может существовать в виде биполярного иона. Такое электрически нейтральное заряженное состояниеаминокислоты называют цвиттерионом. Цвиттерионы являются амфотерными соединениями, т. е. могут проявлять как свойства и кислот, так и свойстваоснований.
Глутамин (2-аминопентанамид-5-овая кислота) — одна из 20 стандартных аминокислот, входящих в состав белка. Глутамин полярен, не заряжен и является амидом моноаминодикарбоновой глутаминовой кислоты, образуясь из неё в результате прямого аминирования под воздействием глутаминсинтетазы.
В растворе глутамин медленно гидролизуется до глутаминовой кислоты[1].
Глутамин весьма распространен в природе, для человека является условно незаменимой аминокислотой. В теле циркулирует в крови и накапливается в мышцах.
Аспараги́н (принятые сокращения: Асн, Asn, N) — амид аспарагиновой кислоты (2-амино-бутанамид-4-овая кислота, Asx или B). Одна из 20-ти наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC. Аспарагин не является незаменимой аминокислотой, что означает способность синтезировать его основными метаболитическимипутями в человеке, и не требуется в диете. Он находится в значительных количествах в:
животных источниках: молоко, сыворотка, мясо, домашняя птица, яйца, рыба, морепродукты
растительных источниках: спаржа, помидор, бобовые, орехи, семена, соя, цельные зёрна.
В живых клетках присутствует в свободном виде и в составе белков. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Электрофорез (от электро- и греч. φορέω — переносить) — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля.
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры. Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока) ианафорез — когда заряд поверхности положительный.
Электрофорез применяют в физиотерапии, для окраски автомобилей, в химической промышленности, для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
Лечебное вещество наносится на прокладки электродов и под действием электрического поля проникает в организм через кожные покровы (в терапии, неврологии, травматологии и др.) или слизистые оболочки (в стоматологии, ЛОР, гинекологии и др.) и влияет на физиологические и патологические процессы непосредственно в месте введения. Электрический ток также оказывает нервно-рефлекторное и гуморальное действие.
В биохимии и молекулярной биологии электрофорез используется для разделения макромолекул — белков и нуклеиновых кислот (а также их фрагментов). Различают множество разновидностей этого метода (см. статью Электрофорез белков). Этот метод находит широчайшее применение для разделения смесей биомолекул на фракции или индивидуальные вещества и используется в биохимии, молекулярной биологии, клинической диагностике, популяционной биологии (для изучения генетической изменчивости) и др.
