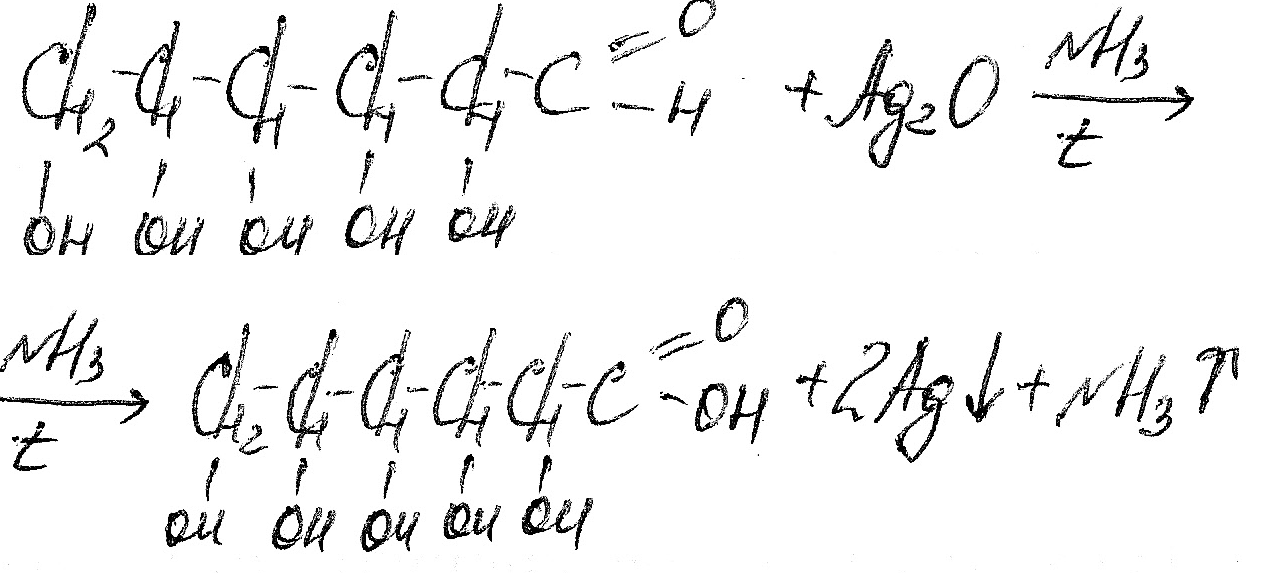- •10. Реакции электрофильного присоединения в алкенах. Правило Марковникова с электронной точки зрения.
- •11. Рекция окисления, полимеризации алкенов. Использование продуктов полимеризации в ветеринарии, с/х( полипропилен, полиэтилен и др.).
- •13. Диеновые углеводороды с сопряженными связями. Строение. Дать понятие сопряжению. Способы получения.
- •14. Алкадиены с сопряженными связями. Особенности их поведения в химических реакциях 1,4- и 1,2- присоединения.
- •15. Строение тройной углерод-углеродной связи, ее реакционная способность
- •16. Гомологический ряд алкинов. Способы получения. Физические свойства. Физиологическое действие алкинов. Реакции замещения в Алкинах.
- •17. Взаимодействие алкинов с галогенами, водой, галогеноводородами. Использование продуктов реакции.
- •18. Бензол- ароматическая система. Дать понятия ароматичности. Ее влияние на реакционную способность соединения. Привести примеры ароматических соединений из других классов.
- •Число изомеров в ряду спиртов быстро растет: с5-восемь изомеров, с6- семнадцать, с10- пятьсот семь.
- •30. Реакционная способность глицерина. Применение продуктов реакции.
- •31. Простые и сложные эфиры на основе этанола. Их реакционная способность, практическое применение.
- •32. Способы получения фенолов, использование их в ветеринарии.
- •33. Реакционная способность фенола. Показать взаимное влияние гидроксильной группы и бензольного кольца на их реакционную способность.
- •34. Классификация альдегидов, кетонов. Номенклатура, изомерия. Физические свойства. Строение карбонильной группы. Реакционные центры.
- •35. Получение альдегидов и кетонов. Распространение в природе. Использование в ветеринарии и медицине.
- •36. Реакции замещения в альдегидах и кетонах по функциональной группе и по радикалу.
- •37. Реакции присоединения, идущие в альдегидах. Кетонах. Использование и распространение в природе продуктов реакции.
- •38. Получение полуацеталей (полукеталей). Значение этих реакций в химии углеводов.
- •39. Реакции полимеризации и конденсации альдегидов и кетонов. Их отличие.
- •64.Простые липиды(жиры). Классиф-я, распр-ние в природе,хим.Св-ва. Применение.
- •70. Аминоспирты. Строение. Распространение в природе. Холин. Коламин. Химические свойства.
- •71. Диамины. Путресцин. Кадаверин. Способы получения из аминокислот. Физ и хим свойства.
- •72. Анилин – ароматический амин. Физ и хим свойства. Использование производных анилина в ветеринарии, медицине. Сульфаниламидные препараты.
- •73. Амиды карбоновых кислот. Мочевина. Свойства, применение в сельском хозяйстве. Строение глутамина и аспарагина.
- •74. Аминокислоты. Строение. Биполярность аминокислот. Амфотерные свойства аминокислот. Строение и свойства глутамина и аспарагина. Электрофорез.
- •75. Химические свойства а-аминокислот. Реакции, идущие по nh2-группе.
- •76. Химические свойства аланина. Реакции, идущие по карбоксильной группе.
- •77. Отношение к нагреванию а,в,V аминокислот (дигидратация). Лактамы. Дикетопиперазины.
- •78. Белки. Общие представления о строении белков. Структурная организация белков. Денатурация.
- •79. Белки. Классификация. Протеины. Протеиды. Биологическая роль белков.
- •80. Пиридин как представитель шестичленных азотистых гетероциклов. Свойства. Биологически активные соединения на его основе. Никотиновая кислота.
- •81. Конденсированные азотистые гетероциклы. Индол и биологически активные соединения на его основе(триптофан, индолилуксусная кислота, триптамин).
- •82. Пиримидиновые азотистые основания и нуклеотиды на их основе.
- •83. Шестичленные азотистые гетероциклы с двумя гетероатомами. Пиримидин, цитозин, урацил, тимин.
- •84. Нуклеиновые кислоты. Нуклеозид, нуклеотид. Строение. Привести пример динуклеотида.
38. Получение полуацеталей (полукеталей). Значение этих реакций в химии углеводов.
Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы.
Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора):
![]()
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
![]()
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами.
У
моносахаридов образование циклических
форм обусловлено взаимодействием
альдегидной группы с гидроксилом пятого
углеродного атома. Циклизация моносахарижов
происходит так, что атом водорода
гидроксильной группы присоединяется
к кислороду альдегидной группы за счет
разрыва
![]() -связи,
образуя так называемый полуацетальный
или гликозидный гидроксил. И таким
образом в молекуле появляется пятый
ассиметрический центр. Та циклическая
форма, у которой полуацетальный гироксил
расположен по одну сторону с гидроксилом,
определяющим конфигурацию монозы
(принадлежность к D-
или L-
ряду) называется α-формой(условно
в цис-положении), а если условно в
транс-положении, то будет относиться к
β-форме.
-связи,
образуя так называемый полуацетальный
или гликозидный гидроксил. И таким
образом в молекуле появляется пятый
ассиметрический центр. Та циклическая
форма, у которой полуацетальный гироксил
расположен по одну сторону с гидроксилом,
определяющим конфигурацию монозы
(принадлежность к D-
или L-
ряду) называется α-формой(условно
в цис-положении), а если условно в
транс-положении, то будет относиться к
β-форме.
39. Реакции полимеризации и конденсации альдегидов и кетонов. Их отличие.
Реакции конденсации. Для альдегидов и кетонов возможна конденсация, проходящая между двумя молекулами одного и того же соединения. При такой конденсации альдегидов двойная связь одной из молекул раскрывается, образуется соединение, содержащее одновременно альдегидную и ОН-группу, называемое альдолем (альдегидоспирт). Протекающую конденсацию называют, соответственно, альдольной, эту реакцию катализируют основания (рис. 4А). Полученный альдоль может далее конденсироваться с образованием двойной связи С=С и выделением конденсационной воды. В итоге получается ненасыщенный альдегид (рис. 4А, кротоновой альдегид). Такую конденсацию называют кротоновой по названию первого соединения в ряду ненасыщенных альдегидов. Кетоны также способны участвовать в альдольной конденсации (рис. 4Б), а вторая стадия – кротоновая конденсация, для них затруднена. В альдольной конденсации могут совместно участвовать молекулы различных альдегидов, а также одновременно альдегид и кетон, во всех случаях происходит удлинение углеродной цепи. Получившийся на последней стадии (рис. 4А) кротоновый альдегид, обладая всеми свойствами альдегидов, может далее участвовать в альдольной и кротоновой конденсации при взаимодействии с очередной порцией ацетальдегида, из которого он и был получен (рис. 4В). Таким способом можно удлинять углеводородную цепь, получая соединения, в которых чередуются простые и двойные связи: –СН=СН–СН=СН–.
Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН2 или замещенная метиленовая группа (СНR либо СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).
Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении.
40. Ароматические альдегиды (бензальдегид). Химические свойства.
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему.
Бензальдегид (C6 H5 ·CHO). простейший альдегид ароматического ряда, бесцветная жидкость с характерным запахом горького миндаля;
Для бензальдегида характерны реакции с участием карбонильной группы. Так, например, бензальдегид взаимодействует с NaHSO3, HCN:
C6H5CHO + HCN = C6H5CH(OH)CN
Присоединение NaHSO3 легко протекает с циклоароматическими альдегидами, реакция сопровождается образованием белых, мелкокристаллических продуктов – бисульфитных соединений:
![]()
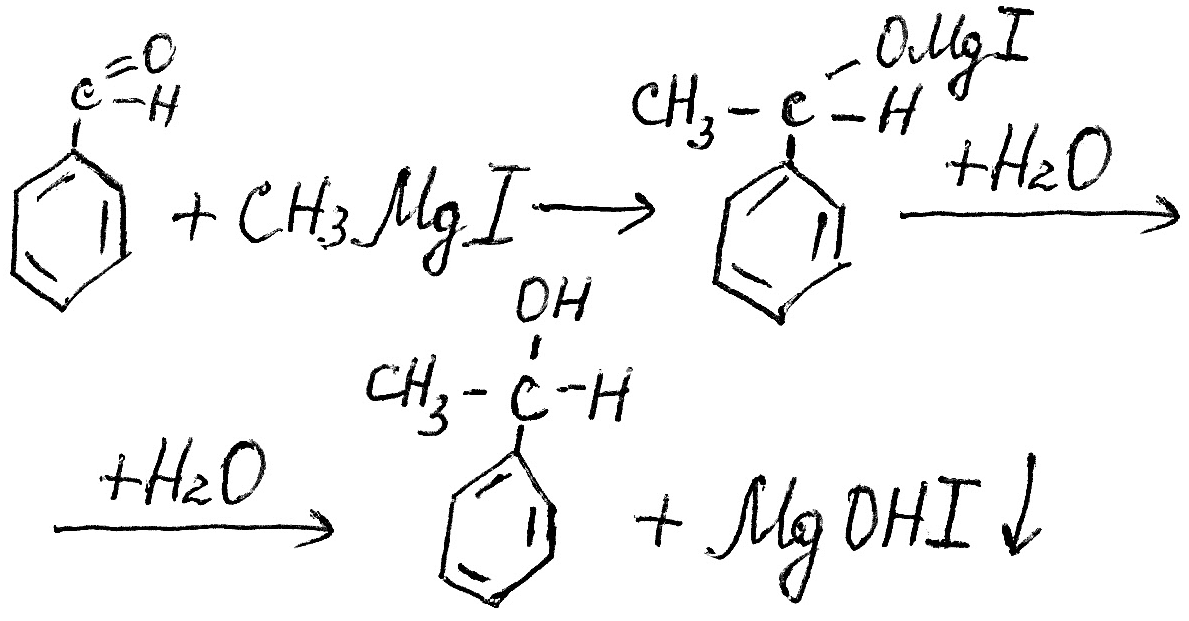
. С реактивами Гриньяра бензальдегид дает соответствующие вторичные спирты
Под действием щелочи бензальдегид вступает в реакцию Канниццаро образуя бензиловый спирт и бензойную кислоту.
Бензальдегид способен вступать в реакции электрофильного замещения, образуя мета-замещенные продукты.
![]()
41.Моносахариды. Классификация. Альдозы, кетозы. Пентозы, гексозы. Показать реакциями, что глюкоза – гетерофункциональное соединение. Написать все таутомерные формы фруктозы.
Моносахариды — органические соединения, одна из основных групп углеводов. Углеводы – это гетерофункциональные соединения.Это естественный класс органических соединений, в котором практически все вещества образуются в растительной клетке.
Моносахариды (монозы) не подвержены гидролизу на более простые молекулы. С химической точки зрения представляют собой многоатомные спирты, дополнительно содержащие альдегидную или кетонную функцию.
Их классифицируют по количеству атомов углерода в молекулярной цепи:
Триозы,
тетрозы(эритроза,треоза),
пентозы(ксилоза,рибоза),
гексозы(глюкоза,фруктоза)
Их классифицируют на
АЛЬДОЗЫ – многоатомные спирты с альдегидной функциональной группой у первого углеродного атома.
КЕТОЗЫ – общее название моносахаридов, способных реагировать как кетонополиспирты.
Глюкоза- гетерофункциональное соединение. Глюкоза – альдегидо- спирт.
Как и все альдегиды, глюкоза легко окисляется. Она восстанавливает серебро из аммиачного раствора оксида серебра:
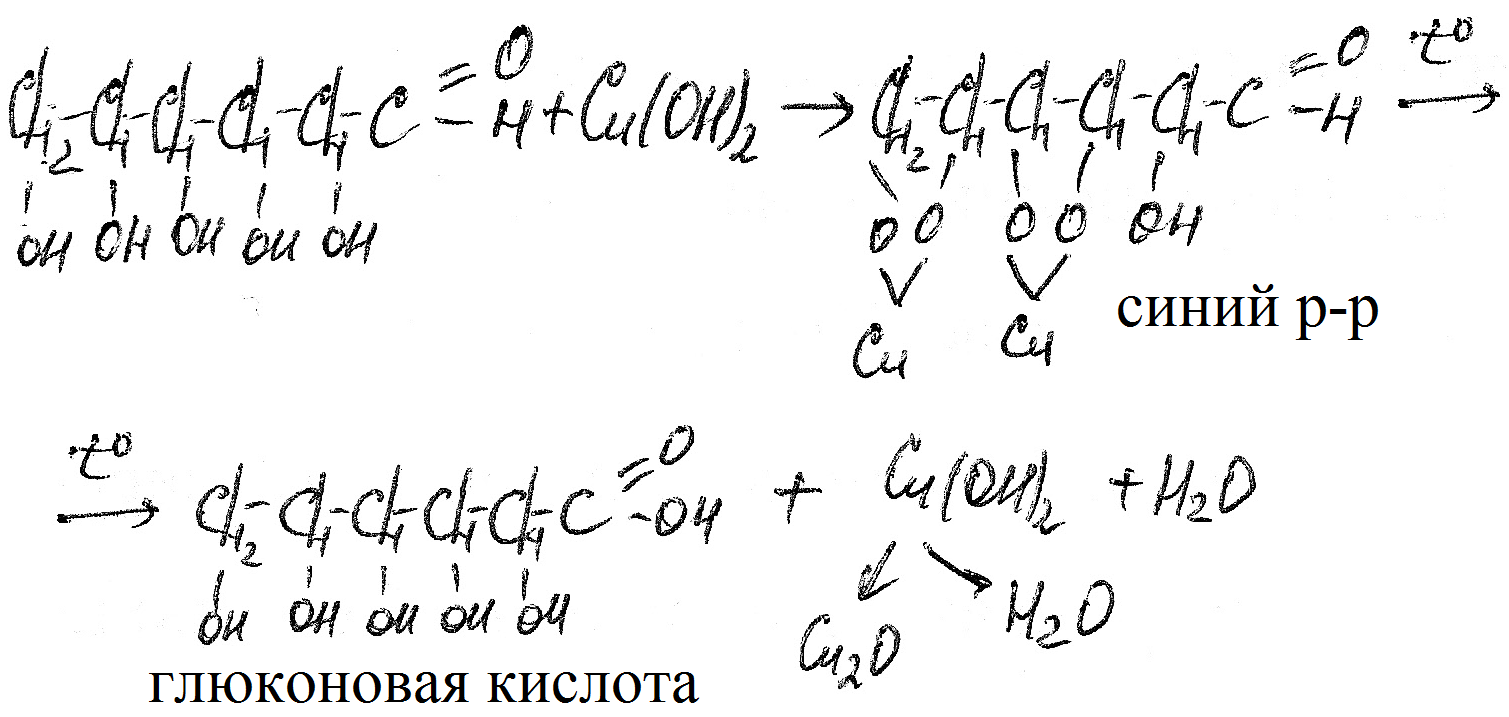
Как многоатомный спирт. Проявляет восстановительные свойства. В частности в реакции растворов сульфата меди с глюкозой и гидроксидом натрия. При нагревании эта смесь реагирует с обесцвечением (сульфат меди сине-голубой) и образованием красного осадка оксида меди(I).
Таутомери́я — явление обратимой изомерии(явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.), при которой два или более изомера легко переходят друг в друга.
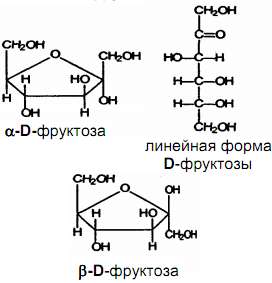
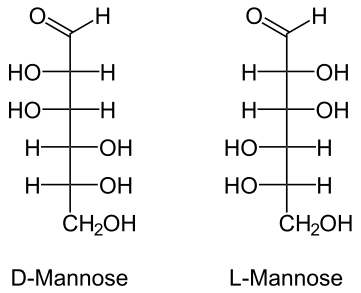
42.Оптическая изомерия моносахаридов на примере маннозы. Дать понятие явлению таутомерии, мутаротации. Доказать повышенную реакционную способность полуацетального (гликозидного) гидроксила.
Изомерия— явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Манноза — моносахарид с общей формулой C6H12O6 (эпимер глюкозы);
Таутомери́я—
явление обратимой изомерии,
при которой два или более изомера легко
переходят друг в друга. При этом
устанавливается таутомерное равновесие,
и вещество одновременно содержит
молекулы
всех изомеров (таутомеров) в определённом
соотношении. (НАПРИМЕР синильная
кислота
существует в двух таутомерных формах:
![]() )
)
Мутаротация - изменение величины оптического вращения растворов оптически активных соединений вследствие их эпимеризации, в химии углеводов под мутаротацией обычно подразумевается эпимеризация полуацетального атома углерода
Наибольшей устойчивостью обладают шести- и пятичленные циклы, называемые соответственно пиранозными и фуранозными циклами. Схема образования пиранозного цикла:
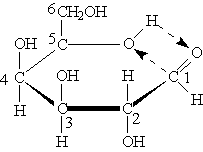
Атом водорода гидроксильной группы присоединяется к атому кислорода альдегидной группировки за счет разрыва -связей. При этом образуется так называемый полуацетальный (см. “Альдегиды и кетоны”) или гликозидный гидроксил. После переноса атома водорода от гидроксильной группы на альдегидную атом кислорода соединяется с атомом углерода с образованием цикла. В результате циклизации в молекуле моносахарида появляется дополнительный асимметрический атом углерода.
Образование циклических форм обусловлено взаимодействием альдегидной группы с гидроксилом пятого (С5) углеродного атома. Эти атомы из-за конфигурации углеродной цепи могут сближаться друг с другом в пространстве без возникновения углового напряжения. Циклизация моносахаридов происходит так, что атом водорода гидроксильной группы (С5) присоединяется к кислороду альдегидной группы за счет разрыва -связи, образуя так называемый полуацетальный, или гликозидный, гидроксил.
43.На примере химических реакций показать, что фруктоза – гетерофункциональное соединение. Енолизация в щелочной среде,восстановление.
ФруктозаC6H12O6 — моносахарид, гетерофункциональное соединение(изомер глюкозы)
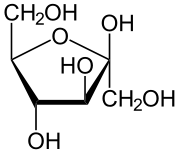
Как многоатомный спирт:
44.Рибоза, дезоксирибоза. О-, N-гликозиды на их основе. Нуклеозиды. Рибит.
Рибоза — моносахарид из группы пентоз,
![]() Рибоза
входит в состав рибонуклеиновой
кислоты,
аденозина,
нуклеотидов
и других биологических важных веществ.
Рибоза
входит в состав рибонуклеиновой
кислоты,
аденозина,
нуклеотидов
и других биологических важных веществ.
Рибоза является компонентом РНК и используется при генетической транскрипции. Производная рибозы — дезоксирибоза является компонентом ДНК. Также рибоза является компонентом АТФ и некоторых других веществ, участвующих в метаболизме.
Дезоксирибо́за C5H10O4 — углевод, альдопентоза: моносахарид, содержащий пять атомов углерода и альдегидную группу в линейной структуре. Это дезоксисахар — производное рибозы, где гидроксильная группа у второго атома углерода замещена водородом с потерей атома кислорода (дезокси — отсутствие атома кислорода).
![]() Входит
в состав ДНК,
вместе с азотистым
основанием
и остатком фосфорной
кислоты
образуя мономерную
единицу дезоксирибонуклеиновой кислоты —
нуклеотид.
Входит
в состав ДНК,
вместе с азотистым
основанием
и остатком фосфорной
кислоты
образуя мономерную
единицу дезоксирибонуклеиновой кислоты —
нуклеотид.
Гликозиды - это природные углеводосодержащие вещества органического характера, преимущественно растительного происхождения. В состав молекулы гликозидов входит сахар и несахаристая часть - агликон, или генин. Агликон и сахар соединены между собой связью, подобной сложноэфирной, поэтому молекула гликозида легко расщепляется в присутствии воды под влиянием энзимов (ферментов), содержащихся в этих растениях.
Связь сахарного остатка (гликозила) с генином (R) осуществляется либо через кислород (O-гликозиды), либо азот (N-гликозиды), либо серу (тиогликозиды), либо углерод (С-гликозиды).
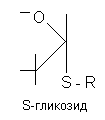
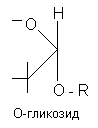
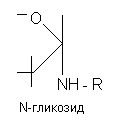
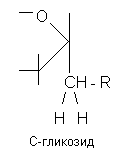
Нуклеозиды, соединения, состоящие из остатка азотистого основания и углевода — рибозы (рибонуклеозиды) или дезоксирибозы (дезоксирибонуклеозиды). Н. можно рассматривать как продукты, получающиеся после отщепления остатка фосфорной кислоты от нуклеотидов. Названия Н. производят от входящего в его молекулу основания: в случае аденина — аденозин, гуанина — гуанозин, урацила — уридин, цитозина — цитидин, тимина — тимидин;
Спирт рибит - производное рибозы; входит в состав ряда витаминов и коферментов. Рибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК. Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп. При восстановлении рибозы образуется спирт —рибит НОСН2—(СНОН)3—СН2ОН, а при окислении — рибоновая кислота НОСН2—(СНОН)3—СООН
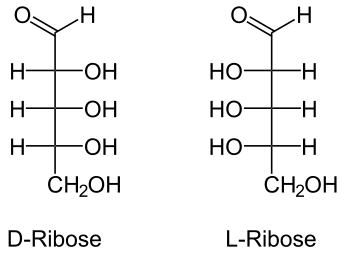
45.Явление таутомерии, мутаротации в моносахаридах (на примере рибозы). D-,L-ряды. Аномеры.
Таутомери́я — явление обратимой изомерии(явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.), при которой два или более изомера легко переходят друг в друга.
Рибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК.
Мутаротация - изменение величины оптического вращения растворов оптически активных соединений вследствие их эпимеризации, в химии углеводов под мутаротацией обычно подразумевается эпимеризация полуацетального атома углерода
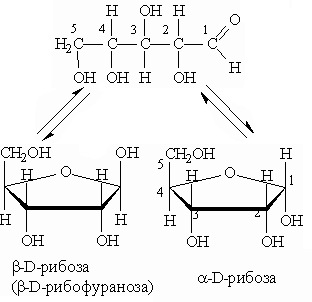
Аномерами называют моносахариды, находящиеся в циклической пиранозной или фуранозной форме и отличающиеся конфигурацией ацетального атома углерода (аномерного центра).
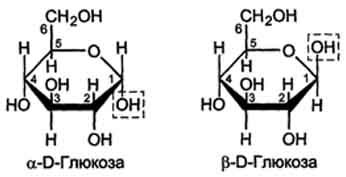
а- и В-аномеры D-глюкозы.
46.Привести пример восстанавливающего дисахарида, подтвердить химической реакцией его восстанавливающую способность.
Дисахариды – это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Дисахариды можно разделить на две группы: невосстанавливающие и восстанавливающие. Все Дисахариды построены по типу гликозидов. При этом водородный атом гликозидного гидроксила одной молекулы моносахарида замещается остатком др. молекулы моносахарида за счёт полуацетального или спиртового гидроксила. В первом случае образуются Дисахариды, не обладающие восстанавливающими свойствами, во втором — Дисахариды с восстанавливающими свойствами (I). В группу невосстанавливающих Дисахариды входят трегалоза (микоза, или грибной сахар), состоящая из 2 остатков глюкозы (II); сахароза, состоящая из остатков глюкозы и фруктозы (III), и др. К группе восстанавливающих Дисахариды относятся мальтоза ,целлобиоза ,лактоза и др.
Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие – имеют свободную ОН-группу при аномерном центре. Невосстанавливающие сахара называют гликозил-гликозидами; восстанавливающие – гликозил-гликозами.
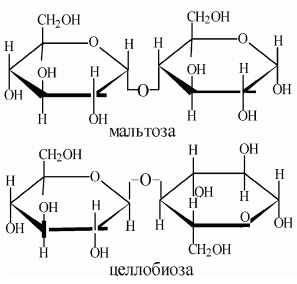
Их восстанавливающие свойства обусловлены способностью образовывать в растворах открытые альдегидные формы
50. Полисахариды. Крахмал. Строение. Физические и химические свойства. Характеристика декстрана.
Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов.
Функциональные свойства:
Структурные полисахариды придают клеточным стенкам прочность.
Водорастворимые полисахариды не дают клеткам высохнуть.
Резервные полисахариды по мере необходимости расщепляются на моносахариды и используются организмом.
Крахма́л — полисахариды амилозы и амилопектина, мономером которых является альфа-глюкоза. Формула крахмала:(C6H10O5)n.
Безвкусный, аморфный порошок белого цвета, нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц.
В горячей воде набухает (растворяется), образуя коллоидный раствор — клейстер; с раствором йода образует соединение-включение, которое имеет синюю окраску. В воде, при добавлении кислот (разбавленная H2SO4 и др.) как катализатора, постепенно гидролизуется с уменьшением молекулярной массы, с образованием т. н. «растворимого крахмала», декстринов, вплоть до глюкозы. Молекулы крахмала неоднородны по размерам. Крахмал представляет собой смесь линейных и разветвлённых макромолекул. При действии ферментов или нагревании с кислотами подвергается гидролизу. Уравнение:(C6H10O5)n + nH2O—H2SO4→ nC6H12O6.
Качественные реакции:
Крахмал, в отличие от глюкозы, не даёт реакции серебряного зеркала.
Подобно сахарозе, не восстанавливает гидроксид меди (II).
Взаимодействие с йодом (окрашивание в синий цвет) — качественная реакция;
ДЕКСТРАНЫ (С6Н10О5)n, группа бактериальных полисахаридов, состоящих из остатков a-D-глюкопиранозы. Молекулы декстранов - разветвленные цепи (см. ф-лу), линейная часть к-рых содержит гл. обр. 1 : 6-связи и небольшое кол-во 1 : 3-связей (в нек-рых редко встречающихся декстранах обнаружены чередующиеся 1 : 6- и 1 : 3-связи). Разветвления в молекуле декстрана образуются с помощью 1 : 2-, 1 : 3- или 1 : 4-связей. В индивидуальном декстране обычно имеются один или два типа связей ветвления. Боковые ветви молекулы состоят обычно из одного или двух остатков глюкозы.
51. Гликоген. Строение. Физические и химические свойства. Характеристика гетерополисахаридов соединительной ткани.
гликоген — полисахарид, откладываемый как энергетический запас в клетках животных организмов, но встречается в малых количествах и в тканях растений. (С6Н10О5) - разветвленный полисахарид, молекулы к-рого построены из остатков-D-глюкопиранозы со связями 1 -> 4 в линейных участках и 1->6 в разветвлениях (ф-лу участка молекулы гликогена см. в ст. Гликозилтрансферазы). Точки ветвления во внутр. участках молекулы расположены через 3-4 остатка моносахарида, хотя в среднем одно разветвление приходится на 10-12 глюкозильных остатков.
Гликоген-аморфный продукт; мол. м. 106-109, + 196° (вода); хорошо раств. в воде (р-ры опалесцируют), из к-рой осаждается спиртом или (NH4)2SO4. К-тами гидролизуется, причем вначале образуются декстрины, а в конце р-ции - глюкоза. К действию конц. р-ров щелочей довольно устойчив. Водные р-ры гликогена окрашиваются иодом ( 410-490 нм), что используется для качеств. обнаружения полисахарида. Образует комплексы со мн. белками, напр. с альбумином.
Гликоген содержится во всех тканях животных и человека и представляет собой резервное в-во (в растениях такие функции выполняет крахмал), легко расщепляющееся под действием ряда ферментов до глюкозы. Обнаружен также в бактериях, грибах и зернах растений. У человека богаты гликогеном печень (2-6% от массы сырой ткани) и мышцы (до 2%). В тканях животных гликоген присутствует в виде частиц, наз. гликогеносомами.
Полисахариды соединительной ткани находятся в виде углевод-белковых комплексов - протеогликанов. Наиболее важные из них: хондроитинсульфаты (кожа, хрящи, сухожилия), гиалуроновая кислота (хрящи, стекловидное тело глаза, суставная жидкость), гепарин (печень, кровеносные сосуды). Для этих полисахаридов характерны общие черты в строении. Они имеют неразветвленную структуру и содержат биозные фрагменты, включающие гликуроновые кислоты и ацетилированные аминосахара. Например, гиалуроновая кислота состоит из дисахаридных фрагментов, включающих D-глюкуроновую кислоту и N-ацетил-D-глюкозамин, которые связан внутри биозного фрагмента b-1,3-гликозидной связью, между биозными фрагментами - b-1,4-гликозидной связью.
52. Клетчатка (целлюлоза). Строение. Химические свойства. Распространение в природе. Применение производных целлюлозы.
целлюлоза — основной структурный полисахарид клеточных стенок растений. (C6H10O5)n[1], белое твердое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица — остаток β-глюкозы [С6Н7О2(OH)3]n. Полисахарид, главная составная часть клеточных оболочек всех высших растений.
Физические свойства
Целлюлоза — белое твердое, стойкое вещество, не разрушается при нагревании (до 200 °C), но является горючим веществом. Не растворима в воде и слабых кислотах. Целлюлоза представляет собой длинные нити, содержащие 300—10 000 остатков глюкозы, без боковых ответвлений. Эти нити соединены между собой множеством водородных связей, что придает целлюлозе большую механическую прочность, при сохранении эластичности. Зарегистрирована в качестве пищевой добавки E460.
Химические свойства
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
(C6H10O5)n + nH2O nC6H12O6
Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет. Один же йод — только в коричневый.
При реакции с азотной кислотой образуется нитроцеллюлоза (тринитрат целлюлозы).
В процессе этерификации целлюлозы уксусной кислотой получается ацетат целлюлозы.
Сохраняющиеся в почве и возвращающиеся в нее растительные остатки на 40-70% состоят из целлюлозы. Столь большое количество целлюлозы в природе обусловливает важную роль разлагающих ее микроорганизмов в процессах минерализации и в круговороте углерода.
Применение
Целлюлозу и её эфиры используют для получения искусственного волокна (вискозный, ацетатный, медно-аммиачный шёлк, искусственная шерсть). Хлопок, состоящий большей частью из целлюлозы (до 99,5 %), идёт на изготовление тканей.
Древесная целлюлоза используется для производства бумаги, пластмасс, кино и фотоплёнок, лаков, бездымного пороха и т. д.
53. Классификация карбоновых кислот. Функциональные производные кислот (амиды, ангидриды, хлорангидриды, сложные эфиры). Реакции их получения на примере масляной и уксус. кислот.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми.
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические
алифатические (в том числе предельные и непредельные)
алициклические
гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
1) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
2) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
3) Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды.
Амиды — производные оксокислот (как карбоновых, так и минеральных) RkE(=O)l(OH)m, (l ≠ 0), формально являющиеся продуктами замещения гидроксильных групп -OH кислотной функции на аминогруппу (незамещенную и замещенную); рассматриваются также как ацилпроизводные аминов. Амиды образуются при нагревании карбоновых кислот с аммиаком или первичными и вторичными аминами, при действии на амины ацилирующих агентов (хлорангидридов и ангидридов карбоновых кислот, кетенов, изоцианатов), при аммонолизе сложных эфиров, гидролизе нитрилов и имидоилгалогенидов.
Ангидриды карбоновых кислот представляют собой продукты отщепления молекулы воды от двух молекул кислоты. Ангидриды карбоновых кислот можно рассматривать как продукт конденсации двух групп -COOH:
R1-COOH + HOOC-R2 = R1-(CO)O(OC)-R2 + H2O
Хлорангидриды карбоновых кислот реагируют с карбоновыми кислотами или их солями, образуя ангидриды:
CH3COCl + CH3COONa = CH3(CO)O(OC)CH3 + NaCl
Для уксусного ангидрида и смешанных ангиридов уксусной кислоты существует особый способ получения: реакция карбоновой кислоты с кетеном (кетен CH2=CO можно представить, как результат отщепления воды от молекулы уксусной кислоты). Сначала получают кетен, пропуская пары ацетона над разогретой до 700 °C нихромовой спиралью:
CH3COCH3 = CH4 + CH2=CO, потом кетен пропускают через карбоновую кислоту, и получают ангидрид.
Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) — производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl.
Получают хлорангидриды чаще всего взаимодействием безводной карбоновой кислоты с тионилхлоридом (SOCl2), трёххлористым фосфором (PCl3) или пятихлористым фосфором (PCl5), фосгеном (COCl2).
R-COOH + SOCl2 → R-COCl + SO2↑ + HCl↑
3 R-COOH + PCl3 → 3 R-COCl + H3PO3
R-COOH + PCl5 → R-COCl + POCl3 + HCl
R-COOH + COCl2 → R-COCl + CO2↑ + HCl↑
Ещё один метод мягкого получения хлорангидридов основан на использовании оксалилхлорида
R-COOH + ClCOCOCl → R-COCl + CO + CO2 + HCl
Сложные эфиры' — производные оксокислот (как карбоновых так и минеральных) RkE(=O)l(OH)m, (l ≠ 0), формально являющиеся продуктами замещения атомов водорода гидроксилов -OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов. Отличаются от простых эфиров, в которых два углеводородных радикала соединены атомом кислорода (R1-O-R2).
Основные методы получения сложных эфиров:
Этерификация — взаимодействие кислот и спиртов в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта:
СН3COOH + C2H5OH = СН3COOC2H5 + H2O
Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:
R'COOR'' + R'''OH = R'COOR''' + R''OH
R'COOR'' + R'''COOH = R'''COOR'' + R'COOH
R'COOR'' + R'''COOR'''' = R'COOR'''' + R'''COOR''
взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
(CH3CO)2O + 2 C2H5OH = 2 СН3COOC2H5 + H2O
взаимодействие солей кислот с алкилгалогенидами
RCOOMe + R'Hal = RCOOR' + MeHal
Присоединение спиртов к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса):
RCOOH + R'CH=CHR'' = RCOOCHR'CH2R''
Алкоголиз нитрилов в присутствии кислот:
RCN + H+ RC+=NH
RC+=NH + R’OH RC(OR')=N+H2
RC(OR')=N+H2 + H2O RCOOR' + +NH4
Алкилирование карбоновых кислот арилиакилтриазенами:
ArN=NNHR + R1COOH R1COOR+ ArNH2 + N2
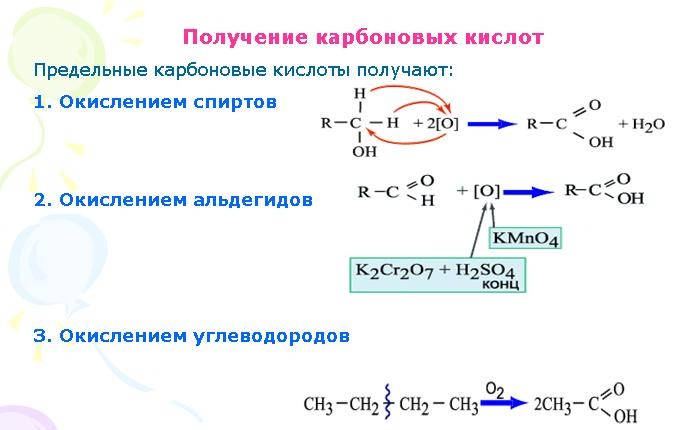
54. Способы получения предельных одноосновных карбоновых кислот. Важнейшие представители (муравьиная, уксусная, пропионовая, масляная, пальмитиновая, стеариновая).
Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) — карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу СnH2n+1COOH
Окисление спиртов
Окисление альдегидов
Окисление углеводородов
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — первый представитель в ряду насыщенных одноосновных карбоновых кислот. При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом. Соли и эфиры муравьиной кислоты называют формиатами. Важнейшим производным муравьиной кислоты является формальдегид (метаналь, муравьиный альдегид). Получение:
Как побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
Окисление метанола
Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта.
Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, причём образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты». Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична(свойство некоторых веществ поглощать водяные пары из воздуха). Неограниченно растворима в воде. Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
2 CH3CHO + O2 → 2 CH3COOH
Пропио́новая кислота́ (пропановая кислота, метилуксусная кислота, консервант E280) — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. Химическая формула С2Н5-СООН. Пропионаты — соли и эфиры пропионовой кислоты. Пропионовая кислота и ее производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (например, поливинилпропионата), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и ПАВ (гликолевые эфиры). В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности её получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца. Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту, как конечный продукт своего анаэробного метаболизма.
Ма́сляная кислота́ (бута́новая кислота́) С3Н7СООН — бесцветная жидкость с запахом прогорклого масла. Соли и эфиры масляной кислоты называются бутиратами. Масляная кислота и её эфиры содержатся в коровьем масле и нефти. Эфиры масляной кислоты применяют как душистые вещества, пластификаторы, эмульгаторы; масляная кислота — в производстве ацетобутиратов целлюлозы.
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH – наиболее распространенная в природе одноосновная насыщенная карбоновая кислота (жирная кислота). Соли и эфиры пальмитиновой кислоты называются пальмитатами.
Стеариновая кислота (октадекановая кислота) — одноосновная карбоновая кислота алифатического ряда, отвечающая формуле C18H36O2, или CH3(CH2)16COOH. Белые кристаллы, нерастворимые в воде и растворимые в диэтиловом эфире.
55. Химические свойства предельных карбоновых кислот (диссоциация, образование солей, сложных эфиров, амидов).
1. Диссоциация кислот. Все карбоновые кислоты, подобно неорганическим кислотам, обладают кислыми свойствами, окрашивая лакмус в красный цвет. Это обусловлено диссоциацией кислот:
RCOOH <-> RCOO- + Н+
2. Образование солей. Карбоновые кислоты легко всту пают в реакции с основаниями, основными оксидами и активными металлами:
2RCOOH + Mg = (RCOO)2Mg + Н2
RCOOH + NaOH = RCOONa + H2O
2RCOOH + CaO = (RCOO)2Ca + H2O
Соли карбоновых кислот сильно гидролизованы в водном растворе как соли слабых кислот. Минеральные кислоты, как более сильные, вытесняют карбоновые кислоты из их солей:
CH3COONa + НСl = СН3СООН + NaCl
Карбоновые кислоты устойчивы к действию концентрированных минеральных кислот. Исключение составляет муравьиная кислота, которая под действием концентрированной H2S04 разлагается:
HCOOH ---H2SO4---> CO + H2O
3. Образование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот:
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации)
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-CO-Cl + Na-O-R' → R-CO-OR' + NaCl.
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
СН3-СО-Сl + CН3 → СН3-СО-CН2 + HCl.
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
CH3-COONH4 t°→ CH3-CO-NH2 + Н2О
56. Реакции замещения а-водородного атома в углеводородном радикале кислот. Влияние заместителей углеводородного радикала на силу кислот. Ангидриды, хлорангидриды кислот.
Ангидриды карбоновых кислот представляют собой продукты отщепления молекулы воды от двух молекул кислоты. Ангидриды карбоновых кислот можно рассматривать как продукт конденсации двух групп -COOH:
R1-COOH + HOOC-R2 = R1-(CO)O(OC)-R2 + H2O
• Хлорангидриды карбоновых кислот реагируют с карбоновыми кислотами или их солями, образуя ангидриды:
CH3COCl + CH3COONa = CH3(CO)O(OC)CH3 + NaCl
• Для уксусного ангидрида и смешанных ангиридов уксусной кислоты существует особый способ получения: реакция карбоновой кислоты с кетеном (кетен CH2=CO можно представить, как результат отщепления воды от молекулы уксусной кислоты). Сначала получают кетен, пропуская пары ацетона над разогретой до 700 °C нихромовой спиралью:
CH3COCH3 = CH4 + CH2=CO, потом кетен пропускают через карбоновую кислоту, и получают ангидрид.
Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) — производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl.
Получают хлорангидриды чаще всего взаимодействием безводной карбоновой кислоты с тионилхлоридом (SOCl2), трёххлористым фосфором (PCl3) или пятихлористым фосфором (PCl5), фосгеном (COCl2).
• R-COOH + SOCl2 → R-COCl + SO2↑ + HCl↑
• 3 R-COOH + PCl3 → 3 R-COCl + H3PO3
• R-COOH + PCl5 → R-COCl + POCl3 + HCl
• R-COOH + COCl2 → R-COCl + CO2↑ + HCl↑
Ещё один метод мягкого получения хлорангидридов основан на использовании оксалилхлорида
R-COOH + ClCOCOCl → R-COCl + CO + CO2 + HCl
57. Высокомолекулярные предельные карбоновые кислоты (пальмитиновая и стеариновая). Эфиры, соли этих кислот.
Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) — карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу СnH2n+1COOH
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH – наиболее распространенная в природе одноосновная насыщенная карбоновая кислота (жирная кислота). Соли и эфиры пальмитиновой кислоты называются пальмитатами. Пальмитиновую кислоту используют в производстве стеарина (смесь со стеариновой кислотой), напалма, моющих и косметических средств, смазочных масел и пластификаторов.
Стеариновая кислота (октадекановая кислота) — одноосновная карбоновая кислота алифатического ряда, отвечающая формуле C18H36O2, или CH3(CH2)16COOH. Белые кристаллы, нерастворимые в воде и растворимые в диэтиловом эфире. Широко используется в косметической промышленности: стеарат натрия является одним из основных компонентов мыла, сама стеариновая кислота входит в состав многих косметических средств. Применяется в производстве свечей и как мягчитель в производстве резины. Стеараты натрия, кальция, свинца используются как компоненты пластичных смазок. Соли и эфиры Стеариновой кислоты называются стеаратами.
58. Химические свойства непредельных карбоновых кислот, связанные с наличием кратной связи на примере акриловой, олеиновой, линолевой, линоленолевой кислот.
Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью - альфа, бета-непредельные кислоты. У этих кислот присоединение галогеноводородов и гидратация идут против правила Марковникова:
СН2=СН-СООН + НВr -> СН2Вr-СН2-СООН
При осторожном окислении образуются диоксикислоты:
СН2=СН-СООН + [О] + Н20 -> НО-СН2-СН(ОН)-СООН
При энергичном окислении происходит разрыв двойной связи и образуется смесь разных продуктов, по которым можно установить положение двойной связи. Олеиновая кислота С17Н33СООН - одна из важнейших высших непредельных кислот. Это - бесцветная жидкость, затвердевает на холоде. Ее структурная формула: СН3-(СН2)7-СН=СН-(СН2)7-СООН. СН2=СН-СООН - акриловая (пропеновая) кислота, Линолевая кислота — одноосновная карбоновая кислота с двумя изолированными двойными связями CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH, Линоленовая кислота — одноосновная карбоновая кислота с тремя изолированными двойными связями, CH3(CH2CH=CH)3(CH2)7COOH.
59. Способы получения оксикислот. Молочная, винная, яблочная, лимонная кислоты. Нахождение в природе.
Оксикислоты (оксикарбоновые кислоты, гидрокискарбоновые кислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН.
Методы синтеза:
Получение α–оксикислот гидролизом оксинитрилов (циангидринов)
Получение α–оксикислот гидролизом галогенкарбоновых кислот
Получение β–оксикислот гидратацией непредельных кислот
Получение β–оксикислот по реакции Реформатского
Получение β–оксикислот ферментативным окислением предельных кислот в β-положение
δ- и γ-оксикислоты получают окислением циклических кетонов надкислотами (реакция Байера-Виллигера) с последующим гидролизом лактонов.
Ви́нная кислота́ (диоксиянтарная кислота, 2,3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН — двухосновная оксикислота. Винная кислота — распространённое природное соединение. В значительном количестве она содержится в кислом соке многих фруктов, например, в виноградном соке. Соли винной кислоты — тартраты. D-винную к-ту получают действием минеральных к-т на ее кислую К-соль (винный камень), образующуюся при брожении виноградного сока. При пиролизе D-винной к-ты образуются пировиноградная СН3СОСООН и пировинная НООССН(СН3)СН2СООН к-ты,выделяется СО2. Она восстанавливается до янтарной к-ты, восстанавливает аммиачный растворр AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора, так называемого реактива Фелинга.
Лимо́нная кислота́ (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — кристаллическое вещество белого цвета, температура плавления 153 °C, хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трёхосновная кислота. Соли и эфиры лимонной кислоты называются цитратами. Вещество чрезвычайно распространено в природе: содержится в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много её в китайском лимоннике и недозрелых лимонах. Лимонную кислоту раньше получали из сока лимона и биомассы махорки. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niger.
Яблочная кислота (оксиянтарная кислота, гидроксибутандиовая кислота) НООС-СН(ОН)-СН2-СООН — двухосновная оксикарбоновая кислота. Бесцветные гигроскопичные кристаллы, отлично растворимые в воде и этиловом спирте. Температура плавления 100 °C. Впервые выделена шведским химиком Карлом Вильгельмом Шееле (Carl Wilhelm Scheele) в 1785 году из незрелых яблок. Соли и анионы яблочной кислоты — малаты. Яблочная кислота содержится в незрелых яблоках, винограде, рябине, барбарисе, малине и др. Растения махорки и табака содержат её в виде солей никотина.
Молочная кислота — α-оксипропионовая (2-гидроксипропановая) кислота. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем молоке, при брожении вина и пива. Получают молочную кислоту молочнокислым брожением глюкозы (реакция ферментативна):
C6H12O6 → 2CH3CH(OH)COOH + 21,8·104 Дж
60.Оксикислоты.Молочная к-та.Оптическая изомерия на примере молочной к-ты. Ее хим.св-ва. Оксикислоты (оксикарбоновые кислоты, гидрокискарбоновые кислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов(окисление, образование простых эфиров и т. д.). Оптические изомеры молочной кислоты отличаются друг от друга как предмет от своего зеркального изображения.Хим.св-ва..
61. оптическая изомерия на примере винных кислот. Дать понятие антиподам, диастереомерам, рацематам. Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена(X), 1,3-дифенилаллена (XI), 6,6'-динитро-2,2'-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Оптически активные винные кислоты при длительном нагревании их водных растворов рацемизуются, превращаясь в смесь антиподов.
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например: π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Рацематы, оптически неактивные комплексы эквимолярных количеств антиподов. Физические свойства Р. и антиподов различны, а синтез Р.из антиподов сопровождается выделением тепла. При химическом синтезе, в котором образуется новый асимметрический атом, обычно получаются Р. специальными приёмами они могут быть разделены на оптически активные антиподы.
62.Альдегидо-и
кетокислоты. Методы получения, нахождение
в природе, хим.св-ва на примере
пировиноградной и ацетоуксусной к-от.
АЛЬДЕГИДО-
И КЕТОКИСЛОТЫ (оксокарбоновые
к-ты, оксокислоты), соединения, содержащие
карбоксильную и карбонильную (альдегидную
или кетонную) группы. В соответствии с
взаимным расположением этих групп
в молекуле различают![]() и
т.д. оксокарбоновые к-ты. Альдегидо-
икетокислоты вступают
в р-ции, характерные для групп СООН и
СО.
Кетокислоты получают окислением
и
т.д. оксокарбоновые к-ты. Альдегидо-
икетокислоты вступают
в р-ции, характерные для групп СООН и
СО.
Кетокислоты получают окислением![]() гидроксикислот.
Важнейшая из них-пировиноградная
СН3СОСООН-бесцв. жидкость с
резким запахом; раств. в воде,
эфире, спирте.
М.б. получена перегонкой винной
к-ты над KHSO4, из ацетилхлорида или
2,2-дихлорпропионовой к-ты. Легко отщепляет
СО2 или
СО.Окисляется Н2О2 в
уксусную к-ту. Является важнейшим
промежут. продуктом, связывающим
превращения углеводов, белков и липидов.
Применяется в произ-ве лек. в-в, напр.
цинхофена (атофана).
гидроксикислот.
Важнейшая из них-пировиноградная
СН3СОСООН-бесцв. жидкость с
резким запахом; раств. в воде,
эфире, спирте.
М.б. получена перегонкой винной
к-ты над KHSO4, из ацетилхлорида или
2,2-дихлорпропионовой к-ты. Легко отщепляет
СО2 или
СО.Окисляется Н2О2 в
уксусную к-ту. Является важнейшим
промежут. продуктом, связывающим
превращения углеводов, белков и липидов.
Применяется в произ-ве лек. в-в, напр.
цинхофена (атофана).
63.Классификация липидов.Св-ва простых липидов(р-ии гидрирования, омыления, окисления, полимеризации). ЛИПИДЫ- жиро-подобные вещества, входящие в состав всех живых клеток и играющие важную роль в жизненных процессах. Будучи одним из осн. компонентов биол. мембран, Л. влияют на проницаемость клеток и активность ферментов, участвуют в передаче нервного импульса, мышечном сокращении, создании межклеточных контактов, в иммунохим. процессах. Др. функции Л.— образование энергетич. резерва и создание защитных водоотталкивающих и термоизоляц. покровов у животных и растений, а также защита разл. органов от механич. воздействий. Большинство Л.— производные высших жирных к-т, спиртов или альдегидов. Простые Л. включают вещества, молекулы к-рых состоят только из остатков жирных к-т (или альдегидов) и спиртов. К ним относятся жиры, воски и диольные Л. (эфиры жирных к-т и этиленгликоля или др. двухатомных спиртов). Сложные Л.— комплексы Л. с белками (липопротеиды), производные ортофосфорной к-ты (фосфатиды, или фосфолипиды), Л., содержащие остатки Сахаров (гликолипиды). Молекулы сложных Л. содержат также остатки многоатомных спиртов — глицерина (глицеринфосфатиды) или сфингозина (сфинголипиды). К Л. относят также нек-рые вещества, не являющиеся производными жирных к-т,— стерины, убихиноны, терпены. Хим. и физ. свойства Л. определяются наличием в их молекулах как полярных группировок (—СООН, —ОН, —NH2 и др.), так и неполярных углеводородных цепей. Благодаря такому строению большинство Л.— поверхностно-активные вещества, умеренно растворимые в неполярных растворителях (петролейном эфире, бензоле и др.) и очень малорастворимые в воде. В организме Л. подвергаются ферментативному гидролизу под влиянием липаз. Освобождающиеся при этом жирные кислоты активируются взаимодействием с аденозинфосфорными к-тами (гл. обр. с АТФ) и коферментом А. и затем окисляются. Выделяющаяся при этом энергия используется для образования АТФ. Омыление — щелочной гидролиз липидов. При О. триглицеридов образуется глицерин и соли жирных кислот.