
- •10. Реакции электрофильного присоединения в алкенах. Правило Марковникова с электронной точки зрения.
- •11. Рекция окисления, полимеризации алкенов. Использование продуктов полимеризации в ветеринарии, с/х( полипропилен, полиэтилен и др.).
- •13. Диеновые углеводороды с сопряженными связями. Строение. Дать понятие сопряжению. Способы получения.
- •14. Алкадиены с сопряженными связями. Особенности их поведения в химических реакциях 1,4- и 1,2- присоединения.
- •15. Строение тройной углерод-углеродной связи, ее реакционная способность
- •16. Гомологический ряд алкинов. Способы получения. Физические свойства. Физиологическое действие алкинов. Реакции замещения в Алкинах.
- •17. Взаимодействие алкинов с галогенами, водой, галогеноводородами. Использование продуктов реакции.
- •18. Бензол- ароматическая система. Дать понятия ароматичности. Ее влияние на реакционную способность соединения. Привести примеры ароматических соединений из других классов.
- •Число изомеров в ряду спиртов быстро растет: с5-восемь изомеров, с6- семнадцать, с10- пятьсот семь.
- •30. Реакционная способность глицерина. Применение продуктов реакции.
- •31. Простые и сложные эфиры на основе этанола. Их реакционная способность, практическое применение.
- •32. Способы получения фенолов, использование их в ветеринарии.
- •33. Реакционная способность фенола. Показать взаимное влияние гидроксильной группы и бензольного кольца на их реакционную способность.
- •34. Классификация альдегидов, кетонов. Номенклатура, изомерия. Физические свойства. Строение карбонильной группы. Реакционные центры.
- •35. Получение альдегидов и кетонов. Распространение в природе. Использование в ветеринарии и медицине.
- •36. Реакции замещения в альдегидах и кетонах по функциональной группе и по радикалу.
- •37. Реакции присоединения, идущие в альдегидах. Кетонах. Использование и распространение в природе продуктов реакции.
- •38. Получение полуацеталей (полукеталей). Значение этих реакций в химии углеводов.
- •39. Реакции полимеризации и конденсации альдегидов и кетонов. Их отличие.
- •64.Простые липиды(жиры). Классиф-я, распр-ние в природе,хим.Св-ва. Применение.
- •70. Аминоспирты. Строение. Распространение в природе. Холин. Коламин. Химические свойства.
- •71. Диамины. Путресцин. Кадаверин. Способы получения из аминокислот. Физ и хим свойства.
- •72. Анилин – ароматический амин. Физ и хим свойства. Использование производных анилина в ветеринарии, медицине. Сульфаниламидные препараты.
- •73. Амиды карбоновых кислот. Мочевина. Свойства, применение в сельском хозяйстве. Строение глутамина и аспарагина.
- •74. Аминокислоты. Строение. Биполярность аминокислот. Амфотерные свойства аминокислот. Строение и свойства глутамина и аспарагина. Электрофорез.
- •75. Химические свойства а-аминокислот. Реакции, идущие по nh2-группе.
- •76. Химические свойства аланина. Реакции, идущие по карбоксильной группе.
- •77. Отношение к нагреванию а,в,V аминокислот (дигидратация). Лактамы. Дикетопиперазины.
- •78. Белки. Общие представления о строении белков. Структурная организация белков. Денатурация.
- •79. Белки. Классификация. Протеины. Протеиды. Биологическая роль белков.
- •80. Пиридин как представитель шестичленных азотистых гетероциклов. Свойства. Биологически активные соединения на его основе. Никотиновая кислота.
- •81. Конденсированные азотистые гетероциклы. Индол и биологически активные соединения на его основе(триптофан, индолилуксусная кислота, триптамин).
- •82. Пиримидиновые азотистые основания и нуклеотиды на их основе.
- •83. Шестичленные азотистые гетероциклы с двумя гетероатомами. Пиримидин, цитозин, урацил, тимин.
- •84. Нуклеиновые кислоты. Нуклеозид, нуклеотид. Строение. Привести пример динуклеотида.
72. Анилин – ароматический амин. Физ и хим свойства. Использование производных анилина в ветеринарии, медицине. Сульфаниламидные препараты.
Анили́н (фениламин) — органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
![]()
Хим свойства. Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Фенацетин, парацетамол применяют как анальгетики; они оказывают жаропонижающее действие, практически не обладают противовоспалительным действием. Фенацетин в организме превращается в парацетамол, который переходит в парааминофенол. Последний способствует метгемоглобино-образованию, может вызвать гемолиз эритроцитов, стать причиной почечной недостаточности («фенацетиновый» нефрит).
Сульфаниламидные препараты (синоним сульфаниламиды) — синтетические химиотерапевтические средства широкого спектра действия из группы производных амида сульфаниловой кислоты (сульфаниламида).
К сульфаниламидным препаратам чувствительны стрептококки, стафилококки, диплококки (гонококки, менингококки, пневмококки), кишечная, дизентерийная, дифтерийная и сибиреязвенная палочки, бруцеллы, холерные вибрионы, актиномицеты, хламидии (возбудители трахомы, орнитоза и др.), а также возбудители анаэробной инфекции (клостридии), некоторых протозойных инфекций (малярии, токсоплазмоза). Кроме того, к С. п. чувствительны отдельные возбудители глубоких микозов (нокардин, актиномицеты). Некоторые С. п. (сульфадиметоксин, сульфапиридазин, сульфален) проявляют активность в отношении микобактерий лепры (см. Противолепрозные средства). К числу устойчивых к С. п. относятся сальмонеллы, синегнойная палочка, микобактерии туберкулеза, спирохеты, лептоспиры и вирусы. На чувствительные к ним микроорганизмы С. п. в концентрациях, в которых они накапливаются в организме в терапевтических дозах, действуют бактериостатически.
73. Амиды карбоновых кислот. Мочевина. Свойства, применение в сельском хозяйстве. Строение глутамина и аспарагина.
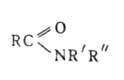
АМИДЫ КАРБОНОВЫХ КИСЛОТ [от ам(миак)], ацилпроизводные аммиака или аминов, соед. общей ф-лы RC(O)NRR". Незамещенные у атома N амиды (А.) RCONH2 наз. первичными; моно- и дизамещенные А. RCONHR и RCONRR" (R и R"-opr. остаток) - соотв. вторичными и третичными. Соед., содержащие две ацильные группы у атома азота RCON(R)COR", наз. имидами, а соединения с тремя ацильными группами RCON(COR)COR" - триациламинами. По др. классификации соед., содержащие одну, две или три ацильные группы, наз. соотв. первичными, вторичными или третичными. Циклич. аналогами А. являются лактамы . Об А. суль-фокислот см. Сульфамиды .
Названия
первичных А. производят от названий
соответствующих к-т, напр. НСОNН2-формамид,
или амид муравьиной к-ты, СН3СОNH2-ацетамид,
или амид уксусной к-ты, С6Н5СОNН2 -
бензамид, или амид бензойной к-ты. В
названиях N-замещенных А. заместители
перечисляются перед названием
незамещенного А., напр. HCON(CH3)2 -
N.N-диметилформамид.
Мочеви́на (карбамид) — химическое соединение, диамид угольной кислоты. Белые кристаллы, растворимые в полярных растворителях (воде, этаноле, жидком аммиаке).
![]()
Мочевина хорошо растворима в полярных растворителях (вода, жидкие аммиак и сернистый ангидрид), при снижении полярности растворителя растворимость падает, нерастворима в неполярных растворителях (алканы, хлороформ).
Реакционная способность мочевины типична для амидов: оба атома азота являются нуклеофилами, то есть мочевина образует соли с сильными кислотами, нитруется с образованием N-нитромочевины, галогенируется с образованием N-галогенпроизводных. Мочевина алкилируется, образуя соответствующие N-алкилмочевины RNHCONH2, взаимодействует с альдегидами, образуя производные 1-аминоспиртов RC(OH)NHCONH2,
В жёстких условиях мочевина ацилируется хлорангидридами карбоновых кислот с образованием уреидов (N-ацилмочевин):
RCOCl
+ NH2CONH2 ![]() RCONHCONH2 +
HCl
RCONHCONH2 +
HCl
Взаимодействие мочевины с дикарбоновыми кислотами и их производными (сложными эфирами и т. п.) ведёт к образованию циклических уреидов и широко используется в синтезе гетероциклических соединений; так, взаимодействие с щавелевой кислотой ведёт к парабановой кислоте, а реакция с эфирами замещённых малоновых кислот — к 1,3,5-триоксипиримидинам — производным барбитуровой кислоты, широко применявшимся в качестве снотворных препаратов:
![]()
В водном растворе мочевина гидролизуется с образованием аммиака и углекислого газа, что обуславливает ее применения в качестве минерального удобрения.
В сельском хозяйстве Мочевина — одно из лучших концентрированных азотных удобрений. Содержит 46% N.
Глутамин (2-аминопентанамид-5-овая кислота) — одна из 20 стандартных аминокислот, входящих в состав белка. Глутамин полярен, не заряжен и является амидом моноаминодикарбоновой глутаминовой кислоты, образуясь из неё в результате прямого аминирования под воздействием глутаминсинтетазы.
В растворе глутамин медленно гидролизуется до глутаминовой кислоты[1].
Глутамин весьма распространен в природе, для человека является условно незаменимой аминокислотой. В теле циркулирует в крови и накапливается в мышцах.
![]()
Аспараги́н (принятые сокращения: Асн, Asn, N) — амид аспарагиновой кислоты (2-амино-бутанамид-4-овая кислота, Asx или B). Одна из 20-ти наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC. Аспарагин не является незаменимой аминокислотой, что означает способность синтезировать его основными метаболитическимипутями в человеке, и не требуется в диете. Он находится в значительных количествах в:
животных источниках: молоко, сыворотка, мясо, домашняя птица, яйца, рыба, морепродукты
растительных источниках: спаржа, помидор, бобовые, орехи, семена, соя, цельные зёрна.
В живых клетках присутствует в свободном виде и в составе белков. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.

