
5.2. Явления смачивания и растекания
Во многих технологических процессах играют большую роль явления, происходящие в контакте жидкости с поверхностью твердого тела. От хорошего смачивания поверхностей твердого тела зависит, например, эффективность их очистки разными химическими реагентами.
Рассмотрим растекание капель на твердой поверхности, используя рисунок 5.2, а.
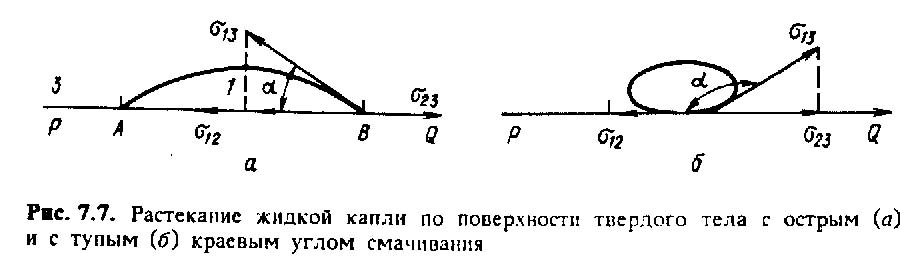
Рисунок 5.2.
Капля АВ жидкости 1 лежит на поверхностной границе PQ твердого тела 2 и фазы 3 (газа или другой жидкости). Поверхностное натяжение σ23 на границе 2-3 стремится растянуть каплю вдоль этой границы. Другое поверхностное натяжение σ12 капли на границе фаз 1-2 стремится, наоборот, стянуть каплю к ее центру. Поверхностное натяжение σ13 на третьей границе 1-3 направлено в точке В к поверхности капли по касательной под некоторым углом α с поверхностью PQ. Этот угол называется краевым углом.
На рисунке 5.2, а этот угол – острый. В этом случае проекция силы σ13 на плоскость PQ, равная σ13cosα, по направлению совпадает с σ12. Поэтому действие этих сил складывается.
Отсюда условием равновесия капли на поверхности будет равенство сил:
![]() (5.4)
(5.4)
На рисунке 5.2, б изображена другая ситуация с тупым краевым углом. В этом случае слагаемое σ13cosα является отрицательным.
В отсутствии равновесия равенство (5.4) не соблюдается, и отклонения от равенства могут быть в обе стороны.
Если σ23 больше суммы сил левой части равенства, то сила σ23 растягивает каплю во все стороны от центра. Капля уплощается, угол α уменьшается, а cosα увеличивается. Следовательно, увеличивается проекция силы σ13 на плоскость PQ. При таком увеличении может наступить момент, что левая часть равенства (5.4) сравняется с правой частью и растянутая капля окажется в равновесном состоянии.
Но может сложиться так, что даже при максимальном значении cosα =1 величина σ23 будет больше суммы, стоящей в левой части (5.4), т.е.
![]() (5.5)
(5.5)
Равновесия капли не будет, и она растекается в жидкую пленку на поверхности твердого тела. Этот случай можно наблюдать при растекании капли воды или спирта на стекле.
Если краевой угол острый, то считают, что жидкость смачивает твердое тело и, наоборот, при тупом краевом угле – жидкость его не смачивает. Известны еще понятия абсолютного смачивания (α = 0) и абсолютного несмачивания (α = 180о).
5.3. Физическая адсорбция газов на поверхности твердых тел
Поверхность твердого тела, контактирующая с газовой средой, достаточно быстро покрывается моно- или полимолекулярным слоем атомов или молекул газа. В этом состоит сущность явления адсорбции.
При этом твердое тело называют адсорбентом, а газовую фазу - адсорбатом. Различают два вида адсорбции: физическую и химическую (хемосорбцию).
При физической адсорбции адсорбированный слой атомов или молекул связан с атомами твердотельной поверхности слабыми силами Ван-дер-Ваальса. Существенное отличие физической адсорбции – это ее обратимость.
Изобара физической адсорбции (количество адсорбированного газа 1см2 поверхности за 1 с при постоянном давлении) представлена кривой 1 (рисунок 5.3). В отличие от нее кривая 3 и ее обратный ход 4 описывают хемосорбцию. Участок 2 на кривой этого рисунка отражает переход от физической адсорбции к хемосорбции. Поэтому всегда есть некоторая облась температур, в которой оба вида адсорбции нельзя резко отделить один от другого.
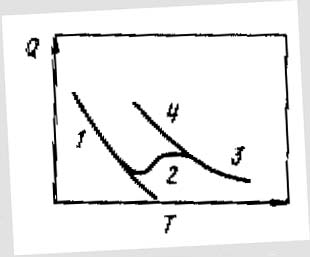
Рисунок 5.3. Изобары адсорбции газа поверхностью твердого тела
Адсорбция всегда является экзотермическим процессом, т.е. протекает с выделением теплоты адсорбции ΔHs.
Адсорбция является последовательно протекающим процессом. Он начинается на участках поверхности с максимальной поверхностной энергией. Это – вершины, углы и ребра кристаллов, берега трещин, царапины и т.д. После того как такие предпочтительные участки будут насыщены адсорбатом, начинается адсорбция на плоских поверхностях. На них высвобождается меньшее количество энергии.
Поскольку физическая адсорбция легко обратима, то легко происходит заменяемость адсорбированного слоя газа другим газом. Это - явление обменной адсорбции. При этом действует правило:
газ тем легче адсорбируется, чем выше точка его кипения, т.е. чем легче он превращается в жидкость.
Пример. Молекулы CO2 и некоторые углеводороды легко вытесняют адсорбированные слои водорода, азота. Другой пример – плохая адсорбируемость инертных газов.
Процесс адсорбции заканчивается установлением равновесия между адсорбентом и адсорбатом. Общее условие равновесия – это равенство химических потенциалов обеих фаз. Это равновесие подвижное, т.е. число молекул (атомов) адсорбируемых на данной поверхности за данный промежуток времени, становится равным числу молекул (атомов), десорбируемых за тот же промежуток времени с той же поверхности.
В условиях адсорбционного равновесия становится постоянной степень заполнения Qs поверхности газовыми частицами. Эта величина зависит, в первую очередь, от температуры и давления. Первая зависимость – изобара адсорбции, а вторая – изотерма адсорбции.
Общим для этих характеристик является увеличение степени заполнения с повышением давления при постоянной температуре и уменьшение от температуры при заданном давлении.
Несмотря на общность сформулированного правила возрастания адсорбции с давлением, математические выражения Q(P) могут различаться для разных пар «адсорбент – адсорбат».
Имеется несколько видом изотерм. Одна из них приведена на рисунке 5.4. Это т.н. изотерма Ленгмюра.
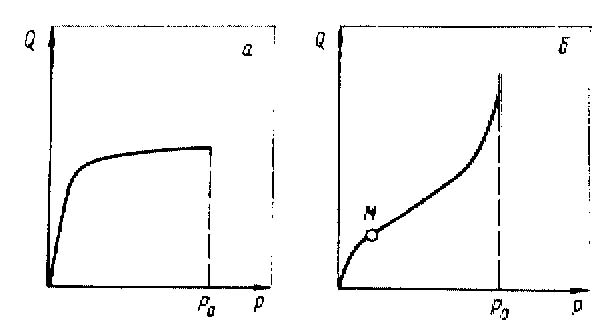
Рисунок 5.4. Изотермы адсорбции.
Для нее характерен выход на насыщение, соответствующее мономолекулярному слою на поверхности твердого тела при данной температуре. Повышение температуры снижает степень заполнения, т.е. ослабляет адсорбцию за счет более интенсивной десорбции.
S – полная поверхность адсорбента, S’ – поверхность, занятая адсорбатом, а (S – S’) – поверхность, свободная от адсорбата.
Из кинетической теории газов следует, что скорость испарения пропорциональна площади, занятой адсорбированными атомами (адатомами): k1S’. Скорость конденсации пропорциональна свободной поверхности и числу столкновений атомов газа с единицей площади поверхности в единицу времени, т.е. давлению газа р. В условиях равновесия имеет место равенство:
![]() (5.6)
(5.6)
или
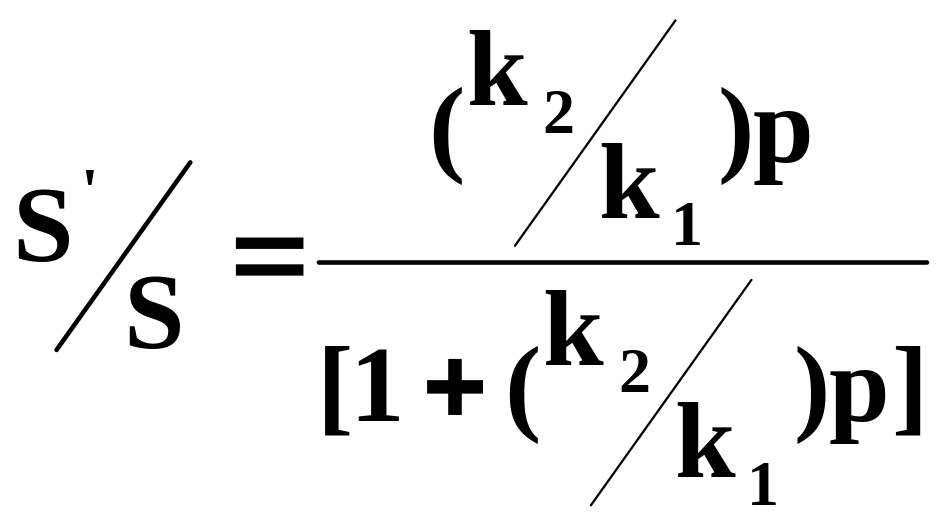 (5.7)
(5.7)
Уравнение (5.7) и есть уравнение изотермы Ленгмюра.
Изотерма другого типа, лучше отражающая полимолекулярную (многослойную) физическую адсорбцию, показана на рисунке 5.4, б. Ее принято называть изотермой БЭТ ( по имени исследователей Брунауэра, Эммета и Теллера). Уравнение изотермы БЭТ имеет вид:
![]() (5.8)
(5.8)
где V/VM – отношение объема адсорбата к объему монослоя; x = P/Po (Po – давление насыщенного пара при температуре адсорбции).
Изотермы БЭТ лучше описывают адсорбцию паров, чем газов.
В ряде случаев адсорбцию можно описать изотермой Фрейндлиха:
![]() (5.9)
(5.9)
где α и β – константы.
