
- •Кинематика материальной точки.
- •Радиус-вектор, скорость и ускорение.
- •Нормальная и тангенциальная составляющая.
- •Радиус кривизны траектории.
- •Кинематика вращательного движения. Угловые скорость и ускорение.
- •Связь линейных и угловых характеристик движения.
- •Инерциальные системы отсчёта.
- •Понятие силы и инертной массы.
- •Законы динамики.
- •Силы в природе.
- •Фундаментальные взаимодействия. Свойства сил упругости и тяготения.
- •Свойства сил трения.
- •Закон сохранения импульса системы материальных точек.
- •Работа переменной силы.
- •Кинетическая энергия и её связь с работой внешних и внутренних сил.
- •Понятие поля.
- •Консервативные силы и потенциальные поля.
- •Закон сохранения механической энергии.
- •Диссипация энергии.
- •Поступательное и вращательное движение твёрдого тела.
- •Момент силы.
- •Момент импульса материальной точки.
- •Связь между моментом силы и моментом импульса. Основное уравнение динамики вращательного движения.
- •Момент инерции.
- •Кинетическая энергия вращающегося тела.
- •Преобразования Галилея.
- •Постулаты сто.
- •Свойства пространства и времени.
- •Преобразования Лоренца.
- •Следствия преобразований Лоренца.
- •Релятивистское изменение длин и промежутков времени. Энергия в сто.
- •Статистический и термодинамический методы исследования.
- •Термодинамические параметры.
- •Идеальный газ.
- •Термодинамическая система.
- •Равновесные и неравновесные состояния и процессы.
- •Среднеквадратичная скорость молекул.
- •Молекулярно-кинетическое толкование абсолютной температуры.
- •Количество теплоты.
- •Первое начало термодинамики.
- •Адиабатный процесс.
- •Тепловые двигатели и холодильные машины.
- •Обратимые и необратимые процессы.
- •Цикл Карно для идеального газа и его кпд.
- •Второе начало термодинамики.
- •Вечный двигатель второго рода.
- •Статистическое толкование второго начала термодинамики.
- •Энтропия в термодинамике.
- •Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения.
- •Вероятностное толкование закона распределения Максвелла. Барометрическая формула.
- •Закон Больцмана для распределения частиц идеального газа во внешнем потенциальном поле.
- •Среднее число столкновений и средняя длина свободного пробега молекул идеального газа.
- •Эффективный диаметр молекулы.
- •Реальные газы.
- •Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Уравнение Ван-дер-Ваальса.
- •Внутренняя энергия реального газа.
Среднее число столкновений и средняя длина свободного пробега молекул идеального газа.
Проследить точно за траекторией частицы, пришедшей из точки А в точку В, невозможно, поэтому реальное смещение молекуле в газе оценивают скоростью диффузии: (отношением перемещения L молекулы из А в В к времени, за которое произошло это перемещение). Скорость диффузии молекулы значительно меньше средней скорости её молекулярного движения.
Чтобы оценить скорости диффузии молекул, вводится понятие средней длины свободного пробега <l>. Это такой путь, который молекула проходит, не испытывая соударений.
Средняя длина свободного пробега молекулы равна отношению пути, пройденного молекулой за 1 с, к числу происшедших за это время столкновений:<l>=<>/<z>=1/(42r2n0).
Эффективный диаметр молекулы.
При взаимодействии молекулы могут сближаться до некоторого наименьшего расстояния dэф, называемого эффективным диаметром молекулы. Если dэф=2r, то из <l>=<>/<z>=1/(42r2n0) имеем dэф2=1/(2<l>n0).
Эти формулы могут быть использованы для вычисления эффективного диаметра молекулы газов, длины свободного пробега и концентрации молекул.
Реальные газы.
Силы взаимодействия, проявляющиеся на расстоянии порядка 10-9-10-10 м, называют ван-дер-ваальсовыми.
Силы и потенциальная энергия межмолекулярного взаимодействия.
Между молекулами, сблизившимися на расстояние порядка 10-9-10-10 м, действуют как силы притяжения разноимённых зарядов, так и силы отталкивания одноимённых зарядов. Межмолекулярные силы взаимодействия являются короткодействующими. Принято считать силы притяжения отрицательной, силы отталкивания – положительными.
Силы отталкивания между молекулами изменяются с расстоянием значительно быстрее, чем силы притяжения; следовательно, положительная потенциальная энергия сближающихся молекул с расстоянием изменяется быстрее, чем отрицательная энергия притяжения.
Одновременное действие сил притяжения и отталкивания означает, что на молекулу действует равнодействующая межмолекулярных сил взаимодействия, т.е. полная потенциальная энергия системы равна сумме положительной энергии отталкивания и отрицательной энергии притяжения молекул.
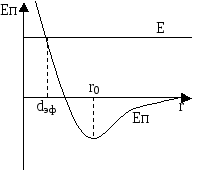
Уравнение Ван-дер-Ваальса.
(p+a/V2)(V-b)=RT – уравнение Ван-дер-Ваальса, записанное для 1 моль газа.
Поправка b, внесённая к объёму, учитывает объём, занимаемый молекулами реального газа, и мёртвое пространство, т.е. объём зазоров между молекулами при их плотной упаковке.
Поправка a/V2 к давлению учитывает силы взаимодействия между молекулами реальных газов. Эта поправка представляет собой внутренне давление, возникающее из-за взаимного притяжения между молекулами.
Константы a и b могут быть определены для каждого газа опытным путём по критическим параметрам.
Внутренняя энергия реального газа.
Внутренняя энергия реального газа определяется суммой потенциальной энергии взаимодействия молекул и кинетической энергии их движения.
Так как потенциальная энергия взаимодействия молекул зависит от их взаимного расположения, то она должна изменяться при изменении объёма газа. Потенциальную энергию взаимодействия молекул 1 моль газа можно вычислить по формуле: Eп=интг(внdV), где вн=-a/V2 – добавочное внутренне давление, входящее в уравнение Ван-дер-Ваальса.
![]()
Эта энергия имеет отрицательный знак, т.к. молекулярные силы, создающие внутреннее давление, являются силами притяжения.
Использую закон Джоуля, можно вычислить внутреннюю энергию реального газа: U=CVT-a/VM – для одного моля.
Внутренняя энергия моль газа определяется по формуле U=CVT-a/V, где a=2a, V=VM.
Внутренняя энергия реального газа зависит как от температуры, так и от объёма.
