
- •1. Основные законы химии
- •1.1 Моль. Количество вещества эквивалента (эквивалент) и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Закон эквивалентов
- •2. Строение атома и химическая связь
- •2.1 Строение атома
- •2.2 Химическая связь и строение молекул.
- •3. Энергетика химических процессов
- •3.1 Химическое сродство.
- •4. Химическая кинетика и равновесие
- •5. Дисперсные системы
- •5.1 Способы выражения концентрации раствора
- •5.3 Ионно-молекулярные (ионные) реакции обмена
- •5.4 Гидролиз солей
- •6.Окислительно-восстановительные
- •6.1 Электродные потенциалы и электродвижущие силы
- •6.2 Электролиз
- •6.3 Коррозия металлов
- •7. Комплексные соединения
- •8. Жесткость воды и методы ее устранения
- •9.Теория строения органических соединений
- •9.1 Теория а.М. Бутлерова
- •9.2 Углеродные цепи и изомерия
- •9.3 Электронные структуры органических соединений
- •10. Классификация органических соединении.
- •10.1 Радикалы
- •10.2 Функциональные группы
- •10.3 Типы реакций органических соединений
- •11. Реакции полимеризации.
- •11.1 Полимеризация органических соединений
- •11.2 Полимеризация углеводородов с двойной связью
- •11.3 Сополимеризация.
- •11.4 Ионная полимеризация.
- •11.5 Пространственная изомерия
- •12. Кристаллическое состояние
- •12.1 Основные понятия
- •12.2 Симметрия кристаллов. Система кристаллов
- •12.3 Кристаллические решетки
- •13. Сплавы
- •13.1 Диаграммы состояния металлических систем.
13. Сплавы
Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме того, металлические материалы очень многочисленны и разнообразны по своим свойствам.


Рис. 12 Рис. 13
В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие три. . .
-
В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов, отчетливо выявляемых на микрошлифе (рис. 12)
-
Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
-
При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 13). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
13.1 Диаграммы состояния металлических систем.
При изучении свойств сплавов очень большое значение имеют диаграммы состояния, характеризующие состояние сплавов различного состава при разных температурах. Такие диаграммы показывают термодинамически устойчивые состояния, т. е. состояния, отвечающие минимуму энергии Гиббса системы. Их называют также разновесными диаграммами, так как они показывают, какие фазы могут сосуществовать при данных условиях.
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и перегибам на них, вызванным тепловыми эффектами превращений, определяют температуры этих превращений. Для получения кривых охлаждения приготовляют из двух металлов изучаемой системы ряд смесей различного состава. Каждую из приготовленных смесей расплавляют. Получающиеся жидкие сплавы (расплавы) медленно охлаждают, отмечая через определенные промежутки времени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс время, а на оси ординат — температуру (рис. 14).
На рис. 14 слева показано, какой вид имеет кривая охлаждения чистого расплавленного металла. Сначала понижение температуры плавно идет по кривой ak. В точке k происходит перелом кривой, начинается образование твердой фазы (кристаллизация), сопровождающееся выделением теплоты, вследствие чего температура некоторое время остается постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается плавное понижение температуры по кривой св.
Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая на связанные с выделением теплоты процессы, происходящие уже в твердом веществе, например переход из одной кристаллической формы в другую.
Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 14 справа. Точка к, как и на первой кривой, отвечает началу затвердевания — началу выделения из сплава кристаллов одного из входящих в него металлов. При этом состав, остающегося жидким, сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Однако выделяющаяся при кристаллизации теплота все же замедляет ход охлаждения, вследствие чего в точке k происходит перелом кривой. Выпадение кристаллов и плавное понижение температуры происходят до тех пор, пока не достигается температура, при которой сплав закристаллизовывается без изменения состава. Здесь падение температуры приостанавливается точка k1). Когда кристаллизация закончится, температура падает по кривой св.
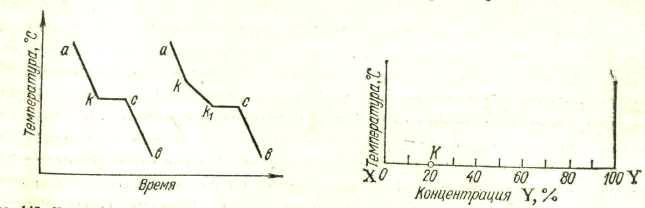
Имея достаточный набор сплавов, различающихся содержанием компонентов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. На диаграммах состояния по вертикальной оси откладывают температуру, а по горизонтальной — состав сплава (концентрацию одного из компонентов). Для сплавов, состоящих из двух компонентов, обозначаемых буквами X и Y, состав характеризуется точкой на отрезке прямой, принятом за 100%. Крайние точки соответствуют индивидуальным компонентам. Любая же точка отрезка, кроме крайних, характеризует состав двойного сплава. На рис. 15 числа указывают содержание компонента Y. Например, точка К отвечает сплаву, состоящему из 20% Y и 80% X.
Рассмотрим четыре простых случая — четыре типа диаграмм, соответствующие упомянутым выше типам сплавов: механической смеси, твердому раствору с неограниченной и с ограниченной растворимостью и химическому соединению.
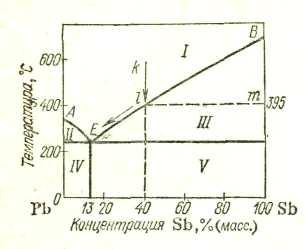
Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов. В качестве примера диаграммы этого типа на рис. 147 приведена диаграмма состояния системы Рb—Sb. Точки А и В на диаграмме — это температуры плавления компонентов системы: свинца (327°С) и сурьмы (631°С). В сплавах рассматриваемого типа добавка одного компонента к другому, согласно закону Рауля, понижает температуру начала его кристаллизации (затвердевания). Кривая АЕ показывает температуру кристаллизации свинца из расплавов, богатых свинцом, а кривая BE— температуру кристаллизации сурьмы из расплавов, богатых сурьмой. Видно, что по мере увеличения содержания второго компонента температуры кристаллизации как свинца, так и сурьмы понижаются. Точка Е принадлежит обеим кривым: из расплава, состав которого отвечает этой точке, кристаллизуются одновременно оба металла. Эта совместная кристаллизация происходит при самой низкой температуре. Отвечающий точке Е состав называется эвтектическим составом, а соответствующий сплав — эвтектическим сплавом или просто эвтектикой (от греческого «эвтектикос» — хорошо плавящийся). Для системы Pb—Sb эвтектика состоит из 13% Sb и 87% Рb; она плавится и кристаллизуется при 246 °С.
Рассмотрим подробнее процесс "кристаллизации расплаая. Пусть это будет расплав, содержащий 40% Sb и 60% Рb (точка k на рис. 16). При охлаждении этого расплава до 395 °С (точка l) из него начнут выпадать кристаллы. Это будут кристаллы избыточного по сравнению с эвтектикой компонента, в данном случае — сурьмы. Теперь сплав стал двухфазным. На диаграмме состояния ему отвечают две точки: точка l (расплав) и точка m(кристаллы сурьмы). Кристаллизация некоторого количества сурьмы изменит состав расплава; он станет беднее сурьмой и, следовательно, богаче свинцом. Точка на диаграмме, отвечающая расплаву, сместится немного влево. Поскольку охлаждение продолжается, эта точка вновь дойдет до кривой — из расплава снова выпадет какое-то количество кристаллов сурьмы. Таким образом, по мере охлаждения и кристаллизации точка, отвечающая расплаву, двигается вниз и влево по кривой кристаллизации сурьмы, а точка, отвечающая кристаллам сурьмы, — вниз по правой вертикальной оси. Когда расплав достигнет эвтектического состава, из него станут выпадать очень мелкие кристаллы обоих компонентов (эвтектика), пока не закристаллизуется все взятое количество вещества. Получившийся сплав будет представлять собою смесь эвтектики с кристаллами сурьмы.
Если исходить из расплава, содержащего небольшой процент сурьмы (меньше эвтектического), то весь процесс будет происходить аналогично рассмотренному, с той разницей, что вначале будут выпадать кристаллы не сурьмы, а свинца. Полученный сплав будет иметь структуру, представляющую собой смесь эвтектики с кристаллами свинца. Наконец, если исходить из расплава эвтектического состава, то весь сплав закристаллизуется при 246 °С и будет представлять собой эвтектику.
Если верхние кривые диаграммы на рис. 16 (АЕ и BE) показывают температуру начала кристаллизации, то нижняя — горизонталь, проходящая через точку Е, — показывает температуру окончания кристаллизации сплава. Как видно, для систем имеющих диаграммы рассматриваемого типа, температура окончания кристаллизации не зависит от состава сплава.
При плавлении твердых сплавов горизонталь, проходящая через точку Е, показывает температуру начала плавления. В рассматриваемом случае эта температура не зависит от состава сплава, потому что плавление начинается с эвтектики, входящей в состав всех сплавов системы (кроме индивидуальных компонентов). При этом температура сплава будет оставаться постоянной, пока вся имеющаяся в нем эвтектика не расплавится. Дальнейшее нагревание приведет к повышению температуры — начнут плавиться кристаллы чистого компонента, которые находились в исходном сплаве в смеси с эвтектикой. Состав расплава будет обогащаться этим компонентом, и точка, отвечающая расплаву, будет двигаться по соответствующей ветви верхней кривой. Когда плавление закончится, т. е. когда твердая фаза исчезнет, тогда состав расплава станет таким же, каким был состав исходного сплава. Таким образом, если исходить из твердого сплава, то горизонталь, проходящая через точку Е, показывает температуру начала, а кривые АЕ и BE — окончания плавления.
Из сказанного ясно, что области I на диаграмме рис. 16 отвечает расплав, областям II и III соответствует сосуществование расплава с кристаллами избыточного компонента, областям IV и V отвечает смесь эвтектики с зернами свинца (область IV) или сурьмы (область V).
Как уже говорилось, по горизонтальной оси диаграмм состояния откладывается состав взятого сплава. Однако для областей, отвечающих равновесию двух фаз, по этой оси можно также устанавливать составы этих фаз. Пусть, например, сплав 5% Sb и 95% Рb нагрет до 270 °С. Такому сплаву отвечает точка а на диаграмме состояния (рис. 17). Проведем через эту точку горизонталь до пересечения с ближайшими линиями диаграммы. Мы получим точки b и с. Они показывают, что взятому сплаву при 270 °С отвечает равновесие кристаллов свинца (точка b) с расплавом, состав которого определяется абсциссой точки с (приблизительно 10% Sb и 90% Рb).
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии. На рис. 18 приведена диаграмма состояния системы Ag—Аu, представляющая собой простейший пример диаграмм этого типа, Как и в предыдущих случаях, точки А и В показывают температуры плавления компонентов. Вид кривых плавления (нижняя кривая) и затвердевания (верхняя кривая) обусловлен в этом случае - тем, что кристаллы, выделяющиеся при охлаждении расплава, всегда содержат оба компонента (кроме, конечно, кристаллизации чистых серебра или золота).
Рассмотрим, как происходит кристаллизация расплавов в этом случае. Пусть исходный жидкий сплав соответствует точке d на диаграмме (рис. 18). При охлаждении его до температуры t1 (точка е) начинается кристаллизация. Кристаллы представляют собой твердый раствор, более богатый тугоплавким компонентом— золотом (точка р). Поэтому в ходе кристаллизации жидкая фаза обедняется тугоплавким компонентом, и точка диаграммы, отвечающая расплаву, смещается несколько влево. По мере охлаждения эта точка движется вниз, вновь доходит до кривой и процесс кристаллизации продолжается. Таким образом, охлаждение расплава сопровождается выпадением кристаллов твердого раствора, обогащенных тугоплавким компонентом — золотом, и обогащением расплава легкоплавким компонентом — серебром. Соответствующие точки на диаграмме при этом перемещаются: состав жидкой фазы изменяется по верхней линии, а состав твердого раствора — по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении такой температуры 1% при которой образующиеся кристаллы имеют состав исходного сплава (точка r).
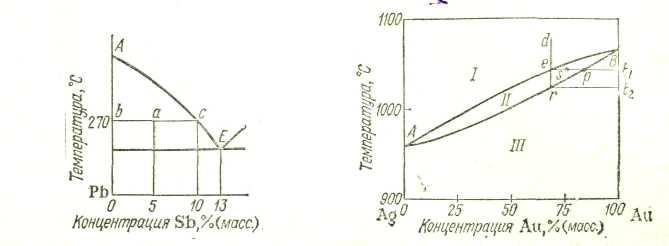
Таким образом, области I на диаграмме состояния рассматриваемой системы (рис. 18) отвечает расплав, области II— сосуществование расплава и кристаллов твердого раствора, области III твердый раствор. При равновесии точки обеих кривых на диаграмме связаны между собой: каждой температуре отвечает расплав определенного состава и кристаллы тоже определенного состава, но другого, чем состав расплава (например, точке е отвечает точка р).
В ходе процесса кристаллизации температура системы понижается и равновесие между расплавом и кристаллами, образовавшимися ранее, т. е. при более высокой
Рис. 19
температуре, нарушается. Поэтому кристаллизация сопровождается диффузией, в результат чего при медленном проведении процесса зерна всего сплава получаются однородными и имеют одинаковый состав. При быстром охлаждении процессы диффузии не успевают происходить и сплав получается неоднородным. Как и в предыдущем случае, по горизонтальной оси диаграммы можно устанавливать составы равновесных фаз, в данном случае — расплава и находящегося в равновесии с ним твердого раствора. Например, система, которой отвечает точка s, состоит из расплава, состав которого отвечает точке е, и кристаллов состава, соответствующего точке р.

Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии. В сплавах этого типа, образуемых компонентами X и Y, могут существовать жидкая фаза и два твердых раствора: раствор компонента X в Y и раствор компонента Y в X. В простейшем случае эти два твердых раствора образуют эвтектику; к такому типу принадлежит система Pb—Sn, диаграмма состояния которой приведена на рис. 19. Отметим прежде всего, что области I здесь отвечает расплав, области II — твердый раствор олова в свинце, области III — твердый раствор свинца в олове.
Для того чтобы понять, существованию каких фаз отвечают другие области на диаграмме и кривые на ней, рассмотрим, как протекает в системе данного типа кристаллизация расплавов.
Сначала будем исходить из жидкого сплава, богатого свинцом (точка d на рис. 19). При охлаждении этого расплава до температуры t1 (точка е) начнется выделение кристаллов твердого раствора олова в свинце. Состав этих кристаллов отвечает точке р; они богаче свинцом, чем исходный расплав, так что при кристаллизации расплав обедняется свинцом. Как и в предыдущих случаях, точки на диаграмме, отвечающие расплаву и образующимся кристаллам, перемещаются: состав жидкой фазы изменяется по линии АЕ, а состав кристаллов — по линии AD. По достижении температуры t2(точка r) образующиеся кристаллы имеют состав исходного сплава. Если процесс проводится достаточно медленно, то при температуре t2 кристаллизация заканчивается, подобно тому, как это происходит в системах с неограниченной взаимной растворимостью (см. выше).
Кривая ADF показывает растворимость олова в твердом свинце при различных температурах. Видно, что растворимость максимальна, при 183,3 °С. Поэтому при охлаждении кристаллов до температуры t3 (точка s) твердый раствор делается насыщенным. В нем начнет протекать превращение в твердом состоянии: кристаллы твердого раствора на основе свинца, состав которых отвечает точке s, будет превращаться в кристаллы твердого раствора на основе олова, состав которых соответствует точке q. При постоянной температуре кристаллы этих двух твердых растворов будут находиться в равновесии. Однако при дальнейшем охлаждение равновесие нарушится и превращение одних кристаллов в другие будет продолжаться. При этом кристаллы твердого раствора на основе свинца будут обедняться оловом — их состав будет изменяться по кривой DF; одновременно по кривой CG будет изменяться состав кристаллов твердого раствора на основе олова.
Теперь рассмотрим охлаждение жидкого сплава, не столь богатого свинцом (точка f). По охлаждении до температуры (точка g) из расплава начнут выделяться кристаллы твердого раствора на основе свинца; их состав отвечает точке h. По мере выделения этих кристаллов, расплав обогащается оловом: его состав изменяется по линии АЕ, а состав выделяющихся кристаллов — по линии AD. Когда точка, отвечающая расплаву, достигает точки Е, — из расплава выделяются кристаллы обоих твердых растворов; при этом состав кристаллов твердого раствора на основе свинца отвечает точке D, а состав кристаллов твердого раствора на основе олова — точке С. Ясно, что точка Е представляет собой эвтектическую точку, а выделяющаяся смесь кристаллов — эвтектическую смесь.
В области температур ниже 183,3 °С растворимость свинца в олове и олова в свинце с понижением температуры уменьшается. Поэтому при дальнейшем охлаждении сплава образовавшиеся кристаллы изменяют свой состав. Состав кристаллов твердого раствора олова в свинце изменяется по кривой DF, а кристаллов твердого раствора свинца в олове — по кривой CG.
Аналогично протекает кристаллизация расплавов, богатых оловом. В этом случае кристаллизация начинается с выделения кристаллов твердого раствора на основе олова.
На основании сказанного можно заключить, что областям IV и V на диаграмме отвечает сосуществование жидкого расплава и кристаллов твердого раствора на основе свинца (область IV) или на основе олова (область V), а областям VI и VII — смеси кристаллов эвтектики с кристаллами твердого раствора на основе
свинца (область VI) или твердого раствора на основе олова (область VII).
Диаграмма состояния для сплавов, образующих
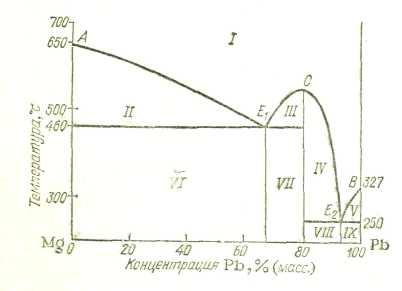
Рис. 20
Металлы образуют друг с другом многочисленные соединения, называемые интерметаллическими. Энтальпии образования подобных соединений обычно невелики; лишь в некоторых случаях (например, при взаимодействии алюминия с расплавленной медью) их образование сопровождается значительным экзотермическим эффектом. Многие металлы образуют по несколько соединений друг с другом, например, AuZn, Au3Zn5, AuZn3; Na4Sn, NaSn, NaSn2.
На рис. 20 приведена диаграмма состояния системы Mg—Pb. Эта система служит простейшим примером систем, в которых образуются химические соединения: свинец образует с магнием только одно соединение Mg2Pb, а в твердом состоянии эти металлы взаимно нерастворимы.
От рассмотренных ранее диаграмм эта диаграмма отличается наличием максимума на кривой начала кристаллизации. Этот максимум (точка С) отвечает температуре плавления соединения Mg2Pb. Абсцисса точки максимума указывает состав соединения. На диаграмме имеются две эвтектики Е1 и E2 Эвтектика Е1 представляет собой смесь кристаллов Mg и Mg2Pb, а эвтектика Е2 — кристаллов Рb и Mg2Pb.
Таким образом, диаграмма системы с химическим соединением как бы составлена из двух диаграмм первого типа. Если компоненты системы образуют между собой два или более химических соединения, то диаграмма как бы составлена из трех, четырех и более отдельных диаграмм первого типа.
Кристаллизация сплавов в этом и в подобных случаях происходит аналогично кристаллизации сплавов, образующих диаграммы первого типа. Отличие состоит в том, что, кроме выделения кристаллов индивидуальных компонентов, происходит еще образование кристаллов соединения. По линии АЕ1 из расплавов при охлаждении выделяется магний, по линии Е2В — свинец и по линии Е1СЕ2 — Mg2Pb. Так, если охлаждать жидкий сплав, содержащий 40% РЬ (60% Mg), то из него сначала будут выделяться кристаллы магния. Когда температура понизится до 460°С, вся оставшаяся еще жидкой часть сплава начнет затвердевать при этой температуре, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения Mg2Pb.
При охлаждении жидкого сплава, содержащего 75% РЬ, сначала будут выделяться кристаллы Mg2Pb. Это будет происходить до тех пор, пока температура не снизится до 460 °С — точки образования эвтектики. Аналогичные процессы с выделением эвтектики Е2 (при 250 °С) будут протекать при содержании в сплаве более 80% Рb.
Нетрудно понять, что области I на, рис. 20 отвечает жидкий сплав, областям II—V—равновесия жидкого сплава и соответствующих кристаллов (в области II — кристаллы Mg, в. областях III и IV— кристаллы Mg2Pb, в области V — кристаллы РЬ), а областям VI — IX — твердые сплавы [Mg + эвтектика Е1 (VI), Mg2Pb + эвтектика Е1 (VII), Mg2Pb + эвтектика Е2 (VIII), Pb + эвтектика E2 (IX)].
Мы рассмотрели наиболее простые, но в то же время важнейшие типы диаграмм состояния. Для многих систем диаграммы состояния носят значительно более сложный характер. Так, ряд металлов и сплавов испытывают превращения в твердом состоянии, переходя из одной модификации в другую. На диаграмме состояния появляются при этом кривые, разграничивающие области устойчивости этих модификаций.
Существуют методы построения диаграмм состояния тройных систем — систем, состоящих из трех компонентов.
Для технически важных систем диаграммы состояния изучены и приводятся в специальной литературе. Они имеют широкое применение в различных областях науки и техники, служат научной основой при подборе сплавов, обладающих заданными свойствами, при изыскании методов термической обработки сплавов, при разработке и создании новых сплавов. Примером системы, имеющей очень большое практическое значение, может служить система Fe — С.
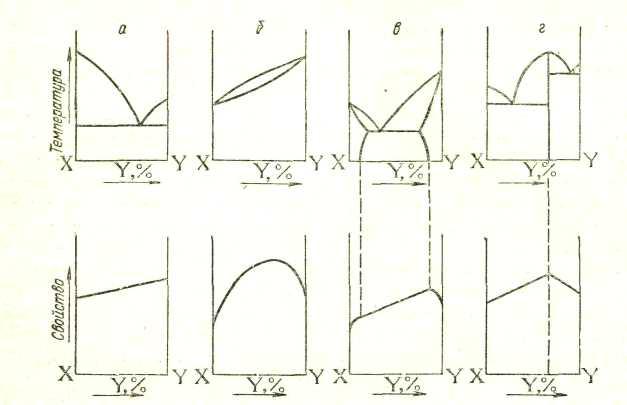
Рис.21
ЗАДАЧИ
1. При нормальных условиях 1 г воздуха занимает объем 733 мл. Какой объем займет та же масса воздуха при 0 С0 и давлении, равном 93,3 кПа (700 мм.рт.ст.)?
2. При восстановлении 1,8 г оксида металла израсходовано 833 мл водорода при н.у. Вычислить эквивалент оксида и металла.
3. Давление газа, занимающего объем 2,5 л равно 121,6 кПа. Чему равно давление, если, не изменяя температуру, сжать газ до 1 л?
4. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалент металла.
5. На нейтрализацию 2,45 г кислоты идет 2,0 г гидроксида натрия. Определить эквивалентную массу кислоты.
6. На нейтрализацию 0,943 г фосфористой кислоты H PO израсходовано 1,291 г КОН. Вычислите эквивалент кислоты и ее основность.
7. Напишите уравнения реакций Fe(OH)3 с соляной кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид; б) гидроксохлорид; в) хлорид. Вычислите эквивалент Fe(OH)3 в каждой из этих реакций.
8. При взаимодействии 1,84 г щелочного металла с водой выделилось 896 мл водорода, измеренного при нормальных условиях. Определить эквивалентные массы металла и образовавшиеся соединения.
9. Для растворения 16,8 г металла потребовалось 14.7 г серной кислоты. Определите эквивалентную массу металла и объем выделившегося водорода при 17 С и давлении 740 мм.рт.ст.
10. При нагревании 21,4 г металла было получено 23,4 г оксида. Определите эквивалент металла.
11. Определите эквивалентную массу металла, если 0,3452 его вытесняют из воды водород объемом 180 мл при температуре 15 С и давлении 0,99*105 Па.
12. Один оксид марганца содержит 22,56% кислорода, а другой 50,50%. Вычислить эквиваленты марганца в этих оксидах и составьте их формулы.
13. Вычислите эквиваленты Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
14. Вычислить эквивалент кобальта в соединении его с серой, зная, что на 1 г кобальта приходится 0,545 г серы, валентность которой 2.
15. Магний массой 2 г вытесняет по отдельности 2 л водорода при 170С и 0,99*10 Па, серебро массой 17,7 г и медь массой 10,5 г из соединений этих элементов. Найдите эквивалентные массы этих элементов.
16. Вычислите атомную массу двухвалентного металла и определите, какой это металл, если 8,34 г металла окисляются 0,740 л кислорода при 200С и 750 мм рт.ст.
17. Вычислить массу 1 л кислорода при 91,5 кПа и 330С.
18. Элемент образует оксид, содержащий 31,58% O. Вычислить эквивалент элемента.
19. Мышьяк образует два оксида, из которых один содержит 65,2% мышьяка, а другой - 75,8%. Определите эквивалентную массу мышьяка в том и другом случае.
20. При давлении 98,7 кПа и температуре 910С некоторое количество газа занимает объем 608 мл. Найти объем газа при н.у.
21. При нагревании 21,4 г металла было получено 23,4 г. оксида. Определить эквивалент металла.
22. Расчетным путем покажите, одинаковое ли количество молекул содержится в 1 эквиваленте диоксида серы SO2 и триоксида серы SO3 , взятых при одинаковых условиях.
23. Определите массу и объем 24,08*1023 молекул сероводорода H2S при 33 С и давлении 1,06кПа.
24. Расчетным путем покажите, одинаковое ли количество молекул в 1 эквиваленте диоксида и оксида азота при одинаковых условиях.
25. Сопоставить число молекул, содержащихся в 1 г H2SO4 с числом молекул, содержащихся в 1 г HNO3.
26. Определить массу и объем 3,01* 1023 молекул метана при 22 С и 81,06 кПа.
27. В каком объеме хлора (20 С, 745 мм.рт.ст.) содержится 10 молекул?
28. Покажите, одинаковы ли количество молекул содержащихся в 1 эквиваленте триоксида серы и сероводорода.
29. Какой объем СО2 получается при сгорании 2 л бутана? Объемы этих газов измерены при 27 С и 740 мм.рт.ст.
30. Вычислите массу одного атома кальция в граммах.
31. Найдите, сколько молекул содержится в 2 молях воды и какой объем они займут при 40С и 105 Па
32. Какое число молекул содержат 0,01 моля кислорода, 1/50 молей атомов кислорода, 1/25 эквивалентной массы кислорода?
33. Определите, какое количество молекул содержится в 1 мл брома (р=3,1 г/мл)?
34. Взяты равные массы кислорода, водорода и метана при 80С и 0,95*105 Па. Найти отношение объемов взятых газов.
35. Рассчитать массу (в граммах) одной молекулы аммиака при 70С и 101,3 кПа.
36. Рассчитайте массу (в граммах) 24,08*1021 молекул сероводорода.
37. Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание СО2 составляет 0,03% (давление нормальное)?
38. Покажите, одинаковое ли количество молекул содержится в эквиваленте оксида азота и оксида углерода.
39. Вычислить объем, занимаемый 5,5 г СО при 110С и 102,6 кПа.
40. Сколько молекул содержится в 1 мл любого газа, измеренного при 270С и р = 740 мм рт.ст.?
41. Расчетным путем покажите, одинаковое ли количество молекул содержится в 0,1 эквиваленте диоксида серы SO2 и сероводорода H2S, взятых при одинаковых условиях.
42. Найдите, сколько молекул содержится в 2 молях воды и какой они займут объем при 4 С и 760 мм рт.ст.
43 . Какой элемент имеет в атоме три электрона, для каждого из которых n=3 и 1=1? Чему равно для них значение магнитного квантового числа? Должны ли они иметь антипараллельные спины?
44. Укажите значения квантовых чисел n и 1 для внешних электронов в атомах элементов с порядковыми номерами 11, 14, 20, 23, 33.
45. Какое значение имеет: а) орбитальное квантовое число для энергетических подуровней, емкость которых равна 10 и 14; б) главное квантовое число для энергетических уровней, емкость которых равна 32, 50 или 72?
46. Составьте таблицу, в которой покажите для s-, p-, d- и f-энергетических подуровней: значений 1; число АО; емкость, выраженную электронной формулой подуровня.
47. Учитывая емкость энергетических уровней, покажите, сколько электронных слоев содержит электронная оболочка атома из 18, 36, 54 или 86 электронов.
48. В атоме элемента находится 5 энергетических уровней, на 5-м энергетическом уровне - 7 внешних электронов. Какими квантовыми числами они характеризуются?
49. Каждой сумме n+1 соответствует n значений для каждого квантового числа, например, если n+l=5, то n и 1 могут иметь значения: n=1, 2, 3, 4, 5; 1=4, 3, 2, 1, 0. Все ли из этих сочетаний n и 1, дающих сумму 5, возможны? Сколько АО и какие дадут реализуемые сочетания n и 1?
50. Масса ядра атома некоторого изотопа равна 181 уг.ед. В электронной оболочке атома содержится 73 электрона. Указать: а) сколько протонов и нейтронов содержится в ядре атома; б) электронную формулу элемента; в) какой это элемент.
51. Энергетическая емкость атома некоторого элемента 35 электронов. Сколько протонов содержится в ядре атома? Указать порядковый номер элемента и его название. Составить электронную формулу.
52.
Указать число электронов, отдаваемых
электронейтральным атомам при следующих
превращениях: Mg
 Mg2+;
A1
Mg2+;
A1
 A13+;
Pb
A13+;
Pb
 Pb2+;
Cr
Pb2+;
Cr
 Cr3+.
Составить электронные формулы атомов
и ионов.
Cr3+.
Составить электронные формулы атомов
и ионов.
53. К каждому из перечисленных ниже ионов прибавлено по 2 электрона: As5+; Ti4+; V5+. Написать электронные формулы исходных ионов и образующихся частиц.
54. Представить электронные формулы ионов и отвечающих им ионов следующих элементов: а) S, S2-, S4+, S6+; б) N3-, N, N3+, N5+.
55. Сколько валентных электронов и валентных АО имеют атомы: С и Si; N и P; O и S? Чему равна максимальная ковалентность элементов 2-го и 3-го периодов?
56. Чему равна валентность и степень окисления азота и углерода в молекулах: N2, NH3, N2H4, NH2OH, NF3, CH4, CCl4, C2H6, C2H4, C2H2?
57. Что называют линией связи и углом связи, или валентным углом? Как называют связь, которая образуется перекрыванием электронных облаков вдоль линии связи? Приведите примеры образования σ-связи.
58. Почему при наличии одной связи между атомами она может быть только σ-связью? При каких условиях образуются π-? Для всех ли форм электронных облаков возможно образование этих связей?
59. Приведите примеры молекул, которые содержат: а) только σ-связи; б) одну σ- и одну π-связи. Сколько σ- и π-связей содержат молекулы: CC14, SO3, C2H4, C2H2?
60. Перечислите возможные типы гибридизации s- и p-орбиталей. В каком из них гибридные орбитали по энергии и форме в наибольшей степени приближаются к исходной s- или p-орбитали?
61. Какие АО не могут участвовать в гибридизации? Возможна ли гибридизация орбиталей: а) 3p- и 4s-; б) 4s- и 5р-; в) 4s- и 4р-; е) 4s-, 4p- и 4d-?
62. Какое влияние оказывает не поделенная электронная пара на углы между связями? Как это можно объяснить? Почему угол НОН в молекуле Н2О меньше угла HNH в молекуле NH3?
63. Какую связь называют водородной и почему ее образуют только те атомы водорода, которые связаны с атомами наиболее электроотрицательных элементов? Назовите их.
64. Почему для молекул H2S и НС1 в отличие от Н2О и НF образование водородных связей не характерно?
65. Чем объяснить значительно более высокие температуры плавления и кипения воды и фтороводородной кислоты по сравнению с теми, которые должны соответствовать их молярным массам?
66. Какое значение для жизни имеет наличие водородных связей между молекулами воды? Какое биологическое значение имеет водородная связь?
67. Что называют внутримолекулярной водородной связью? Приведите примеры.
68. Определите количество теплоты, выделяющейся при взаимодействии 50 г Р2О5 с водой по реакции Р2О5 + Н2О = 2НРО3, если тепловые эффекты реакции равны: 2Р + 5/2О2 = Р2О5; ∆Нр =-1549,0 кДж; 2P + Н2 + 3О2 = 2НРО3; ∆Нр =-1964,8 кДж.
69. При сгорании 9,3 г фосфора выделяется 229,5 кДж теплоты. Рассчитайте Н298 оксида фосфора (V).
70. Вычислите теплоту разложения 1 кг FeSO4 по уравнению: 2FeSO4(к) = Fe2O3(к) + 2SO2(г) + 0,5O2(г).
71. Процесс гашения оксида кальция представлен следующим термохимическим уравнением: СаО + Н2О = Са(ОН)2 + 16 ккал. Сколько теплоты выделится при гашении 1 т извести, содержащей 20% посторонних примесей.
72. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO(к) + СО(г) = Fe(к) + CO2(г); ∆Н=-13,18 кДж;
СО(г) + 1/2О2(г) = СО2(г); ∆Н=-283 кДж;
Н2(г) + 1/2О2(г) = H2O(г); ∆Н=-241,83 кДж.
73. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений: Ca(к) + 1/2О2(г) = СаО(к); ∆Н=-635,6 кДж; Н2(г) + 1/2О2(г) = Н2О(ж) ∆Н=-285,84 кДж; СаО(к) + Н2О(ж) = Са(ОН)2(к); ∆Н=-65,06 кДж.
74. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
Н2(г) + 1/2О2(г) = Н2О(ж); ∆Н=-285,84 кДж;
С(к) + О2(г) = СО2(г); ∆Н=-393,51 кДж;
СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г); ∆Н=-890,31 кДж.
75. Подсчитав ∆S0 реакций, определите, какая из двух реакций термодинамически возможна: FeO+CO = Fe + CO2; FeO + H2 = Fe + H2O(г).
76. По известным значениям стандартной энтропии для приведенных ниже реакций определите, какие из этих реакций являются термодинамически возможными в изолированной системе:а) CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г);
б) А12(SO4)3(к) = А12О3(к) + 3SO3(г).
77. Энтропия реакции зависит не столько от химической индивидуальности реагентов и продуктов, сколько от агрегатного состояния веществ и их количеств, участвующих в реакции. Укажите, какое значение (>0,<0) имеет стандартная энтропия реакций: а) 2О3(г) = 2О2(г); б) SO2(г) + 2H2S(г) = 2S(т) + 2Н2О(ж); в) J2(г) = 2J(г). Подтвердите Ваш ответ расчетом с использованием справочных данных.
78. В изолированной системе протекают следующие процессы: 3Fe(т) + 4Н2О(г) = 4Н2(г) + Fe3O4. На основании определенного значения ∆S укажите направление реакции.
79.
Вычислите значение ∆Н298,
∆G298,
∆S298
для процесса МеСО3(к)
 МеО(к)
+ СО2(г)
и составьте ряд термической стабильности
карбонатов MgCO3,
BaCO3,CaCO3.
Как влияет на течение этих процессов
температура?
МеО(к)
+ СО2(г)
и составьте ряд термической стабильности
карбонатов MgCO3,
BaCO3,CaCO3.
Как влияет на течение этих процессов
температура?
80. В каком направлении будет протекать реакция: Fe2O3(k) + 3H2(г) = 3H2O(г) + Fe(k).
81. Как ведет себя магний в атмосфере кислорода, углекислого газа, паров воды? Ответ подтвердите расчетами.
82. Вычислите Н0, S0, Gт реакции, протекающей по уравнению TiO2(k) + 2C(k) = Ti(k) + CO2(г). Возможна ли реакция восстановления TiО2 углеродом при температурах 1000 и 3000К?
83. Определите, при какой температуре начинается реакция восстановления Fe3O4, протекающая по уравнению:
Fe3O4(k) + CO(г) = 3Fe(k) + CO2(г); ∆Н = +34,55 кДж.
84. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению:
РС15(г) = РС13(г) + С12(г); ∆Н = +92,59 кДж.
85.
Тепловой эффект и изменение энергии
Гиббса при 250С
для реакции СО2(г)
+
4Н2(г)
= СН4(г)
+
2Н2О(ж)
соответственно равны -253,02 кДж моль-1;
-130,1 кДж
моль-1;
-130,1 кДж моль-1.
Определите ∆S0
для этой реакции.
моль-1.
Определите ∆S0
для этой реакции.
86. Подсчитав ∆G298 реакции, определите возможность протекания реакции Р2О5(к) + 3Н2О(ж) = 2РН3(г) + 4О2(г) при стандартных условиях.
87.
Установите возможность или невозможность
самопроизвольного протекания реакции
при температуре 298 К: СО2(г)
 СО(г)
+ 1/2O2(г).
СО(г)
+ 1/2O2(г).
88. Установите возможность самопроизвольного протекания реакции ВаО + СO2 = BaСO3 при температуре 298 К.
89.
Установите возможность самопроизвольной
реакции разложения сульфатных соединений
CaSO4
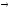 CaO + SO3;
CaSO4
CaO + SO3;
CaSO4
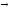 CaO
+ SO2
+
1/2O2.
CaO
+ SO2
+
1/2O2.
90. Образование какого оксида СО или СО2 - наиболее вероятно при сгорании угля. При ответе используйте данные ∆Н0, S0, ∆G0.
91. Вычислите ∆G298 окисления аммиака кислородом с образованием NO или N2. Какой из этих процессов наиболее вероятен при сжигании аммиака?
92. Какая из приведенных ниже реакций
РС13(ж) + 3Н2О(ж) = Н3РО3(ж) + 3НС1(ж); AsCl3(ж) + 3H2O(ж) = H3AsO3(ж) + 3HC1(ж)
обратима в обычных условиях, а какая нет? При обосновании ответа вычислите ∆G298 реакций.
93.
Начальные
концентрации веществ, участвующих в
реакции СО + 2Н2О
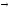 СО2
+ Н2
были равны: СО = 0,3; Н2О
= 0,4; СО2
= 0,4; Н2
= 0,05. Каковы концентрации всех веществ
в момент, когда прореагировала 1/2
оксида углерода?
СО2
+ Н2
были равны: СО = 0,3; Н2О
= 0,4; СО2
= 0,4; Н2
= 0,05. Каковы концентрации всех веществ
в момент, когда прореагировала 1/2
оксида углерода?
94.
Начальные концентрации веществ,
участвующих в реакции N2
+ 3H2
↔ 2NH3,
равны (моль л-1):
N2
=0,2; H2
= 0,3; NH3=0.
Каковы концентрации азота и водорода
в момент, когда концентрация аммиака
составит 0,1 моль
л-1):
N2
=0,2; H2
= 0,3; NH3=0.
Каковы концентрации азота и водорода
в момент, когда концентрация аммиака
составит 0,1 моль л-1?
л-1?
95. Написать выражение скорости химической реакции, протекающей в гомогенной системе по схеме А + 2В = С, и определить, во сколько раз увеличится скорость реакции, если: а) концентрация А увеличится в 2 раза; б) концентрация В увеличится в 2 раза; в) концентрация А и В увеличится в 2 раза.
96. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 = 2NO2 возросла в 1000 раз?
97.
Реакция между веществами А и В выражается
уравнением 2А + В ↔2С. Начальная
концентрация вещества А равна 0,3
моль л--1,
а вещества В - 0,5 моль
л--1,
а вещества В - 0,5 моль л-1.Константа
скорости реакции равна 0,8 л2
л-1.Константа
скорости реакции равна 0,8 л2 моль-2
моль-2 мин-1.
Рассчитайте начальную скорость прямой
реакции и скорость по истечении некоторого
времени, когда концентрация вещества
А уменьшится на 0,1 моль.
мин-1.
Рассчитайте начальную скорость прямой
реакции и скорость по истечении некоторого
времени, когда концентрация вещества
А уменьшится на 0,1 моль.
98.
Реакция идет по уравнению 2NO
+ O2
↔ 2NO2.
Начальные концентрации реагирующих
веществ были (моль л-1):
СNO
=
0,8; СО
= 0,6. Как изменится скорость реакции,
если концентрацию кислорода увеличить
до 0,9 моль
л-1):
СNO
=
0,8; СО
= 0,6. Как изменится скорость реакции,
если концентрацию кислорода увеличить
до 0,9 моль л-1;
а концентрацию оксида азота до 1,2
моль
л-1;
а концентрацию оксида азота до 1,2
моль л-1?
л-1?
99.
Чему равна скорость химической реакции,
если концентрация одного из реагирующих
веществ в начальный момент была равна
1,2 моль л--1,
а через 50 мин стала равной 0,3 моль
л--1,
а через 50 мин стала равной 0,3 моль л-1?
л-1?
100.
При взаимодействии SO2
и О2
концентрация последнего уменьшилась
за 1 ч на 0,25 моль л-1.
Как изменится при этом концентрация
SO2
и чему равна средняя скорость реакции?
л-1.
Как изменится при этом концентрация
SO2
и чему равна средняя скорость реакции?
101. На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз (γ = 2)?
102. При повышении температуры на 600 скорость реакции увеличилась в 4000 раз. Вычислить γ.
103. При повышении температуры на 420 скорость реакции увеличилась в 320 раз. Вычислить γ.
104. Реакция заканчивается при 70 за 120 с, а при 270 за 60 с. Вычислить энергию активации.
105. Реакция при 200 протекает за 60 с. Сколько времени потребуется для завершения реакции при 400, если энергия активации равна 7980 кал?
106.
Константа скорости реакции при 600 К
равна 7,5, а при 650 К - 4,5 10-2.
Вычислить энергию активации, а также
константу скорости реакции при 700 К.
10-2.
Вычислить энергию активации, а также
константу скорости реакции при 700 К.
107. При 393 К реакция заканчивается за 18 мин. Через сколько времени эта реакция закончится при 453 К, если γ равен 3?
108. При повышении температуры на 200 скорость реакции возросла в 9 раз. Чему равен температурный коэффициент этой реакции?
109.
Константа равновесия системы 2NO + O2
↔2NO2
найдена равной 1,21. Равновесные концентрации
[NО] = 0,72 и [NO2]
= 0,84 моль л-1.
Найти первоначальную и равновесную
концентрацию кислорода.
л-1.
Найти первоначальную и равновесную
концентрацию кислорода.
110. Куда сместится равновесие в системе
MgC12 + 2NH4OH Mg(OH)2 + 2NH4C1 при добавлении концентрированного раствора хлорида аммония, т.е. будет ли Mg(OH)2 растворяться или осадок будет увеличиваться?
111.
Константа равновесия гомогенной системы
СО(г)
+ Н2О(г)
↔ СО2(г)
+ Н2(г)
при некоторой температуре равна 1.
Вычислите равновесные концентрации
всех реагирующих веществ, если исходные
концентрации [CO] = 0,1 моль л-1;
[H2O]
= 0,4 моль
л-1;
[H2O]
= 0,4 моль л-1
л-1
112.
Куда сместится равновесие в системе
AlO + H2O
↔ AlO
+ H2O
↔ AlO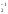 +
2ОН-
; а) при разбавлении раствора; б) при
прибавлении щелочи; в) при прибавлении
кислоты?
+
2ОН-
; а) при разбавлении раствора; б) при
прибавлении щелочи; в) при прибавлении
кислоты?
113. Реакция СО + С12 ↔ СОС12 протекает в объеме 10 л. Состав равновесной смеси: 14 г СО; 35,5 гС12 и 49,5 г СОС12. Вычислить константу равновесия реакции.
114.
Равновесные концентрации веществ в
обратимой реакции 2SO2
+ O2
↔ 2SO3
составляют (моль л-1):
[SO2]
= 0,0002; [O2]
= 0,004; [SO3]
= 0,003. Вычислить исходные концентрации
кислорода и оксида серы (IV). Вычислить
константу равновесия.
л-1):
[SO2]
= 0,0002; [O2]
= 0,004; [SO3]
= 0,003. Вычислить исходные концентрации
кислорода и оксида серы (IV). Вычислить
константу равновесия.
115. В сосуд объемом 0,5 л помещено 0,5 моля водорода и 0,5 моля азота. К моменту равновесия образовалось 0,02 моля аммиака. Вычислить константу равновесия.
116. Как изменится равновесие в системе Zn2++H2O↔ZnOH++ H+: а) при добавлении кислоты; б) при добавлении щелочи?
117. Вычислить константу равновесия реакции Н2 + J2 2HJ, происходящей в сосуде объемом 2 л, если первоначальные количества веществ были следующие: 0,2 г Н2; 0,12 г J2 и к моменту равновесия прореагировало 20% водорода.
Кристаллическая
сода Na2СO3 10Н2О
какой массы потребуется для приготовления
раствора объемом 1,2 л, если его: а) молярная
концентрация равна 0,2 моль/л;
б) эквивалентная концентрация равна
0,2 моль/л?
10Н2О
какой массы потребуется для приготовления
раствора объемом 1,2 л, если его: а) молярная
концентрация равна 0,2 моль/л;
б) эквивалентная концентрация равна
0,2 моль/л?
118.
Медный купорос CuSO4 5H2O
какой массы потребуется для приготовления
раствора объемом 2 л, содержащего CuSO4
количеством вещества 0,5 моль? Какова
молярная концентрация полученного
раствора?
5H2O
какой массы потребуется для приготовления
раствора объемом 2 л, содержащего CuSO4
количеством вещества 0,5 моль? Какова
молярная концентрация полученного
раствора?
119.
Чему равны массы хлорида бария безводного
и кристаллогидрата BaCl2 2H2O,
которые надо взять для приготовления
раствора (ρ=1,072 г
2H2O,
которые надо взять для приготовления
раствора (ρ=1,072 г см-3)
объемом 1,5 л, в котором ω(BaCl2)=0,08?
Какой объем воды потребуется в том и
другом случае?
см-3)
объемом 1,5 л, в котором ω(BaCl2)=0,08?
Какой объем воды потребуется в том и
другом случае?
120.
Какие массы безводного сульфата меди
и медного купороса CuSO4 5H2O
потребуются для приготовления раствора
(ρ=1,084 г
5H2O
потребуются для приготовления раствора
(ρ=1,084 г см-3)
объемом 1 л, для которого ω (CuSO4)=0,08?
см-3)
объемом 1 л, для которого ω (CuSO4)=0,08?
121.
Определите эквивалентную концентрацию
8%-ного раствора гидроксида натрия
(ρ=1,092 г см-3).
см-3).
122.
Определите нормальную концентрацию
10%-ного раствора серной кислоты (ρ=1,07
г см-3).
см-3).
123.
Сколько миллилитров 96%-ного (по массе)
раствора H2SO4
(ρ=1,84 г см-3)
нужно взять для приготовления 1 л 0,25 н
раствора?
см-3)
нужно взять для приготовления 1 л 0,25 н
раствора?
124.
Плотность 40%-ного (по массе) раствора
HNO3
равна 1,25 г см-3.
Рассчитать молярность, моляльность
этого раствора.
см-3.
Рассчитать молярность, моляльность
этого раствора.
125.
Вычислите массовую долю HNO3
в растворе и моляльность 8 н раствора
HNO3,
плотность которого равна 1,246 г см-3.
см-3.
126.
Какой объем раствора гидроксида калия
с массовой долей КОН 24% (ρ=1,218 г см-3)
можно приготовить из 125 л раствора
гидроксида калия с массовой долей КОН
0,48 (ρ=1,510 г
см-3)
можно приготовить из 125 л раствора
гидроксида калия с массовой долей КОН
0,48 (ρ=1,510 г см-3)?
см-3)?
127.
Определите эквивалентную концентрацию,
моляльность, и массовую долю Fe2(SO4)3
в растворе, если плотность раствора
равна 1,000 г см-3.
см-3.
128.
Какой объем 5 н раствора NaOH можно
приготовить из 4 л раствора гидроксида
натрия с массовой долей NaOH 0,50 (ρ=1,510
г см-3)?
см-3)?
129.
Плотность 15%-ного (по массе) раствора
H2SO4
равна 1,105 г см-3.
Вычислите нормальность, молярность,
моляльность раствора.
см-3.
Вычислите нормальность, молярность,
моляльность раствора.
130.
Из 3 л раствора с массовой долей КОН 0,50
и плотностью 1,538 г см-3
нужно приготовить раствор с массовой
долей КОН 0,10 (ρ=1,09 г
см-3
нужно приготовить раствор с массовой
долей КОН 0,10 (ρ=1,09 г см-3).
Сколько воды нужно взять для приготовления
указанного раствора?
см-3).
Сколько воды нужно взять для приготовления
указанного раствора?
131.
Из 5 л раствора гидроксида калия с
массовой долей КОН 0,50 и плотностью 1,538
г см-3
надо приготовить раствор с массовой
долей КОН 0,18. Какой объем воды надо
взять?
см-3
надо приготовить раствор с массовой
долей КОН 0,18. Какой объем воды надо
взять?
132.
Какой объем раствора серной кислоты с
массовой долей H2SO4
0,96 (ρ=1,835 г см-3)
нужно взять для приготовления 5 л 0,5 н
раствора H2SO4?
см-3)
нужно взять для приготовления 5 л 0,5 н
раствора H2SO4?
133.
Какой объем 50%-ного раствора КОН (ρ=1,538
г см-3)
требуется для приготовления 3 л 6%-ного
раствора (ρ=1,048 г
см-3)
требуется для приготовления 3 л 6%-ного
раствора (ρ=1,048 г см-3)?
см-3)?
134.
Какой объем 0,1 н HNO3
можно
приготовить из 0,7 л раствора азотной
кислоты с массовой долей 30(ρ=1,180 г см-3).
см-3).
135.
К 100 мл 96%-ной (по массе) H2SO4
(ρ=1,84 г см-3)
прибавили 400 мл воды. Получился раствор
плотностью 1,220 г
см-3)
прибавили 400 мл воды. Получился раствор
плотностью 1,220 г см-3.
Вычислить его эквивалентную концентрацию
и массовую долю H2SO4.
см-3.
Вычислить его эквивалентную концентрацию
и массовую долю H2SO4.
136.
Сколько миллилитров концентрированной
соляной кислоты (ρ=1,19 г см-3),
содержащей 38%(масс.) НС1, нужно взять для
приготовления 1 л 2 н раствора?
см-3),
содержащей 38%(масс.) НС1, нужно взять для
приготовления 1 л 2 н раствора?
137. Смешаны 0,8 л 1,5 н NaOH и 0,4 л 0,6 н NaOH. Какова эквивалентная концентрация полученного раствора?
138.
Водный раствор содержит 577 г H2SO4
в 1 л. Плотность раствора 1,335 г см-3
.
Вычислите массовую долю H2SO4
в растворе, а также эквивалентную
концентрацию раствора.
см-3
.
Вычислите массовую долю H2SO4
в растворе, а также эквивалентную
концентрацию раствора.
139.
Определите молярную концентрацию и
эквивалентную концентрацию H2SO4
в растворе, в котором массовая доля
H2SO4
0,98, а ρ=1,84 г см-3.
см-3.
140.
К 0,78 л раствора NaOH с массовой долей 0,20
и ρ=1,225 г см-3
прибавили 0,14 л раствора с массовой долей
NaOH 0,10 и ρ=1,115 г
см-3
прибавили 0,14 л раствора с массовой долей
NaOH 0,10 и ρ=1,115 г см-3
.
Определите массовую долю NaOH в полученном
растворе.
см-3
.
Определите массовую долю NaOH в полученном
растворе.
141.
Какой объем раствора серной кислоты с
массовой долей H2SO4
0,3 (ρ=1,219 г см-3)
можно приготовить из 12 кг раствора
серной кислоты с массовой долей H2SO4
0,6.
см-3)
можно приготовить из 12 кг раствора
серной кислоты с массовой долей H2SO4
0,6.
142. Требуется вычислить давление пара раствора, содержащего 0,2 моля сахара в 450 г воды. Давление пара чистой воды при 200С равно 17,5 мм рт.ст.
143. Давление пара воды при 200С составляет 17,54 мм рт.ст. Сколько граммов сахара С12Н22О11 следует растворить в 720 г воды для получения раствора, давление пара которого на 0,14 мм рт.ст. ниже давления пара воды?
144. При 420С давление водяного пара 61,5 мм рт.ст. На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6.
145. Вычислить давление пара 10%-ного водного раствора сахара С12Н22О11 при 1000С.
146. Определите относительную молекулярную массу анилина, если при 300С давление пара раствора, содержащего 3,09 г анилина в 370 г эфира С4Н10О равно 643,6 мм рт.ст. а давление пара чистого эфира при той же температуре равно 647,9 мм рт.ст.
147. Определите моляльность раствора мочевины. Давление пара над раствором при 250С равно 31 гПа. Давление па ра воды при этой температуре 31,67 гПа.
148. Определите массовую долю глюкозы в растворе, если давление пара над ним равно при той же температуре давлению пара раствора, содержащего мочевину массой 1,56 г и воду массой 90 г.
149. При растворении 0,94 г фенола С6Н5ОН в 50 г спирта точка кипения повысилась на 0,2320. Определите относительную молекулярную массу фенола, если эбуллиоскопическая константа спирта 1,160С.
150. Вычислите, на сколько градусов понизится температура замерзания бензола, если в 100 г его растворить 4 г нафталина С10Н8. Криоскопическая константа бензола 5,120С
151. При какой температуре будет кипеть 50%-ный водный раствор С12Н22О11? Эбуллиоскопическая константа воды 0,512.
152. В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,1040С. Эбуллиоскопическая константа воды 0,5120С.
153. Раствор, содержащий 5,4 г неэлектролита в 200 г воды, кипит при 100,0780С. Вычислить относительную молекулярную массу растворенного вещества, если эбуллиоскопическая константа воды 0,5120С.
154. Раствор, приготовленный из 2 кг этилового спирта С2Н5ОН и 8 кг воды, залили в радиатор автомобиля. Вычислить температуру замерзания раствора, если криоскопическая константа воды 1,860С.
155. Раствор, содержащий 2,7 г фенола С6Н5ОН в 75 г бензола, замерзает при 3,50С, тогда как чистый бензол замерзает при 5,50С. Вычислите криоскопическую константу бензола.
156. Сколько бензойной кислоты (С7Н6О2) растворено в уксусной кислоте массой 100 г, если температура замерзания последней понизилась на 0,8240? Криоскопическая константа уксусной кислоты 3,90С.
157. Температура замерзания бензола 5,50С, а раствора, содержащего в бензоле массой 25,04 г неизвестное вещество массой 0,4678 г, 4,8720С. Криоскопическая константа воды 5,120С. Вычислите относительную молекулярную массу неизвестного вещества.
158. Для охлаждения цилиндров автомобильных, тракторных и авиационных двигателей в морозную погоду, когда вода может замерзнуть во время стоянок, применяют антифризы - водные растворы, не замерзающие при низких температурах. Допустив. что закон Рауля справедлив для раствора нижеуказанного состава, вычислите, при какой температуре замерзнет раствор этиленгликоля С2Н4(ОН)2 массовой долей 0,40. Криоскопическая константа воды 1,860С.
159. Раствор, содержащий глюкозу массой 7,252 г в воде массой 200 г, замерзает при -0,3780С. Криоскопическая константа воды 1,860С. Определите относительную молекулярную массу глюкозы и относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
160. Сколько граммов глюкозы нужно растворить в воде массой 100 г, чтобы повышение температуры кипения было равно 10? Считать, что в этом случае применим закон Рауля. Эбуллиоскопическая константа воды 0,5120С.
161. Вычислите массовую долю мочевины в водном растворе, который кипит при 100,1280С. Эбуллиоскопическая константа воды 0,5120С.
162. При растворении камфоры (С10Н15О) массой 0,298 г в бензоле массой 21,2 г температура кипения повысилась на 0,2360. Эбуллиоскопическая константа бензола 2,60С. Вычислите относительную молекулярную массу камфоры и относительную ошибку опыта в процентах по сравнению с величиной, найденной в справочнике.
163. Определите массовую долю мочевины в водном растворе, температура кипения которого равна 100,1740С. Эбуллиоскопическая константа воды 0,5120С.
164. Чему равно значение Мr растворенного вещества, если оно массой 3,52 г образует с 25,2 г воды раствор, давление пара которого при 700С равно 30,728 кПа? При этой же температуре Р(Н О) =31,175 кПа.
165. При 100С давление пара воды равно 1227,8 Па. Для того, чтобы понизить давление пара до 1200 Па, в воде какой массы надо растворить СН3ОН массой 16 г?
166. Давление пара над раствором, содержащим нафталин массой 2,55 г в бензоле массой 234 г, при 200С равно 99,53 гПа. Давление пара над чистым бензолом при этой же температуре равно 100,21 гПа. Вычислите относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
167. Вычислите величину осмотического давления раствора, в 1 л которого содержится 0,2 моля неэлектролита, если температура раствора 170С.
168. Определите относительную молекулярную массу глюкозы, если осмотическое давление раствора, содержащего 6 г глюкозы в 1 л раствора, равно 0,82 атм при 270С.
169. Вычислите осмотическое давление раствора сахара С12Н22О11, если 1 л раствора содержит 91 г растворенного вещества, а температура равна 270С.
170. Раствор неэлектролита содержит 1 л 0,12 моля растворенного вещества. Вычислите осмотическое давление
раствора, если температура его равна 370С.
171. Вычислите осмотическое давление раствора, содержащего в 1 л 0,05 моля растворенного вещества, если температура раствора равна 350С.
172. Вычислите осмотическое давление раствора, содержащего в 1 л 3,1 г анилина С6Н5NН2 при 210С.
173.
Вычислите осмотическое давление 4%-ного
раствора сахара С12Н22О11
при 200С,
если плотность раствора равна
1,014 г см-3.
см-3.
174. Вычислите, при какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С6Н12О6, достигнет 6 атм.?
175. Сколько граммов глюкозы С6Н12О6 содержится в 200 мл раствора, осмотическое давление которого при 370С составляет 8 атм.?
176. Осмотическое давление раствора, в 250 мл которого содержится 0,66 г мочевины, равно 836 мм рт.ст. при 330С. Вычислите относительную молекулярную массу мочевины.
177. Чему равно при 270С осмотическое давление раствора, взятого объемом 1 л и содержащего этиловый спирт массой 23 г, или глюкозу С6Н12О6 массой 36 г?
178. Методом измерения осмотического давления растворов было установлено значение Мr гемоглобина - 68000. В одном из опытов при 40С осмотическое давление раствора, содержащего гемоглобин массой 40 г в растворе объемом 0,5 л, оказалось равным 2634 Па. Какое значение Мr гемоглобина было найдено в этом опыте?
179.
Чему равно при 170С
осмотическое давление раствора глюкозы,
в котором ее массовая доля составляет
0,10 (ρ=1,0377 г см-3)?
см-3)?
180. Каким будет при 00С осмотическое давление раствора, содержащего сахарозу С12Н22О11 массой 25,2 г в растворе 200 мл?
181.
При 200С
плотность раствора в котором массовая
доля сахарозы составляет 0,17, равна 1,067
г см--3.
Какое осмотическое давление имеет этот
раствор при той же температуре?
см--3.
Какое осмотическое давление имеет этот
раствор при той же температуре?
182.
Осмотическое давление раствора мочевины
СО(NH2)2
при 00С
равно 6,8 105
Па. Найдите ее массу в этом растворе
объемом 1 л.
105
Па. Найдите ее массу в этом растворе
объемом 1 л.
183. Чему равна молярная концентрация раствора неэлектролита, если при 170С его осмотическое давление составляет 1204,5 Па?
184.
Какой массы сахароза находится в растворе
объемом 200 мл, если осмотическое давление
этого раствора при 00С
равно 6,61 105Па?
105Па?
185.
Чему равна массовая доля сахарозы в
растворе с осмотическим давлением
0,637 105
Па при 680С?
105
Па при 680С?
186. Масса анилина С6Н5NH2 в растворе объемом 1 л составляет 9,30 г. Если этот раствор при 180С изотоничен с раствором метилового спирта, то чему равна m(СН3ОН) в растворе объемом 1 л?
187.
Будут ли при одной и той же температуре
изотоническими водные растворы сахарозы
и глицерина С3Н5(ОН)3,
в которых их массовые доли: а) одинаковы
и равны 0,01; б) неодинаковы:
для сахара 0,01, для глицерина 0,0027? (для
растворов ρ=1 г см-3).
см-3).
188. Какова молярная концентрация раствора, объем которого равен 1 л, а осмотическое давление при 100С составляет 0,12 МПа?
189.
Сколько воды надо прибавить к 5 л раствора
сахара, чтобы понизить его осмотическое
давление с 10,13 105
до 1,013
105
до 1,013 105
Па?
105
Па?
190. Осмотическое давление в организме млекопитающих колеблется от 669 до 8,10 кПа. Какой должна быть молярная концентрация раствора, чтобы при 200С осмотическое давление было равно его максимальному значению?
191.
Осмотическое давление клеточного сока
наземных органов болотных растений при
200С
колеблется от 2,026 105
до
16,2
105
до
16,2 105
Па, а степных - от 8,104
105
Па, а степных - от 8,104 105
до 40,52
105
до 40,52 105
Па. Какой молярной концентрации раствора
соответствует минимальное значение
осмотического давления для болотных
растений и максимальное для степных? В
каком молярном соотношении находятся
эти концентрации?
105
Па. Какой молярной концентрации раствора
соответствует минимальное значение
осмотического давления для болотных
растений и максимальное для степных? В
каком молярном соотношении находятся
эти концентрации?
192.
Составьте гальванический элемент, в
котором бы протекала следующая реакция:
Hg2SO4
+ 2Cl–
= Hg2Cl2
+
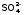
Укажите знаки электродов, запишите электронные реакции, рассчитайте стандартную Э.Д.С. данного элемента/
193. Составьте гальванический элемент, в котором бы протекала следующая реакция:
5Pb0
+ 5SO +
2MnO
+
2MnO + 16H+
= 2Mn2+
+ 8H2O
+ 5PbSO
+ 16H+
= 2Mn2+
+ 8H2O
+ 5PbSO
Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
194. Составьте гальванический элемент, в котором бы протекала следующая реакция: Pb + 2 OH– + 2AgCl = PbO + H2O + 2Ag + 2Cl–
Укажите знаки электродов, запишите электродные реакции,рассчитайте нормальную Э.Д.С. данного элемента.
195. Вычислить Э.Д.С. гальванического элемента, образованного металлическим электродом Pb/Pb2+ при концентрации [Pb2+]=10-2 г–ион/л в сочетании со стандартным водородным электродом. Определить знаки электродов, написать уравнения электродных процессов.
196. Вычислить Э.Д.С. гальванического элемента, образованного медным электродом в растворе CuSO4, [Cu2+]=10–1г–ион/л и никелевого электрода в растворе NiSO4,[Ni2+]=10–2г–ион/л . Указать направление движения электронов в составленной схеме данного гальванического элемента.
197. Вычислить Э.Д.С. гальванического элемента, образованного цинковым электродом в растворе ZnSO4,[Zn2+]=0,01г–ион/л и свинцового электрода в растворе Pb(NO3)2, [Pb2+]=0,1 г–ион/л . Указать направление движения электронов в составленной схеме данного гальванического элемента.
198. Составьте гальванический элемент, в котором бы протекала следующая реакция: Ag0 + Br– + Co3+ = AgBr + Co2+ Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
199.
Для гальванического элемента Ag,
AgI/I–//MnO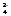 ,
MnO2
составить уравнение электродных реакций,
суммарную реакцию. Рассчитать нормальную
Э.Д.С. элемента.
,
MnO2
составить уравнение электродных реакций,
суммарную реакцию. Рассчитать нормальную
Э.Д.С. элемента.
200. Для гальванического элемента (Pt) Sn+2, Sn+4//Fe+3, Fe+2(Pt) составьте уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
201. Вычислите Э.Д.С. гальванического элемента, который образован электродами Zn/Zn+2 при C(Zn2+) = 0,1 г–ион/л и Cu/Cu+2 при C(Cu+2)=0,01 г–ион/л и сравните Э.Д.С. гальванического элемента, образованного нормальными электродами тех же металлов.
202.
Составьте гальванический элемент, в
котором бы протекала следующая реакция:
Ge + 2H2O
+ 2Hg2SO4
= GeO2
+ 4H+
+ 4Hg + 2SO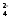 Укажите знаки электродов, запишите
электродные реакции, рассчитайте
нормальную Э.Д.С. данного элемента.
Укажите знаки электродов, запишите
электродные реакции, рассчитайте
нормальную Э.Д.С. данного элемента.
203. Вычислить Э.Д.С. гальванического элемента образованного металлическим электродом Со/Со2+ при концентрации [Co2+] = 0,01 г–ион/л в сочетании со стандартным водородным электродом. Определить знаки электродов, выписать уравнения электродных процессов.
204. Для гальванического элемента (Pt)Cu+, Cu+2//Cl–, Hg2Cl2,Hg составить уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д,С. элемента.
205.
Для гальванического элемента Ag, AgCl,
Cl–//MnO ,
MnO
,
MnO (Pt) составить уравнения электродных
реакций, суммарную реакцию. Рассчитать
нормальную Э.Д.С. элемента.
(Pt) составить уравнения электродных
реакций, суммарную реакцию. Рассчитать
нормальную Э.Д.С. элемента.
206. Составить гальванический элемент, в котором бы протекала следующая реакция: Pb0 + 2H2O + 4Fe3+ = PbO2 + 4H+ + 4Fe2+. Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
207. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора Fe2(SO4)3 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер за время 2 часа при t=170С и р=99,75 кПа. Выход по току составил 90%.
208. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора CuCl2 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 4 ампер за время 1,5 часа при t=170С и Р=750 мм. рт. ст.
209. Составьте уравнения реакций, протекающих на электродах, происходящих в водном растворе Pb(NO3)2 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 1,5 ампер ? Выход по току 75%, время 1,5 часа, t=270C, Р=760 мм.рт.ст.
210. При пропускании тока через раствор NiSO4 в течение 40 мин. на катоде выделилось 30 г Ni. Какой газ и в каком количестве выделится на аноде при Т=170С и Р=740 мм рт. ст. Определите силу тока.
211. Какова была сила тока при электролизе водного раствора нитрата свинца (II), если в течение 20 мин. был выделен весь металл из 500 мл 0,1 н раствора ? Напишите уравнения реакций, протекающих на электродах.
212. Какова была сила тока при электролизе водного раствора сульфата меди, если в течение 10 мин. был выделен весь металл из 250 мл 0,25 н раствора ? Напишите уравнения реакций, происходящих на электродах.
213. Составьте уравнения реакции, протекающих, на электродах, происходящих в водном растворе Na2SO4 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер. Выход по току 92%, время – 0,5 часа., t =170С, Р=98,42 к Па.
214. Какова была сила тока при электролизе водного раствора Pb(NO3)2 если в течение 20 мин был выделен весь металл из 500 мл 0,1 н раствора. Напишите уравнения реакций, происходящих на электродах.
215. Какова была сила тока при электролизе водного раствора AgNO3 если в течение 15 мин был выделен весь металл из 300 мл 0,5 н раствора. Напишите уравнения реакций, происходящих на электродах.
216. Составьте уравнения реакций электролиза водного раствора Pb(NO3)2 . Какой объем 0,5 М раствора был взят, если для полного превращения электролита потребовалось 1,5 часа ? Сила тока равна 4 А.
217. Составьте уравнения реакций, протекающих на электродах, происходящих в одном растворе Fe2(SO4)3 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 10 ампер. Выход по току 98%, время 0,6 часа, Т=170С, Р=95,76 кПа
218. При пропускании тока через раствор Cr2(SO4)3 в течение 1 часа на катоде выделилось 26 г Cr. Какой газ и в каком количестве выделится на аноде при Т=270С и Р=720 мм рт. ст. Определить силу тока.
219. Какова была сила тока при электролизе водного раствора CuSO4 если в течение 10 мин был выделен весь металл из 250 мл 0,25 н раствора ? Напишите уравнения реакций, происходящих на электродах.
220. Какова была сила тока при электролизе водного раствора Pb(NO3)2 , если в течение 20 мин был выделен весь металл из 500 мл 0,1 н раствора ? Напишите уравнение реакций, происходящих на электродах.
221. Составьте уравнения реакции, протекающих на электродах, происходящих в водном растворе FeSO4 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер ? Выход по току 98%, время 2 часа, t=170С, Р=750 мм рт.ст.
222. Составьте схему атмосферной коррозии железа в контакте с медью. Ответ мотивируйте.
223. Составьте схему атмосферной коррозии Ag в контакте с Cd. Дать соответствующие пояснения.
224. Составьте схему атмосферной коррозии Mg в контакте с Со. Дать соответствующие пояснения.
225. Sn склепано с Au. Система находится в агрессивной кислой среде. Какой метал будет корродировать ? Почему ? Составьте схему коррозии.
226. Mg склепан с Cu. Деталь находится в H2O с растворимым в ней О2. Будет ли наблюдаться коррозия и почему ? Если будет, записать схему коррозии.
227. Zn склепан с Со. Деталь находится в Н2О с растворимым в ней О2. Будет ли наблюдаться коррозия и почему ? Если будет, записать схему коррозии.
228. Sn склепано с Bi. Система находится в агрессивной кислой среде. Какой металл будет корродировать ? Почему ? Составьте уравнения электродных процессов.
229. Mg склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему ? Если будет, то записать схему коррозии.
230. Ti склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему. Если будет, то записать схему коррозии.
231. Никель покрыт серебром. Система работает в кислом водном растворе. Будет ли протекать коррозия в системе, если нарушена целостность покрытия ? Ответ мотивируйте.
232. Sn склепано с Zn . Система находится в агрессивной кислой среде. Какой металл будет корродировать ? Почему ? Составить уравнения электродных процессов.
233. Fe склепано с Cu. Система находится в агрессивной кислой среде. Какой металл будет корродировать ? Почему ? Составьте схему коррозии.
234. Zn склепан с Со. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, то записать схему коррозии.
235. Mg склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему ? Если будет, то записать схему коррозии.
236. Составьте схему атмосферной коррозии Fe в контакте с Cu . Дать соответствующие пояснения.
237. 176. Определить величину и знак заряда комплексных ионов, образуемых Cr3+, [Cr(H2O)4Cl2]; [Cr(H2O)3Cl3]; [Cr(H2O)5Cl].
238. Определить заряд комплексообразователя в ионах [Co(NH3)5Cl]2+; [Co(NH3)4Cl2]+; [Co(NH3)3Cl3]0.
239. Координационное число Cо3+ равно 6. Написать возможные комплексы Cо3+ с NH3 и H2O в качестве лигандов.
240. Гидроксид алюминия растворяется в конц. NaOH с образованием комплексного иона [Al(OH)4]–. Напишите эту реакцию и найдите заряд иона-комплексообразователя.
241. Сколько требуется AgNO3 для осаждения ионов Cl– из 0,1 моля [Cr(H2O)5Cl]Сl2?
242.
Представьте координационные формулы
следующих соединений: 2Ca(CN)2 Fe(CN)2,
K2C2O4
Fe(CN)2,
K2C2O4 CuC2O4,
KCl
CuC2O4,
KCl AuCl3,
(NH4)4
AuCl3,
(NH4)4 Fe(SO4)2,
2NH4Cl
Fe(SO4)2,
2NH4Cl PtCl4.
PtCl4.
243. Назовите следующие комплексные соединения: [Co(H2O)2(NH3)4]Cl3; [Ti(H2O)6]Br3; [Cr(NH3)6](NO3)3; Ba[Pt(NO3)4Cl2]; K4[CoF6];
244. Напишите формулы следующих соединений: триоксалатокобальтата (III) натрия, хлорида дибромотетраамминплатины (IV), тетрароданодиаквохромата (III) калия, сульфата пентаамминаквоникеля (II), нитрата карбонатотетраамминхрома (III).
245. Указать комплексообразователь, его заряд и координационное число в комплексных соединениях: K4[Fe(CN)6]; K3[Fe(CN)6]; [Ag(NH3)2]Cl; K2[Cu(CN)4]; [Ni(NH3)6]SO4; K2[PtCl6].
246. Указать комплексообразователь, его заряд и координационное число в комплексных ионах: [Au(CN)2]–, [Cr(H2O)4Br2]2+; [Co(NH3)2(NO2)4]–; [Hg(CN)4]2–; [HgJ4]2–; [Ni(NH3)6Cl]+.
247.
Нижеприведенные молекулярные соединения
представить в виде комплексных солей:
KCN AgCN;
Co(NO3)3
AgCN;
Co(NO3)3 6NH3;
CrCl3
6NH3;
CrCl3 6H2O;
2KCNS
6H2O;
2KCNS Co(CNS)2;
2KCN
Co(CNS)2;
2KCN Cu(CN)2;
2KJ
Cu(CN)2;
2KJ HgJ2.
HgJ2.
248. Определить степень окисления центрального иона (комплексообразователя) и назвать комплексные соединения: [Co(NH3)3(NO2)3]; K[Co(NH3)2(NO2)4]; K2[SiF6]; K[AuCl4]; K3[Fe(CN)6]; [Cr(H2O)6Cl3].
249. Написать химические формулы комплексных соединений, взяв внутренюю сферу комплекса в квадратные скобки: а) дициано-аргентат натрия; б) гексанитро-(III) кобальтат калия; в) хлорид гексаммин никеля (II); г) бромид гексаммин кобальта (III); д) нитрат дибромо-тетра-аква хрома (III); е) нитрат диаква-тетраммин никеля (II).
250. В практике ремонта деталей для их поверхностной обработки применяют желтую и красную кровяные соли. Их химические названия: гексациано-(II) феррат калия и гексациано-(III) феррат калия. Написать формулы этих солей с указанием внутренней сферы комплекса.
251. Написать уравнения первичной диссоциации в водном растворе солей, указать комплексные катионы и анионы, назвать их: [Ag(NH3)2]Cl; K4[Fe(CN)6]; [Cr(H2O)6]Cl3; [Co(NH3)5Cl]Cl2; [Cu(H2O)4]SO4.
252.
Известны две комплексные соли кобальта,
отвечающие одной и той же эмпирической
формуле CoClSO4 5NH3.
Одна из них в растворе с BaCl2
дает
осадок BaSO4,
но не дает осадка с AgNO3,
другая с AgNO3
дает осадок AgCl, а с BaCl2
осадка не дает:
5NH3.
Одна из них в растворе с BaCl2
дает
осадок BaSO4,
но не дает осадка с AgNO3,
другая с AgNO3
дает осадок AgCl, а с BaCl2
осадка не дает:
а) написать формулы обеих комплексных солей;
б) написать уравнения диссоциации этих солей и назвать ионы;
в) написать молекулярные и ионные уравнения реакций взаимодействия солей с образованием осадка - в одном случае AgCl, а в другом - BaSO4.
253.
Координационное число кобальта Co3+,
как комплексообразователя, равно 6.
Указать состав комплексных ионов (т.е.
внутренней сферы комплекса) в солях
CoCl3 6NH3,
CoCl3
6NH3,
CoCl3 5NH3,
CoCl3
5NH3,
CoCl3 4NH3,
учитывая, что молекулы аммиака в них
играют только роль лигандов. Назвать
эти комплексные соли и написать уравнения
их диссоциации в водных растворах.
4NH3,
учитывая, что молекулы аммиака в них
играют только роль лигандов. Назвать
эти комплексные соли и написать уравнения
их диссоциации в водных растворах.
254. Представить выражения для констант нестойкости (Кн) комплексных ионов: [Ag(CN)2]–; [Cu(NH3)4]2+; [Hg(CNS)4]2–; [Co(NH3)6]2+; [Ag(NH3)2]+; [Fe(CN)6]3–; [Fe(CN)6]4–; [Cr(H2O)4Cl2]+.
255. Ниже указаны константы нестойкости некоторых комплексных ионов:
|
|
[Ag(CN)2]– |
[Au(CN)2]– |
[Cu(CN)4]2– |
[Hg(CN)4]2– |
|
Кн |
10–21 |
5 |
5 |
4 |
Указать, в растворе какой из комплексных солей: K[Ag(CN)2], K[Au(CN)2], K[Cu(CN)4] или K[Hg(CN)4] при равной молярной концентрации концентрация CN–-ионов будет: а) наибольшей и б) наименьшей.
256. Сколько требуется миллилитров 0,1 Н раствора
AgNO3 для осаждения ионов Cl– из 25,0 мл 0,1 М раствора [Cr(H2O)5Cl]Cl2?
257. Определить заряды комплексообразователей в комплексных солях: K2[PtCl6]; K2[PtCl4]; K[AuCl4]; K[AuCl2]; K3[Fe(CN)6]; [Pt(NH3)2Cl2]; K4[Fe(CN)6].
258.
Какие комплексные ионы входят в состав
солей: K2PtCl6;
KAu(CN)4;
CrCl3 5H2O;
K4Fe(CN)6;
KAu(CN)2;
CoCl3
5H2O;
K4Fe(CN)6;
KAu(CN)2;
CoCl3 6NH3,
если комплексообразователями в них
являются ионы Pt4+;
Au3+;
Cr3+;
Fe2+;
Au+
и Co3+.
Составьте уравнения диссоциации этих
солей.
6NH3,
если комплексообразователями в них
являются ионы Pt4+;
Au3+;
Cr3+;
Fe2+;
Au+
и Co3+.
Составьте уравнения диссоциации этих
солей.
259. Составить выражения констант нестойкости комплексных ионов: [Сd(CN)4]2–; [Pt(NH3)4]2+; [Cu(CN)4]2–; [Ag(S2O3)2]3–.
260.
Константы нестойкости ионов: [Сu(NH3)4]2+
4,6 10–14;
[Zn(NH3)4]2+
2,6
10–14;
[Zn(NH3)4]2+
2,6 10–11;
[Сd(NH3)4]2+
1,0
10–11;
[Сd(NH3)4]2+
1,0 10–7.
Какой из этих ионов более прочный?
10–7.
Какой из этих ионов более прочный?
261.
Константы нестойкости ионов: [Сd(CN)4]2–
1,4 10–17;
[Ni(CN)4]2–
3,0
10–17;
[Ni(CN)4]2–
3,0 10–16;
[Hg(CN)4]2–
4,0
10–16;
[Hg(CN)4]2–
4,0 10–14.
В растворе какого комплексного иона
будет содержаться больше ионов CN–
при одинаковой молярной концентрации
комплексных ионов?
10–14.
В растворе какого комплексного иона
будет содержаться больше ионов CN–
при одинаковой молярной концентрации
комплексных ионов?
262. Минерал шпинель имеет состав, выражаемый формулой MgAl2O4. Привести химическое название этого вещества.
263.
Состав доломитной горной породы может
быть выражен общей формулой
mСаСО3 nMgCO3.
Вычислить m и n, если образец породы
содержит: а) 28,17% Са; б) 21,74% MgO.
nMgCO3.
Вычислить m и n, если образец породы
содержит: а) 28,17% Са; б) 21,74% MgO.
264.
Образец доломитной породы имеет состав,
выражаемый формулой 3СаСО3 2MgCO3.
Других примесей не содержит: а)
вычислить процентное содержание СаО
в образце; б) какой объем CO2
(при н.у.) выделится из 400 г этого
образца, если он содержит 8% посторонних
примесей (при обработке образца
достаточным количеством, например,
соляной кислоты)?
2MgCO3.
Других примесей не содержит: а)
вычислить процентное содержание СаО
в образце; б) какой объем CO2
(при н.у.) выделится из 400 г этого
образца, если он содержит 8% посторонних
примесей (при обработке образца
достаточным количеством, например,
соляной кислоты)?
265.
Минерал каолинит (белая глина) имеет
состав, который может быть выражен
формулой AlHSiO4 H2O.
Привести химическое название соли;
представить состав каолинита в виде
соединения окислов.
H2O.
Привести химическое название соли;
представить состав каолинита в виде
соединения окислов.
266. Для производства цемента используют известняк, содержащий 92% СаСО3, и глину, содержащую 48% SiO2. Сколько глины требуется взять на 1 т цемента, чтобы в полученном цементе окисел составлял 22%? Сколько процентов будет составлять окисел СаО?
267. Как получается негашеная известь? В чем заключается процесс гашения извести? Вычислите, сколько гашеной извести можно получить из 10 т известняка СаСО3?
268. Какие соединения металлов II группы широко применяются в строительном деле в качестве вяжущих материалов? Как они получаются, чем обусловлены их вяжущие свойства? Напишите уравнения соответствующих реакций.
269. Какой объем СО2 (н.у.) и какую массу Са(ОН)2 можно получить из известняка массой 1 т, если он содержит 90% СаСО3?
270.
При смешивании портландцемента с водой
трехкальциевый силикат, или алит
3СаО SiO2,
массовая доля которого в цементе 0,60,
гидролитически разлагается с образованием
Са(ОН)2
и гидросиликата кальция:
SiO2,
массовая доля которого в цементе 0,60,
гидролитически разлагается с образованием
Са(ОН)2
и гидросиликата кальция:
yСаО SiO2
SiO2 mH2O;
mH2O;
3СаО SiO2
+
nH2O
= xСа(ОН)2
+ yСаО
SiO2
+
nH2O
= xСа(ОН)2
+ yСаО SiO2
SiO2 mH2O.
Какая масса воды (в килограммах) необходима
для гидратации алита, содержащегося в
1 т цемента, при х = 2, у = 1 и m = 3?
mH2O.
Какая масса воды (в килограммах) необходима
для гидратации алита, содержащегося в
1 т цемента, при х = 2, у = 1 и m = 3?
271. Для производства цемента используются известняк с массовой долей СаСО3 0,92 и глина с массовой долей SiO2 0,48. Какая масса глины необходима на каждую тонну известняка, чтобы в полученном цементе оксид кальция составлял 0,62 массовой доли, а оксид кремния 0,22?
272. При сплавлении известняка массой 150 т с песком получился силикат кальция массой 150 т. Определить массовую долю примеси в известняке.
273. Рассчитать массу продукта, получаемого при обжиге
1 т известняка с массовыми долями СаСО3 0,90, MgСО3 0,06 и SiO2 0,04.
274. Определить массовую долю оксида углерода в известняке, имеющем следующий состав (в массовых долях): СаСО3 0,944, MgСО3 0,016 и других соединений, не являющихся карбонатами, 0,04.
275. При обжиге известняка массой 100 т получается 40 т оксида углерода (IV). Найти массовую долю карбоната кальция в известняке, допуская, что карбонат кальция разложился полностью.
276. Рассчитать расходный коэффициент известняка с массовой долей СаСО3 0,89 для получения негашеной извести с массовой долей СаО 0,94; СаСО3 (недопал) 0,012 и примесей 0,048.
277. На производственном объединении “Доломит” произведено извесняково-доломитовой крошки массой 200 тыс. т и доломитового щебня объемом 370 тыс.м3. Определить израсходованную массу доломитизированного известняка в пересчете на карбонат кальция и карбонат магния, если расходный коэффициент для известняково-доломитовой крошки составляет 1,06, а для доломитового щебня 1,4. Массовая доля СаСО3 в доломитизированном известняке 0,47, MgСО3 0,4 и глинистых примесей 0,08.
278. Вычислить выход продукта (в процентах), если на получение извести массой 1 т с массовой долей СаО 0,85 израсходовано известняка 1,7 т с массовой долей СаСО3 0,94.
279.
Провести анализ реакции образования
моноалюмината кальция СаО Al2O3
(CA), являющегося главным минералом
глиноземистого цемента, при использовании
различных исходных материалов: Al2O3,
Al(OH)3,
CaO, CaCO3,
Ca(OH)2.
Исходные данные для расчета представлены
в таблице.
Al2O3
(CA), являющегося главным минералом
глиноземистого цемента, при использовании
различных исходных материалов: Al2O3,
Al(OH)3,
CaO, CaCO3,
Ca(OH)2.
Исходные данные для расчета представлены
в таблице.
|
Соединение |
|
|
|
СаО |
–635,55 |
–604,17 |
|
Ca(OH)2 (тв) |
–686,59 |
–896,76 |
|
CaCO3 |
–1206,87 |
–1128,76 |
|
|
–1669,83 |
–1576,53 |
|
CaO |
–2321,28 |
–2202,04 |
280. Определить теплоту образования Са(ОН)2 тв на основе реакций:
СаСО3
 СаО + СО2
+
СаО + СО2
+
 Н1;
Н1;
СаО
+ Н2О
 Са(ОН)2
тв
+
Са(ОН)2
тв
+
 Н2
Н2
281. Вычислить гидромодуль для образца цемента состава: 66% СаО, 21% SiO2, 6% Al2O3, 3,5% Fe2O3, 3,5% MgO .
282. Определите, для какого из минералов - магнезита MgСО3, кальцита СаСО3 или доломита СаMg(CO3)2 - прокаливание образцов одинаковой массы приведет к получению большего объема углекислого газа. Рассчитайте этот объем (м3, н.у.), если прокалена 1 т минерала.
283.
Жженый гипс mСаSО4 nH2O
готовят из обычного гипса xСаSО4
nH2O
готовят из обычного гипса xСаSО4 yH2O
выдерживанием последнего при 1300С.
По данным анализа образец гипса содержит
20,9% (по массе) воды, а образец жженого
гипса - только 6,2%. Установите химический
состав обоих кристаллогидратов.
yH2O
выдерживанием последнего при 1300С.
По данным анализа образец гипса содержит
20,9% (по массе) воды, а образец жженого
гипса - только 6,2%. Установите химический
состав обоих кристаллогидратов.
284.
Вычислите процентное содержание алюминия
в природных минералах: корунде Al2O3,
криолите AlF3 3NaF,
глине Al2O3
3NaF,
глине Al2O3 2SiO2
2SiO2 2H2O.
2H2O.
285. Месторождения криолита встречаются редко, поэтому его в основном получают искусственным путем по схеме:
Al(OH)3
+ HF + Na2CO3 Na3[AlF6]
+ CO2
+ H2O
Na3[AlF6]
+ CO2
+ H2O
Относится ли эта реакция к окислительно-восстановительным? Сколько образуется граммов криолита, если в реакцию вступает 15,6 г гидроксида алюминия?
286. При строительстве Волго-Донского канала было уложено 2,9 млн.м3 бетона. Определить, сколько вагонов известняка для этого потребовалось (один товарный вагон имеет грузоподъемность 16,5 т), если принять, что 1 м3 бетона содержит в среднем 150 кг гашеной извести и что известняк, применяемый для получения извести, содержит в среднем 95% карбоната кальция.
287. Опишите химическую связь в молекуле пропана. Сколько s- и sp3-орбиталей участвуют в образовании -связей?
288. Опишите химическую связь в молекуле метилацетилена. Сколько s-, p- и sp-гибридных орбиталей участвуют в образовании -и -связей?
289. Опишите химическую связь в молекуле метилбутадиена. Какие орбитали и в каком количестве участвуют в образовании -и -связей в молекуле изопрена (метилбутадиена)?
290. Приведенные ниже вещества расположите в порядке убывания индукционного эффекта:
а) CH2cl–COOH; б) CH2J–COOH;
в) CH2F–COOH; г) CH2Br–COOH.
291. Напишите формулы соединений, если даны их названия по номенклатуре ИЮПАК: а) 4-бутил-2,2-диметилоктан; б) 2,3-диэтилбутан; в) 2,3-диметилбутадиен-1,3.
292. Какие из приведенных соединений могут существовать в виде цис- и транс-изомеров? Приведите структурные формулы изомеров:
а) С2Н5ОН = СНС2Н5;
СН3
б) Н3С – СН2 – СН = СН – СН – СН2 – СН3;
 СН3
СН3
в) СН3 – СН2 – СН = СН – СН
 СН3
СН3
293. Напишите формулы веществ, которые могут быть получены рекомбинацией свободных радикалов, образовавшихся при гомолитическом распаде молекул: а) этана; б) пропана.
294. В какие положения направляет нитрогруппа заместители в реакциях нуклеофильного замещения в ароматических соединениях. Почему? Какие вещества образуются при нагревании нитробензола с едким кали (КОН взят твердый, порошкообразный)?
295. Напишите уравнения реакций между веществами, учитывая ориентирующее действие заместителей: а) мета-нитротолуола с хлором (в присутствии FeCl3); б) мета-ксилола с азотной кислотой (концентрированная HNO3); в) орто-нитротолуола с серной кислотой (концентрированной, дымящей).
296. Определите стандартную теплоту образования из
простых веществ метана, если стандартные энтальпии H2O (ж) и СО2 (Г) соответственно равны –285,84 и –393,41 кДж/моль, а теплота сгорания метана –890,31 кДж/моль.
297. Рассчитайте массу KMnO4, необходимую для окисления 56 л этилена до этиленгликоля. Напишите уравнения реакций окисления этилена перманганатом калия в водной среде.
298. Какую массу хлора может присоединить 10,0 л смеси, содержащей 32,8% метана, 22,4% ацетилена и 44% этилена?
299. Из 7,8 г бензола при действии необходимого количества брома образуется 15,0 г бромбензола. Вычислите выход (%) C6H5Br от теоретического.
300. Какой объем ацетилена (н.у.) образуется, если 10,0 г карбида кальция, содержащего 4% примесей, внести в прибор, в котором находится 36,0 мл Н2О?
301. При каталитическом гидрировании 10,8 г углеводорода С4Н6 затрачено 8,96 л (н.у.) водорода. Напишите уравнение реакции и дайте названия исходного и полученного продуктов.
302. Какие одноатомные спирты получаются при восстановлении следующих соединений:
а) СН3 –СН – СНО;
СН3
б) СН3 – СН2 – СО – СН – СН3;
СН3
в) СН3 – СН = СН – СН – СН3;
СН3
303. При взаимодействии 1,15 г спирта с металлическим
натрием выделилось 214,6 мл водорода (н.у.). Определите молекулярную массу спирта.
304. Как осуществить следующие превращения:
СН3–СН=СН2
 СН3–СН–СН3
СН3–СН–СН3
 СН3–СН–СН3
СН3–СН–СН3
Cl OH
 СН3–С–СН3
СН3–С–СН3
O
305. При нитровании 100 г фенола было получено 44 г о-нитрофенола и 14,0 г n-нирофенола. Определите общий выход продуктов нитрования в процентах от теоретического, напишите уравнения реакций.
306. Как осуществить следующие превращения:
СН2
=
СН2
 С2Н5ОН
С2Н5ОН
 СН2
=
СН – СН
=
СН2
СН2
=
СН – СН
=
СН2
 (–
СН2
–
СН = СН
–
СН2
–)n
(–
СН2
–
СН = СН
–
СН2
–)n
Составьте уравнения реакций.
307. Составьте схему реакции поликонденсации между уксусным альдегидом и фенолятом натрия, считая, что на 2 моль фенолята натрия потребуется 1 моль уксусного альдегида. Какая масса CH3COH (= 35%) потребуется для получения 300 кг смолы.
308. Напишите уравнение реакции поликонденсации карбамида с уксусным альдегидом исходя из того, что с каждыми 3 моль карбамида вступают в реакцию 2 моль альдегида. Рассчитайте массу смолы, которая получится, если в реакции участвуют 15 кг карбамида и 12 кг альдегида.
309. Составьте схему реакции поликонденсации ацетальдегида с фенолятом натрия. Считая, что на 2 моль фенолята натрия потребуется 1 моль ацетальдегида, определите массу ацетальдегида, необходимую для получения 30 кг смолы, если CH3СОН взят в виде
раствора с массовой долей = 35%.
310. Составьте уравнение реакции сополимеризации бутилена и стирола, если число молекул бутилена и стирола, входящих в состав макромолекул, находится в соотношении 2:1. Вычислите объем бутилена и массу стирола, необходимую для получения 125 кг полимера, если производственные потери составляют 25%?
311. Чему равен коэффициент полимеризации изобутилена при получении полиизобутилена с Mч = 56280?
312. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью. Укажите окислитель и восстановитель.
313. Молярная концентрация эквивалента раствора K2Cr2O7 0,25 моль/л. Какой объем этого раствора надо взять для реакции с KJ в подкисленном серной кислотой растворе, содержащем йодид-ионы количеством вещества 0,01 моль?
314.
Было приготовлено 200 мл раствора сульфата
железа (II) из навески FeSO4 7H2O
массой 27,80 г. Какой объем раствора KMnO4,
для которого Сэ=0,1
экв/л потребуется на окисление в кислой
среде FeSO4,
содержащегося в приготовленном растворе
объемом 50 мл?
7H2O
массой 27,80 г. Какой объем раствора KMnO4,
для которого Сэ=0,1
экв/л потребуется на окисление в кислой
среде FeSO4,
содержащегося в приготовленном растворе
объемом 50 мл?
315. Уравнениями реакций покажите отношение: а) меди к азотной и серной кислоте; б) серебра к азотной кис
лоте; в) золота к “царской водке”?
316.
Как можно осуществить указанные ниже
переходы от одного соединения меди (II)
к другому: а) сульфат
 карбонат
карбонат
 оксид
оксид
 гидроксид
гидроксид
 гидроксосульфат
гидроксосульфат
 хлорид; б) Cu
хлорид; б) Cu
 Cu(NO3)2
Cu(NO3)2
 CuS
CuS
 Cu(NO3)2
Cu(NO3)2
 CuO
CuO
 (CuOH)2SO4
(CuOH)2SO4
 CuCl2
CuCl2
 Cu.
Cu.
317. Какой объем раствора с массовой долей HNO3 8% (= 1,045 г/см). потребуется для растворения меди массой 24 г? Чему должен быть равен объем NO (н.у.), который при этом выделится?
318. Дайте общую характеристику d-элементов II группы периодической системы. В чем проявляется устойчивость электронной конфигурации (n–1)d10 в атомах этих элементов?
319. Укажите возможные продукты восстановления серной кислоты цинком и напишите уравнения соответствующих реакций.
320. Какой объем раствора NaOH концентрации 2 моль/л потребуется для полного растворения Zn(OH)2 массой 9,9 г?
321. Учитывая электронную структуру атомов, их радиусы и ионизационные потенциалы, а также наиболее характерные валентные состояния, сделать вывод о том, к какому из элементов, марганцу или рению, ближе по химическим свойствам технеций.
322. Чем объяснить, что при большом различии в свойствах соединений марганца и хлора в низших валентных состояниях соединения этих же элементов в высших валентных состояниях имеют сходство? Сравнить Cl2O и MnO; Cl2O7 и Mn2O7.
323. Оценить термодинамическую возможность протекания в стандартных условиях реакций:
1) Mn(Т) + Н2О(Ж) = MnO(Т) + H2 (Г);
2) Mn(Т) + 2Н2О(Ж) = MnO2 (Т) + 2H2 (Г);
324. Как изменяется максимально возможная и наиболее характерная степени окисления атомов d-элементов VIII группы периодической системы по горизонтали и по вертикали?
325. Сравнить кислотно-основные свойства гидроксидов железа Fe(OH)2 и Fe(OH)3.
326. Чем объяснить, что химическая активность d-металлов понижается по периоду и по группам Периодической системы, в результате наименее активные, благородные металлы (Pd, Pt, Au и т.д.) концентрируются в VIII и I группах V-VI периодов системы?
327. Сравнить кислотно-основной характер гидроксидов CuOH и Cu(OH)2. Какой из этих гидроксидов обладает амфотерными свойствами? Написать уравнения реакций, подтверждающих его амфотерный характер.
328. Проанализировать термодинамическую возможность осуществления реакций:
2CuГ(Т) = CuГ2(Т) + Cu(Т); 2CuГ2(Т) = 2CuГ(Т) + Г2(Т);
в
стандартных условиях для разных
галогенидов меди, используя
изобарно-изотермические потенциалы их
орбазования ( ,
ккал/моль):
,
ккал/моль):
|
CuГ |
CuF2 |
CuCl2 |
CuBr2 |
CuJ2 |
CuF |
CuCl |
CuBr |
CuJ |
|
|
–116,6 |
–40,97 |
–31,3 |
–3 |
–50 |
–28,7 |
–23,8 |
–16,6 |
329. Химически чистый цинк почти не растворяется в разбавленных соляной и серной кислотах. Почему интенсивность взаимодействия с кислотами резко возрастает, если коснуться металла медной проволокой или добавить в раствор кислоты соль меди? Будет ли аналогичным образом влиять на процесс растворения цинка в кислоте введение солей свинца, ртути, маг
ния?
330.
Какую массу хрома можно получить из 2,5
т хромистого железняка FeO Cr2O3,
содержащего 15% посторонних веществ
(пустой породы)?
Cr2O3,
содержащего 15% посторонних веществ
(пустой породы)?
331. На восстановление 0,05 л 0,2 Н K2Cr2O7 в присутствии разбавленной соляной кислоты затрачено 0,2 л раствора хлорида олова (II). Вычислите молярную концентрацию эквивалента раствора SnCl2.
332. Вычислите, какая масса дихромата калия потребовалась для приготовления 0,3 л 0,2 Н K2Cr2O7 (применительно к реакции окисления в кислой среде).
333. Кусок латуни массой 0,8 г растворен в азотной кислоте. При электролизе этого раствора на катоде выделилось 0,496 г меди. Напишите уравнения реакций и определите марку латуни, т.е. состав сплава (%).
334. Карбонил никеля может быть получен при действии оксида углерода на тонкодисперсный порошок металла. Процесс может быть выражен уравнением
Ni
(Т)
+ 4CO
(Г)
 [Ni(CO)4]
(Г)
[Ni(CO)4]
(Г)
Какой объем займет тетракарбонил никеля, если в реакцию вступило 23,48 г никеля, а производственные потери составили 10%?
335. Пирометаллургический процесс извлечения меди из сернистых руд можно выразить следующей схемой:
CuFeS2
+ O2
+ SiO2
 Cu + FeSiO2
+ SO2
Cu + FeSiO2
+ SO2
Какая масса меди получается из 5,8 г сульфида, содержащего 5% примесей, а выход реакции составляет 90% от теоретического? Какой объем (н.у.) займет выделившийся оксид серы (IV)?
336. Составьте уравнение реакции растворения Sc в разбавленной азотной кислоте. Какой объем азотной кислоты с массовой долей 15,53% (= 1090 кг/м3) необходим для растворения скандия, если в результате
реакции образовалось 0,03 моль нитрата аммония?
337. Под действием HNO3 манганаты диспропорционируют следующим образом:
K2MnO4
+ HNO3
 KMnO4+
MnO2
+ KNO3
+ H2O
KMnO4+
MnO2
+ KNO3
+ H2O
Какой объем раствора азотной кислоты (= 1185 кг/м3) с массовой долей 30% необходим для того, чтобы получить 9,48 г перманганата калия. Какая масса диоксида марганца образуется?
338. Имеется 400 г сплава олова со свинцом, содержащего (по массе) 30% олова и 70% свинца. Какой из этих металлов и в каком количестве находится в сплаве в виде кристаллов, вкрапленных в эвтектику, если последняя содержит 64% (масс.) олова и 36% (масс.) свинца?
339. При сплавлении олова с магнием образуется интерметаллическое соединение Mn2Sn. В какой пропорции нужно сплавить указанные металлы, чтобы полученный сплав содержал 20% (масс.) свободного магния?
340. По диаграмме плавкости системы Сd–Bi (рис.1) определить, какой из металлов и при какой температуре начнет выделяться первым при охлаждении жидких сплавов, содержащих: а) 20% Вi; б) 60% Вi; в) 70% Вi.
341. Какой металл будет выделяться при охлаждении жидкого сплава меди и алюминия, содержащего 25% (масс.) меди, если эвтектика включает 32,5% (масс.) меди? Какую массу этого металла можно выделить из 200 г сплава?
 350
1000
350
1000
 Cd
3210C
Cd
3210C
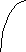

300 900
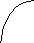 2710С
2710С
250 Bi 800
200 700
 Mg
6500C
Mg
6500C

150 600 Sb
6300C
100

0 20 40 60 80 100 0 20 40 60 80 100
Содержание Bi, % (масс.) Содержание Sb, % (масс.)
Рис.1.Диаграмма состояния Рис.2.Диаграмма состояния
системы Cd–Bi системы Mg–Sb
342. Сплав олова со свинцом содержит 73% (масс.) олова. Найти массу эвтектики в 1 кг твердого сплава, если эвтектика включает 64% (масс.) олова?
343. Серебряные монеты обычно чеканят из сплава, состоящего из равных масс меди и серебра. Сколько граммов меди находится в 200 г такого сплава в виде кристаллов, вкрапленных в эвтектику, если последняя содержит 28% (масс.) меди?
344. По диаграмме плавкости системы Mg–Sb (рис.2) установить формулу интерметаллического соединения, образуемого этими металлами. Каков будет состав твердой фазы, которая выделяется первой при охлаждении жидкого сплава, содержащего 60% (масс.) сурьмы? Что будет представлять собой затвердевший сплав?
345. По диаграмме плавкости системы Сu–Mg (рис.3) найти формулы интерметаллических соединений, образуемых этими металлами.
346. Имеется 500 г сплава 72% висмута и 28% кадмия.
Сколько граммов висмута содержится в сплаве в виде вкрапленных в эвтектику кристаллов? Состав эвтектики: Bi 60%, Cd 40%.


 1100
1100
 Сu
10830C
1453 A
Сu
10830C
1453 A
1000
 900
900

 800
Е
800
Е
D
Mg
700
 6500C
6500C


600 650 K
500
16
43
400
 500
500
0 20 40 60 80 100 Ni 100% Sb 100%
Содержание Mg, % (масс.) Содержание Sb, % (масс.)
Рис.3.Диаграмма состояния Рис.4.Диаграмма состояния
системы Cu–Mg системы Ni–Sb
347. Магний образует с сурьмой химическое соединение, в состав которого входят 23% Mg и 77% Sb. Сколько граммов этого соединения содержится в 1 кг сплава, состав которого Mg 60%, Sb 40%?
348. Сплав имеет состав: Sn 30%, Pb 70%. В 800 г сплава содержится 425 г свинца в виде кристаллов, вкрапленных в эвтектику. Вычислите состав эвтектики.
349. Эвтектика металлов Cu и Ag имеет состав: Cu 29%, Ag 72%. В 1 кг сплава этих металлов содержится 400 г эвтектики. Вычислить состав сплава, если медь содержится в нем в избытке.
350. Свинец и магний образуют химическое соединение, в котором Pb 81%, Mg 19%? Что представляет собой твердый сплав, имеющий состав: Pb 60%, Mg 40%? Какой металл находится в нем в свободном состоянии? Сколько его содержится в 400 г сплава?
351. Что представляет собой сплав, имеющий состав: Pb 85%, Mg 15%. Вычислить массу химического соединения этих металлов (состав см.задачу 238), содержащегося в 300 г сплава.
352. Магний и сурьма образуют соединение состава: Mg 23%, Sb 77%. Что собой представляет затвердевший сплав этих металлов, имеющий состав Mg 30%, Sb 70%. Какой из металлов находится в свободном состоянии? Сколько его содержится в 300 г сплава?
353. Вычертить диаграмму плавкости для сплава свинца с магнием по следующим данным:
|
Pb, % |
0 |
30 |
67,5 |
81 |
91 |
100 |
|
Mg, % |
100 |
70 |
32,5 |
19 |
3 |
0 |
|
Т.пл., 0С |
651 |
590 |
460 |
551 |
250 |
323 |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Pb 10% и Mg 90% при 700, 500 и 4000С. Что будет представлять собой затвердевший сплав?
354. Вычертить диаграмму плавкости для сплава образованного магнием и сурьмой, по следующим данным:
|
Mg, % |
100 |
60 |
23 |
5 |
0 |
|
Sb, % |
0 |
40 |
77 |
95 |
100 |
|
Т.пл., 0С |
650 |
626 |
961 |
594 |
630 |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Mg 50% и Sb 50% при 800, 600 и 4000С. Что будет представлять собой твердый сплав?
355. Вычертить диаграмму плавкости для сплава меди с серебром по следующим данным:
|
Cu, % |
100 |
80 |
70 |
60 |
40 |
28 |
20 |
0 |
|
Ag, % |
0 |
20 |
30 |
40 |
60 |
72 |
80 |
100 |
|
Т.пл.,0С |
1084 |
900 |
930 |
880 |
778 |
800 |
820 |
962 |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Cu 55% и Ag 45% при 1000, 800 и 4000С. Что будет представлять собой твердый сплав?
356. Вычертить диаграмму плавкости для сплава, состоящего из олова и свинца по следующим данным:
|
Sn, % |
100 |
80 |
64 |
40 |
20 |
0 |
|
Pb, % |
0 |
20 |
36 |
60 |
80 |
100 |
|
Т.пл., 0С |
232 |
205 |
181 |
235 |
280 |
326 |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Sn 15% и Pb 85% при 400, 200 и 1500С. Что будет представлять собой затвердевший сплав?
357. По диаграмме плавкости сплава Bi–Pb (рис.6) определите состав жидкой и твердой фаз для системы, содержащей 55% Pb и 45% Bi при 1500С. Какая масса твердой фазы выделится при кристаллизации 300 г этого сплава при данной температуре?
358. Сколькими степенями свободы обладает система, содержащая 40% Cu и 60% Ag при 8000С?. Диаграмма плавкости на рисунке 5.
359. Определите температуру затвердевания и плавления сплава, содержащего 60% Ni и 40% Cu. Диаграмма плавкости на рисунке 7.
360. При какой температуре будет затвердевать и плавиться сплав, содержащий 80% Au и 20% Pt? Определите число степеней свободы для сплава данного состава при 12000С. Диаграмма плавкости на рисунке 8.
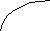 1083
В
1083
В
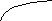
 271,3
327,4
271,3
327,4
А В A
 960,8
960,8
Е
E
500
Ag 100% Cu 100% Bi 100% Pb 100%
Рис.5.Диаграмма состояния Рис.6.Диаграмма состояния
системы Ag–Cu системы Bi–Pb
361. По диаграмме плавкости системы Ni–Sb (рис.4) установите формулы интерметаллических соединений, образуемых при сплавлении этих металлов.


1769
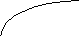
 1453
1453
1083 1063
1000 1000
Cu 100% Ni 100% Au 100% Pt 100%
Рис.7.Диаграмма состояния Рис.8.Диаграмма состояния
системы Cu–Ni системы Au–Pt
362. При сплавлении лантан и таллий образуют интерметаллическое соединение, имеющее состав: 42% Tl и 58% La. Установите формулу этого соединения. Какой из металлов находится в свободном состоянии при охлаждении жидкого сплава, содержащего 30% Tl и 70% La? Какая масса этого металла содержится в 750 г сплава?
ТЕСТЫ
Основные законы химии
Хл 4л
1. Вычислить Величину Х в реакции 2NO + O2 → 2NO2
А) 4л
Б) 2л
В)8л
Г)22,4л
Д)44,8л
2. Металл М образует оксид М2О3 содержащий 68,4 вес.% металла. Вычислите относительную атомную массу этого металла.
А) 51,9
Б) 34,6
В) 26,9
Г) 69,3
Д) 103,8
3. Какой объем занимает 1г озона при н.у.?
А) 22,4л
Б) 0,94л
В) 4,7л
Г)0,47л
Д) 5,6л
4. Вычислите массу в граммах 1 атома серы.
А)32г
Б) 1г
В)5,3*10-23г
Г)5,3*1023
Д) 16г
5. В приведенной реакции вычислите величину, обозначенную через Х
200г Х
CaCO3 + 2HCl → CaCl2 + H2O + CO2
А)111г
Б) 222г
В) 100г
Г) 50г
Д) 200г
6. Вычислите массу в граммах 100 молекул воды.
А)18г
Б)2,99*10-23
В) 9г
Г) 2,99*10-21
Д) 1800
7. Сколько молей и молекул любого газа содержится при н.у. в объеме 2,24л?
А) 1 моль и 1 молекула
Б)0,5 молей и 6,02*1023 молекул
В) 1 моль и 6,02*1023 молекул
Г) 0,1 моля и 6,02*1022 молекул
Д)1 моль и 6,02*10-23 молекул
8) Вычислите массу в граммах 1 молекулы водорода.
А) 2г
Б) 1г
В) 6,02*10-23г
Г) 0,33*10-23г
Д) 0,17*10-23г.
9. Рассчитать объем 0,5 моль эквивалентов кислорода при нормальных условиях
А) 5,6л
Б) 11,2 л В) 22,4л
Г)2,8л Д) 44,8л
10. Найти объем 2 моль воды при t = 40С
А) 36*10-3л Б) 22,4л В) 44,8л Г) 11,2л Д) 18*10-3л
Окислительно – восстановительные реакции.
1. Какие из ниже приведенных реакций являются окислительно – восстановительными?
1) Ca CO3 = CaO + СО2
2) НСl + NaOH = NaCl +H2O
3) CuO + H2SO4 = CuSO4 + H2O
4)2 Hg O = 2Hg +O2
Ответы:



 А)1
Б)2
В)3
Г)4
Д)-
2
.Укажите процесс окисления:
А)1
Б)2
В)3
Г)4
Д)-
2
.Укажите процесс окисления:
1) H2S → H2SO4
2) HNO3 → NO2
3)H2O2 → H2O
4)K2Cr2O7 → Cr2(SO4)3
 5)
Вr20
→
2Br
–
5)
Вr20
→
2Br
–
Ответы:
А)1
Б)2
В)3
Г)4
Д)5
3. Укажите процессы восстановления:

 1)
AsH3
→
H3AsO4
1)
AsH3
→
H3AsO4
2) H2O2 → O2
3)PbO2 → Pb(NO3)2
4) HNO2 → HNO3
5)MnO2 → KMnO4
Ответы:
А)1
Б)2
В)3
Г)4
Д)5
4. Укажите формулу вещества, проявляющегося только окислительные свойства:
1) MnO2
2) H2S
3) KMnO4
4)H2O2
5) H2SO2
Ответы:
А)1
Б)2
В)3
Г)4
Д)5
5. Указать форму вещества, проявляющего восстановительные свойства:
1) H2S
2) K2MnO4
3) F2
4) K2Cr2O7
5) H2O2
Ответы:
А)1
Б)2
В)3
Г)4
Д)5
6.Указать формулу вещества, проявляющего как окислительные, так и восстановительные свойства:
1) KJ
2) O2
3) KMnO4
4) H2SO4
5) H2O2
Ответы:
А)1
Б) 2
В)3
Г)4
Д)5
7. Какие из ниже приведенных реакций являются окислительно-восстановительными?
1) CuO + 2HCl = CuCl2 + H2O;
2)Cu + 4HNO3 = Cu(NO3)2 + 2NO2 +2H2O;
3) Cu(OH)2 = CuO + H2O;
4) MgCO3 = MgO + CO2;
5) H2 + Cl2 = 2HCl
Ответы:
А)1,2
Б)2,3
В)2,5
Г)3,4
 Д)1,5
Д)1,5
8. Укажите процесс окисления:
1) CI2 → 2 HCI
2) Pb(NO3)2 → PbO2

 3)
HNO3
→
NH3
3)
HNO3
→
NH3
 4)MnO2
→
MnSO4
4)MnO2
→
MnSO4
 5)
AsH3
→
H3AsO4
5)
AsH3
→
H3AsO4
Ответы:
А)1,2 Б)4,5 В)1,3 Г)2,5 Д)1,5
9. Укажите процесс восстановления:
1) Mg → Mg2+
2) C → CO2
3) CuO → Cu
4) S2- → SO2
5) FeS → Fe2O3
Ответы:
А)1
Б) 2
В)3
Г)4
Д)5
10. Указать формулы вещества, проявляющего только окислительные свойства:
1)C




 2)CO
2)CO
3)HNO3
4)NH3
5.H2
Ответы:
А)1
Б) 2
В)3
Г)4
Д)5
Термодинамика
1. Мерой термодинамической вероятности протекания химической реакции является
А) энтальпия реакции
Б) энтропия реакции
В) энергия Гиббса
Д) константа химического равновесия
2. Теплота сгорания метана
∆H°сг(СН4) = -890 кДж/моль.
Теплотворная способность метана (в кДж/м3) равна
А)89000
Б)39732
В)890,0
Г)3973,2
3. При сжигании 3,04 г магния выделилось 76,45 кДж теплоты. Теплота образования МgО (∆H°обр, кДж/моль) равна
А) 232,4
Б) -611,0
В) -232,4
Г) 611,0
4. Теплота образования оксида углерода (IV) равна ∆H°обр = -393,6 кДж/моль. При выделении теплоты в количестве 209,3 кДж образовался оксид углерода (IV) в объеме (в литрах при н.у.), равном
А) 6
Б) 8
В) 10
Г) 12
5. При образовании 1 л (при н.у.) HBr выделяется 1,58 кДж теплоты. Теплота образования (∆H°обр, в кДж/моль) бромоводорода равна
А) 35,4
Б) -35,4
В) 22,4
Г) -22,4
6. Термохимическое уравнение реакции имеет вид:
2Al (т) + Fe2О3 (т) = Al2О3 (т) + 2Fе (т) + 848 кДж.
Количество теплоты (в кДж), которое выделится при взаимодействии 10,8 г алюминия, равно
А) 84,8
Б) 169,6
В) 254,4
Г) 424,0
7. Значение
∆H°обр(MgO) = -611 кДж/моль; ∆H°обр(В2О3) = -1406 кДж/моль.
Значение ∆H° для реакции
В2О3 (т) + 3Mg (т) = 2В (т) + 3Mgo (т)
равно (в кДж/моль)
А)427
Б) -427
В)795
Г) -795
8. Известны термохимические уравнения окисления Аs2О3 кислородом и озоном
Аs2О3 (т) + 02 (г) = Аs2О5 (т), ∆H°обр = -271 кДж;
3Аs2О3 (т) + 2О3 (г) = 3Аs2О5 (т), ∆H°обр = -1096кДж.
Теплота образования (∆H°обр, кДж/моль) озона из молекулярного кислорода равна
А)138,5
Б)277
В)415,5
Г)-138,5
9. Известны термодинамические характеристики веществ
|
Вещество
|
∆H°обр, кДж/моль
|
S°обр, ДжДмоль•К)
|
|
С02(г) Н2(г) С0(г) Н2О(ж)
|
-393,51 0 -110,52 -285,84
|
213,65 130,59 197,91 69,94
|
Значение ∆G°обр (в кДж/моль) реакции
СО(г) + Н2О(ж) = СО2(г) + Н2(г)
равно
А) -19,9
Б) -22761,0
В) 2,86
Г) 76,39
10. Дано термохимическое уравнение
SiO2 (т) + 2Мg (т) = 2МgО (т) + Si (т);
∆H°обр = -372 кДж. Теплота образования оксида магния ∆H°обр(МgО) = -611 кДж/моль. Теплота образования оксида кремния (IV) (∆H°обр(SiO2), в кДж/моль) равна
А) -239
Б) 239
В) -850
Г) 850
Кинетика
1.Во сколько раз увеличиться скорость химической реакции при увеличении температуры на 30 градусов, если температурный коэффициент скорости равен 2 ?
А) 60;
Б) 30;
В) 15;
Г)8;
Д)4.
2.На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент скорости равен 3 ?
А) 27;
Б) 30;
В) 3;
Г) 81;
Д) 9.
3.Две реакции при 40 градусах протекают с одинаковой скоростью (V1=V2). Температурный коэффициент скорости первой реакции равен 2, второй – 3. Как будут относиться скорости реакций V2/V1, реакции проводить при 70 градусах ?
А) 2/3;
Б) 3/2;
В) 9/4;
Г) 27/8;
Д)8/27.
4.Во сколько раз возрастёт скорость реакции X+2Y=Z при увеличении концентрации Y в 3 раза?
А)2;
Б) 3;
В) 6;
Г) 9;
Д )12.
5.Во сколько раз возрастёт скорость газовой реакции X+2Y=Z при увеличении давления в системе в 2 раза ?
А)16;
Б) 8;
В)4;
Г) 2;
Д) 0,25.
6.В растворе происходит реакция по уравнению
Cl -+HClO=Cl 2 +OH-
Во сколько раз уменьшиться скорость реакции при разбавлении реагирующей смеси в 6 раз ?
А) 6;
Б) 12;
В) 3;
Г) 24;
Д) З6.
7.Для реакции X+Y=Z при Cx=1,0 моль/л и Cy=3,0 моль/л скорость равна 0,15 моль/л*ч. Вычислите константу скорости.
А) 0,15;
Б) 0,45;
В) 0,05;
Г) 0,60;
Д) 0,0375.
8.Во сколько раз станет больше скорость прямой реакции в системе 2NO+O 2=2NO2 при увеличении давления в 2 раза ?
А) 2;
Б) 4;
В) 3/2;
Г) 0,5;
Д) 2/3.
9.Во сколько раз станет больше скорость прямой по сравнению со скоростью обратной реакции в системе N2O4=2NO2 при разбавлении реагирующей смеси инертным газом в 3 раза ?
А) 2/3;
Б )3/2;
В)3;
Г) 6;
Д) 9.
10.Во сколько раз увеличиться скорость химической реакции при увеличении температуры на 50 градусов, если температурный коэффициент скорости равен 2 ?
А) 2;
Б) 10;
В) 8;
Г) 16;
Д) 32.
Растворы
1. Рассчитать % концентрацию раствора, содержащего 30 г Na2SO4 в 570 г воды:
Ответы:
А) 5,4
Б) 0
В) 5
Г) 50
Д) 4
2. Определить молярную концентрацию раствора, содержащего 4 г NaOH (м. масса = 40) в 500 мл раствора.
Ответы:
А) 0,1М
Б) 0,2М
В) 1М
Г) 2М
Д) 0,4М
3. Определить титр раствора HCl, если плотность раствора 1,63г/см3, а содержание кислоты 96%.
Ответы:
А) 1,63 * 100
96
Б) 96 * 100
1,63
В) 96 * 1,63
100
Г) 100
96 * 1,63
Д) 1,63 * 96
100
4. Определить нормальность раствора, содержащего 5,6 г КОН (молекулярная масса = 56) в 500 мл раствора.
Ответы:
А) 0,0 Н
Б) 0,1Н
В) 0,4Н
Г) 0,2Н
Д) 2Н
5. Определить моляльность раствора, содержащего 20 г NaOH в 500 мл воды.
Ответы:
А) 1
Б) 0,1
В) 10
Г) 0,01
Д) 5
6. Рассчитать % концентрацию раствора, содержащего 5г NaCl в 495 г воды.
Ответы:
А) 1,01
Б) 0,018
В) 1
Г) 0,1
Д) 10
7. определить молярную концентрацию раствора, содержащего 9,8 г серной кислоты H2SO4 (М.масса =98) в 200 мл водного раствора.
Ответы:
А) 0,5М
Б) 1 М
В) 0,05М
Г) 2М
Д) 0,3М
8. Определить титр раствора NaCl, содержащего 5,85 г вещества в 100 мл раствора (М.масса = 58,5).
Ответы:
А) 5,85 * 10000
58 * 100
Б) 5,85
100
В) 5,85 * 1
58,5 * 100
Г) 5,85
58,5
Д) 5,85
9. В 500 мл раствора содержится 30 г уксусной кислоты СН3ООН. Какова нормальность раствора (М.масса = 60)?
Ответы:
А) 0,1Н
Б) 0,001Н
В) 2Н
Г) 5Н
Д) 1Н
10. Определить моляльность раствора, содержащего 49 г H2SO4 в 500 мл воды.
Ответы:
А) 10
Б) 2
В) 5
Г) 1
Д) 0,1
Жесткость воды
1. Введением каких реагентов можно удалить постоянную жесткость воды?
А) Na2CO3
Б) NaOH
В) HCl
Г) Na2S2O3
2. В воде присутствует хлорид кальция. Какой тип жесткости обеспечивает эта соль?
А) временная некарбонатная
Б) постоянная некарбонатная
В) постоянная карбонатная
Г) временная карбонатная
3. В 100 мл воды содержится 6 мг Ca2+ и 9,6 мг Mg2+. Какова жесткость воды?
А) 11
Б) 1,1
В) 15,6
Г) 156
4. Какой процесс пригоден для умягчения воды, жесткость которой обеспечивается наличием в воде сульфата магния?


 А)
MgSO4
+ Na2S2O3
→ MgS + NaHSO4
А)
MgSO4
+ Na2S2O3
→ MgS + NaHSO4
 Б)
MgSO4
+ HCl → MgCl2
+ H2SO4
Б)
MgSO4
+ HCl → MgCl2
+ H2SO4
 В)
MgSO4
+ 2 NaOH → Mg(OH)2
+ Na2SO4
В)
MgSO4
+ 2 NaOH → Mg(OH)2
+ Na2SO4
Г) MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4
Д) 3 MgSO4 + 2 Na3PO4 → Mg3(PO4)2 + 3 Na2SO4
5. какова карбонатная жесткость воды, если на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 Н раствора HCl?
А) 0,5
Б)10
В) 5
Г) 2,5
Д)1,25
6. К какому классу жесткости относится вода с жесткостью 2 мг-экв/ л?
А) жесткая
Б) мягкая
В) очень мягкая
Г) средней жесткости
Д) очень жесткая
7. какие ионы надо удалить из природной воды, чтобы сделать её мягкой?
А) SO42- ; PO43-
Б) K+ ; Na+
В) CO32- ; HCO3-
Г) Ca2+ ; Mg2+
Д) Cl- ; Fe2+ ; OH-
8. В 1 л воды обнаружено 0,02 г кальция и 0,024 г магния. Какова жесткость воды?
А) 3
Б) 0,44
В) 44
 Г)
0,004
Г)
0,004


 9.
какой процесс протекает при химическом
карбонатном методе устранения постоянной
жесткости воды?
9.
какой процесс протекает при химическом
карбонатном методе устранения постоянной
жесткости воды?

 А)
Ca(HCO3)2+H2SO4
→ CaSO4
+ H2O
+ CO2↑
А)
Ca(HCO3)2+H2SO4
→ CaSO4
+ H2O
+ CO2↑
 Б)
CaSO4
+ Na2CO3
→ Ca(OH)2
+ Na2SO4
+ CO2↑
Б)
CaSO4
+ Na2CO3
→ Ca(OH)2
+ Na2SO4
+ CO2↑
В) Ca(HCO3)2+ NaCl → CaCl2 + NaHCO3


 Г)
Ca(HCO3)2+
HCl → CaCl2
+ H2O
+ CO2↑
Г)
Ca(HCO3)2+
HCl → CaCl2
+ H2O
+ CO2↑
Д) CaCl2 + Na2CO3 → CaCO3 ↓ + 2 NaCl
10.В 200 мл воды растворено 0,5 г Ca(HCO3)2. Сколько мг-экв/ л Ca2+ содержит эта вода?
А) 55
Б) 25
В) 0,025
Гальванические элементы.
1.В
каком направлении движутся электроны
во внешней цепи при работе гальванического
элемента:
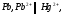
Указать знаки электродов.
А)
(-) ;
;
Б)
(-)
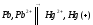 ;
;
В)(+)
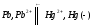 ;
;
Г)
(+)
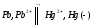 ;
;
2.
Вычислить электродный потенциал хрома
в 0,001 М растворе
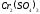
А) -0,74 В;
Б) -0,799 В;
В) -0,681 В;
Г) 0,799 В;
Д) 0,681;
3.Указать
процесс, происходящий на отрицательном
электроде гальванического элемента:
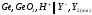
А)
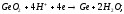
Б)

В)
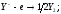
Г)

4.
Вычислить ЭДС гальванического элемента,
состоящего из титанового электрода,
содержащего 0,01 М раствор
 и платинового электрода, содержащего
0,01 М раствор
и платинового электрода, содержащего
0,01 М раствор

1) -2,82 В;
2) 2,82 В;
3) 0,558 В;
4) -0,558 В;
5.
В каком направлении движутся электроны
во внешней цепи при работе гальванического
элемента:

Указать знаки электродов.
А)
(-)
 ;
;
Б)
(-)
 ;
;
В)(+)
 ;
;
Г)
(+)
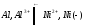 ;
;
6.
Указать процесс, происходящий на
положительном электроде гальванического
элемента:

А)

Б)
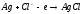 ;
;
В)
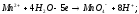
Г)
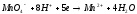 ;
;
Д)
 ;
;
7.
Вычислить электродный потенциал никеля
в 0,01 М растворе
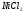
А) 1,042 В;
Б) -0,191 В;
В) -0,309 В;
Г) 0,309 В;
Д) 1,158 В.
8.
Вычислить ЭДС гальванического элемента,
состоящего из медного электрода,
содержащего 0,01 М раствор соли
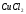 и свинцового электрода, содержащего
0,01 М раствор соли
и свинцового электрода, содержащего
0,01 М раствор соли
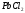
А) -0,471 В;
Б) 0,384 В;
В) -0,326 В;
Г) 0,326;
Д) 0,471 В.
9.
В каком направлении движутся электроны
во внешней цепи при работе гальванического
элемента:
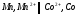

Указать знаки электродов.
А)
(-)
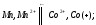
Б)
(-)
 ;
;
В)
(+)
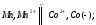
Г)
(+)

Д)
(+)

10.
Вычислить электродный потенциал свинца
в 0,01 М растворе
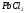
А) -0,126 В;
Б) -0,185 В;
В) -0,067 В;
Г) 0,185 В;
Д) 0,067В.
Электролиз
1. Какие частицы распадаются на аноде при электролизе расплавленной соли NaCl?
А)NaCl Б)Na+ В)Cl- Г)H2O
Д)H+
Е)OH-
2. В какой последовательности будут выделяться металлы при электролизе водных растворов, содержащие одинаковые концентрации ионов:
Fe2+, Bi3+, Ag+, Cr3+, Sn2+
А)Ag+, Bi3+, Sn2+, Fe2+, Cr3+ Б)Cr3+,Fe2+,Sn2+,Bi3+,Ag+ В)Ag+,Cr3+,Fe2+,Sn2+,Bi3+ Г)Cr3+,Ag+,Bi3+,Sn2+,Fe2+ Д) Sn2+, Fe2+ ,Ag+, Bi3+ ,Cr3+
3. Какое количество электричества необходимо пропустить через раствор соли никеля, чтобы выделить 59г никеля?
А)9650К
Б)1930К В)19300К Г)193000К Д)96500К
4. При электролизе водных растворов каких из ниже приведенных веществ анодный процесс выражается уравнением ( анод инертный)
2Н2О -2е → О2 + 4Н+
А)AgNO3 Б)NaCl В)KY Г)NaOH
5. При рафинировании меди из раствора выделяется 281г этого металла при прохождении 250А-час электричества. Вычислите выход по току.
А)94,3 Б)250 В)1,14 Г) 114
6. Назвать процесс отдачи электронов.
А)окисление Б)восстановление В)диссоциация Г)нейтрализация Д)гидролиз
7. Какое количество электричества необходимо пропустить через раствор электролита для выделения 32г Сu?
А)96,5 Б)965 В)9650 Г)96500 Д)48250
8. При пропускании через раствор Bi(NO3)3 2770К электричества выделилось 2г висмута. Определите химический эквивалент висмута.
А)209 Б)69 В)0,007 Г)0,028 Д) -
9. Какие частицы разряжаются на катоде при электролизе расплавленной соли КNО3.
А)KNO3
Б)K+
В)NO3-
Г)H2O
Д)O2-
E) N5+
10. Какое количество электричества необходимо пропустить через раствор электролита для выделения 2г/экв. Вещества?
А)193К Б)1930К В)19300К193000К Г)193000К Д)96500К
Свойства металлов.
1. Между какими из перечисленных ниже веществ, взятых попарно, пойдет реакция замещения:
Ответы:
А)AgNO3 + Fe →
Б)Hg(NO3)2 + Au →
В)FeCl3 + Cu →
Г)KCl + Al →
Д)Na2SO4 +Pb →
2.Какая из нижеприведенных схем отражает процесс взаимодействия цинка с концентрированной азотной кислотой?
Ответы:
А)Zn + HNO3 → Zn(NO3)2 + H2
Б)Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
В)Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Г)Zn + HNO3 → Zn(NO3)2 + NO + H2O
Д)Zn + HNO3 → Zn(NO3)2 +H2O
3. Какие металлы не вытесняют водород из раствора HCl?
Ответы:
А)Fe и Na
Б)Ag и Cu
В)Ca и Zn
Г)Mg и K
Д)Fe и Ca
4.Какую кислоту следует взять для растворения медносеребряного сплава?
Ответы:
А) H2SO4 (конц.)
Б) H2SO4 (разб.)
В)HNO3 (конц.)
Г)HCl (конц.)
Д) HF (конц.)
5. Химическое соединение меди с цинком содержит 66% меди и 34% цинка. Определить формулу соединения.
Ответы:
А)CuZn
Б) Cu3Zn2
В) Cu2Zn
Г) CuZn2
6. Между какими из перечисленных ниже веществ, взятых попарно, возможна реакция замещения:
Ответы:
А) AgNO3 + Pt→
Б) K2SO4 + Fe →
В) CuCl2 + Zn →
Г) FeSO4 + Cu →
Д) Hg(NO3)2 +Ag →
7. Какая из нижеприведенных схем отражает химизм взаимодействия концентрированной серной кислоты с цинком?
Ответы:
А) Zn + H2SO4 → ZnSO4 + H2
Б) Zn + H2SO4 → ZnSO4 + SO2 + H2O
В) Zn + H2SO4 → ZnSO4 + H2S+ H2O
Г) Zn + H2SO4 → ZnSO4 + S + H2O
Д) Zn + H2SO4 → ZnSO4 +H2O
8. C какими металлами будет взаимодействовать водный раствор NaOH?
Ответы:
А) Cu и Fe
Б) Fe и Zn
В) Zn и Al
Г)Al и Pb
Д) Zn и K
9. Написать уравнения реакций между бериллием и раствором NaOH?
Ответы:
А) Be + 2NaOH = Be(OH)2 + 2Na
Б) Be + 2NaOH = BeO + 2Na +H2O
В) Be + 4NaOH = Be(OH)2 + 2Na2O + H2 ↑
Г) Be + 2NaOH + 2HO = Na2[Be(OH)4] + H2 ↑
10. Сколько килограммов гидрида кальция следует разложить водой, чтобы получить 1680 м3 водорода (0ºС, 760 мм. рт. ст.)?
Ответы:
А) 1,575
Б) 3,150
В) 1575
Г) 3150
Комплексные соединения
1. Определите заряд комплексного иона, степень окисления координационное число комплексообразователя:
[CrCl2(H2O)2(NH3)2]Cl
А)-1;+6;4
Б)+2;+3;6
В)+1;+3;6
Г)-1;-3;7
2. Написать химическую формулу комплексного соединения: нитрата диаква-тетраммин-никеля(2)
А)(NH3)4[Ni(H2O)2(NO3)2]Cl
Б)[Ni(H2O)2(NH3)4](NO3)2
В)[Ni(NH3)4(NO3)2]*2H2O
Г)[Ni(H2O)2(NH3)4]NO3
3. Укажите реакцию первичной диссоциации комплексного соединения
[Co(NH3)5Cl]Cl2
А)[Co(NH3)5Cl2 → [Co(NH3)5]2++2Cl-
Б)[Co(NH3)5Cl]+↔Co3++5NH3+Cl-
В) [Co(NH3)5Cl]Cl2↔Co3++5NH3++3Cl-
4. Представить выражение для константы нестойкости (Кн) комплексного иона [Cu(NH3)4]2+
А)Кн=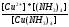
Б)Кн=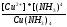
В)Кн=
Г)Кн=

5. Координационное число кобальта Со3+ как комплексообразователя равно 6. Написать формулу CoСl3*6NH3, учитывая, что молекулы аммиака играют только роль лигандов.
А)(NH3)6[CoCl3]
Б)[Co(NH3)6]Cl3
В)[Co(NH3)6Cl2]Cl
Г)(NH3)3[Co(NH3)3]Cl3
6. Написать формулу комплексной соли, имеющей эмпирическую формулу CoClSO4*5NН3, если известно, что при взаимодействии с BaCl2 она даёт осадок BaSO4, а при взаимодействии с AgCl не образуется.
А)[Co(NH3)5SO4]CL
Б)[Co(NH3)5](SO4)Cl
В)[Co(NH3)5Cl]SO4
Г)[Co(SO4)Cl](NH3)5
7. Константы нестойкости комплексных ионов соответственно равны:
1)[Co(CN)4]2-=8*10-2
2)Hg(CN)4]2-=4*10-41
3)[Cd(CN)4]2-=1,4*10-17
4)[Ag(CN)2]-=8*10-22
В каком растворе( при равной концентрации) больше ионов CN-?
А)1
Б)2
В)3
Г)4
8. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя:
[Co(NH3)4](OH)2
А)-2;+1;4
Б)+2;+2;4
В)+2;+2;6
Г)+1;+1;4
9)Написать химическую формулу комплексного соединения:
трифторо-гидроксо-бериллата магния
А)Mg[Be(OH)F3]
Б)Mg2[Be(OH)F3]
В)Be[Mg(OH)F3]
Г)Be2[Mg(OH)F3]
10. Представить выражения для константы нестойкости (Кн) комплексного иона:
[Co(NH3)6]2+
А)Кн=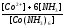
Б)Кн=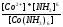
В)Кн=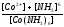
Г)Кн=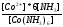
Органические вещества
-
Покажите структуру мономера, из которых может быть получен каучук.
А) CH2=C-CH=CH2
|
CH3
Б) CH2=CH2
В) CH2=C=CH-CH3
Г)(CH2OH)2;
Д) CH2=CH-CN
O
/
2. Формула акриловой кислоты CH2=CH-C . Покажите химическую формулу
\
OH
сложного эфира кислоты и метилового спирта.
OCH3
/
А) CH2=CH
\
ОН
O
//
Б) H3CO-CH=CH
\ .
ОН
OCH3 О
| //
В) CH2=C-C
| \\
OCH3 ОН
О
//
Г) CH2=CH-C
\
OCH3
О
//
Д) CH3-CH2-C
\
СН3
3. В чем суть процесса вулканизации каучука ?
А) обработка каучука кислотой;
Б) термическая каучука;
В) введение в каучука органического растворителя;
Г) введение инициатора при полимеризации;
Д) образование сульфидных мостиков между различными цепями.
4. По какому типу реакции может быть получено высокомолекулярное соединение при участии H2N-(CH2)6 –NH2 ?
А) полимеризация;
Б) поликонденсация;
В) блоксонолимеризация.
5. К какому виду высокомолекулярных соединений относится ацетатный шелк?
А ) синтетические в.м.с.;
Б) природные в.м.с.;
В) искусственные в.м.с.;
Г) пластмассы;
Д) каучуки.
6. Покажите структуру мономера/ов/, из которых наиболее вероятно получен следующий
полимер: орлон /волокно, ткани/-CH2CH(CN)CH2CH(CN)-
А) CH2=CH-CN;
Б) CH2=CH2+HCN;
В) CH3-CH2-CN;
Г) CH3-CH3+HCN;
Д) CH3-CH2-CN.
7. Почему резина является более прочным материалом, чем каучук?
А) резина обработана кислотой;
Б) различное количество мономеров в макроцепи;
В) у каучука более разветвленное строение;
Г) резина обработана щелочью;
Д) наличие мостиков серы.
8. Какое из следующих веществ будут образовывать конденсационные полимеры?
А) CH2=CH-CN;
Б) C6H5-CH=CH2 ;
В) HOOC-(CH2)2-COOH;
Г) C2H5-CH-CH2 ;
\ /
О
Д) –
9. К какому виду высокомолекулярных соединений относится нитроцеллюлоза?
А) природные в.м.с.;
Б) пластмасса;
В)синтетические в.м.с.;
Г) искусственные в.м.с.;
Д) каучуки.
10. Показать звено блоксополимера этиленстирольного каучука.
А) [СН2-СН2-С6Н4-СH2-CH2] n ;
Б) [CH2-CH2-CH-CH2] n ;
|
C6H5
CH=CH2
/ \
В) [CH2-CH2-|O| ] n ;
\ /
/ \
Г) [CH2-|O|-CH2] n ;
\ /
C2H5
Д) [ CH2-< O >- CH2-CH2-CH2] n
Высокомолекулярные соединения
1. Покажите структуру мономера(ов) , из которых наиболее вероятно получен следующий полимер: орлон (волокно, ткани)
А)СН2=СН-СN
Б)СН2=СН2+НСN
В)СН3-СН2-СN
Г)СН3-СН3+НСN
Д)СН3-СН2-СN
2. Почему резина является более прочным материалом, чем каучук?
А) резина обработана кислотой
Б) различное количество мономеров в макроцепи
В) у каучука более разветвленное строение
Г) резина обработана щелочью
Д) наличие мостиков серы
3. Какое из следующих веществ будет образовывать конденсационные полимеры?
4. К какому виду высокомолекулярных соединений относится нитроцеллюлоза?
А)природное в.м.с.
Б)пластмасса
В)синтетическое в.м.с.
Г)искусственное в.м.с.
Д)каучуки
5. Показать звено блоксополимера этиленстирольного каучука.
А)СН2=СН-СN
Б)С6Н5-СН=СН2
В)НООС-(СН2)2-СООН
Г)С2Н5-СН-СН

 О
О
Д)-
4. К какому виду высокомолекулярных соединений относится нитроцеллюлоза?
А)природное в.м.с.
Б)пластмасса
В)синтетическое в.м.с.
Г)искусственное в.м.с.
Д)каучуки
5. Показать звено блоксополимера этиленстирольного каучука.
6. Почему при
А)[-СН2-СН2-С6Н4-СН2-СН2-]n
Б)[-СН2-СН2-СН-СН2-]n
|
 С6Н5
С6Н5
В)[-СН2-СН2-О-]n
Г)[-СН2-О-СН2-]n
Д) [-СН2-О-СН2-СН2-СН2-]n
|
С2Н5
6. Почему при проникновении этилена через расплавленную серу она становится очень твердой?
А)сера и этилен образуют сополимер
Б) при пропускании газа происходит охлаждение и образуется пористая система
В)этилен полимеризуется при повышении температуры, сера катализатор
7. По какому механизму протекает образование высокомолекулярного соединения из метилметакрилата?
А)гидролиз
Б)поликонденсация
В)полимеризация
Г)озонолиз
Д)электрофильное замещение
8. Вычислить объем бутана, расходуемого на получение 1т. бутадиенового каучука, приняв выход равным 65% от теоретического. Как осуществляется реакция?
9. Покажите структуру мономера, из которого наиболее вероятно получение сарана /упаковочная пленка, покрытие/
А)638м2
Б) 638л
В)6,38м3
Г)650м3
Д)319л
9. Покажите структуру мономера, из которого наиболее вероятно получение сарана /упаковочная пленка, покрытие/
-СН2ССl2CН2ССl2-
А)nCCl4+nCН4,
Б)СН3-ССl3,
В)СН2=ССl2,
Г) СlСН2-СН2Сl
10. Укажите, какие из следующих веществ будут образовываться аддитивные полимеры
1. Укажите уравнение реакции, лежащей в основе получения чистого и особо чистого кремния
А)NH2-CO-NH2,
Б)СН3-СН2-СН2-СН3,
В)С6Н5-ОН,
Г)С6Н5-С=СН2,
|
СН3


 Д)
(СН2ОН)2
Д)
(СН2ОН)2
Кремний
1. Укажите уравнение реакции, лежащей в основе получения чистого и особо чистого кремния.
2. Какая из разновидностей кремнезема является более активной в химическом отношении?
А) SiCl4 + 2Zn = Si + 2ZnCl2
Б) SiO2 + 2C = Si + 2CO
В) SiO2 + 2Mg = 2MgO +Si
Г) SiO2 + 2H2 = Si +2H2O
Д) H2SiO3 = SiO2 + H2O
2. Какая из разновидностей кремнезёма является более активной в химическом отношении?
А)кварц
Б)тридимит
В)аморфный кремнезём
Г)кристобалит
3. В каких нижеуказанных веществах растворяется двуокись кремния?
А) NaOH и HCl
Б) H2SO4 и HCl
В) HNO3 и H2SO4
Г) NaOH и Ca(OH)2
Д) NaOH и HF
4. Какая реакция лежит в основе получения метакремниевой кислоты в лабораторных условиях?
А) H2O + SiO2 = H2SiO3
Б) CaSiO3 + H2SO4 = CaSO4 + H2SiO3
В) CaSiO3 + 2HCl = H2SiO3 + CaCl2
Г) Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Д) Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
5. Какая формула отражает химический состав жидкого стекла?
6. Какой из способов получения кремния является наиболее экономически выгодным?
А) CaSiO3
Б) Na2SiO3
В) H2SiF6
Г) Ca2SiO4
Д) Na2O*CaO*6SiO2
6. Какой из способов получения кремния является наиболее экономически выгодным?
А) SiO2 + C = Si + CO2
Б) SiO2 + 2Mg = 2MgO + Si
В ) SiO2 + 4Na = 2Na2O + Si
Г ) SiO2 + 2H2 = Si + 2H2О
Д ) SiCl4 + 4Na = 4NaCl + Si
7. Какая из нижеуказанных реакций отражает процесс промышленного способа получения оконного стекла?
А) 2NaOH + SiO2 = Na2SiO3 + H2O
Б) Na2CO3 + SiO2 = Na2SiO3 + H2O + CO2
В) Na2CO3 + CaCO3 +6SiO2 = Na2O*CaO*6SiO2 + 2CO2
Г) SiO2 + Ca(OH)2 = CaSiO3 + H2O
Д) SiO2 + NaOH = Na2SiO3
8. В каком из нижеуказанных веществ растворяется кремний?
А) C2H5OH
Б) HF
В) HCl
Г) HNO3
Д) H2SO4
9. Укажите формулу метакремниевой кислоты
А) H4SiO4
Б) 2H2O*SiO2
В) H2O*SiO2
Г) H2O*2SiO2
Д) H2Si2O5
10. Какие соли кремнефтористоводородной кислоты используются в качестве флюатов чаще всего?
А) MgSiF6 и Na2SiF6
Б) Fe2(SiF6)3 и Al2(SiF6)3
В) Al2(SiF6)3 и Na2SiF6
Г) Al2(SiF6)3 и MgSiF6
Д) Cr2(SiF6)3 и K2SiF6
Приложение
Таблица 1
|
Квантовый |
Магнитное квантовое число m1 |
Число квантовых состояний |
Максимальное число электронов |
|||||||
|
уровень |
подуровень |
В под-уровне (2l+1) |
В уровне n2 |
В под-уровне 2(2l+1) |
В уровне 2 n2 |
|||||
|
обоз- наче-ние |
Глав- ное кван- товое число n |
обоз- наче-ние |
Орби- таль-ное кван-товое число l |
|||||||
|
К |
1 |
s |
0 |
0 |
1 |
1 |
2 |
2 |
||
|
L |
2 |
s |
0 |
0 |
1 |
|
2 |
|
||
|
|
|
p |
1 |
-1; 0; +1 |
3 |
4 |
6 |
8 |
||
|
M |
3 |
s |
0 |
0 |
1 |
|
2 |
|
||
|
|
|
p |
1 |
-1; 0; +1 |
3 |
9 |
6 |
18 |
||
|
|
|
d |
2 |
-2; -1;0;+1;+2 |
5 |
|
10 |
|
||
|
N |
4 |
s |
0 |
0 |
1 |
|
2 |
|
||
|
|
|
p |
1 |
-1; 0; +1 |
3 |
|
6 |
|
||
|
|
|
d |
2 |
-2; -1;0;+1;+2 |
5 |
16 |
10 |
32 |
||
|
|
|
f |
3 |
-3; -2; -1; 0;+1;+2;+3 |
7 |
|
14 |
|
||
Произведение растворимости малорастворимых
веществ в воде при 25оС
|
Вещество |
ПР |
|
AgBr |
6,3*10-13 |
|
Ag2CO3 |
6,15*10-12 |
|
AgCl |
1,56*10-10 |
|
AgI |
1,5*10-16 |
|
Ag3PO4 (20oC) |
1,8*10-18 |
|
Ag2S |
5,7*10-51 |
|
Ag2SO4 |
7,7*10-5 |
|
Al(OH)3 |
1,9*10-33 |
|
BaCO3 |
7*10-9 |
|
BaCrO4 |
2,3*10-10 |
|
BaSO4 |
1,08*10-10 |
|
CaCO3 |
4,8*10-9 |
|
Ca3(PO4)3 |
1*10-25 |
|
CaSO4 |
6,10*10-5 |
|
CdCO3 |
2,5*10-14 |
|
CuCO3 |
2,36*10-10 |
|
Cu(OH)2 |
5,6*10-20 |
|
CuS |
4,*10-38 |
|
Fe(OH)3 (18oC) |
3,8*10-38 |
|
FeS |
3,7*10-19 |
|
Mg(OH)2 |
5,5*10-12 |
|
MgS |
2,0*10-15 |
|
MnCO3 |
5,05*10-10 |
|
MnS (18oC) |
5,6*10-16 |
|
PbCO3 |
1,5*10-13 |
|
PbCl2 |
1,7*10-5 |
|
PbS (18 oC) |
1,1*10-29 |
|
PbSO4 |
1,8*10-8 |
|
SrCO3 |
9,42*10-10 |
|
SrSO4 |
2,8*10-7 |
|
ZnCO3 |
6*10-11 |
|
Zn(OH)2 (20oC) |
4*10-16 |
Стандартные, окислительно – восстановителтьные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
|
Окисленная форма |
Число получаемых электронов |
Восстановленная форма |
φ o , В |
|
Li+ |
1 |
Li |
3,045 |
|
Rb+ |
1 |
Rb |
-2,925 |
|
K+ |
1 |
K |
-2,925, |
|
Cs+ |
1 |
Cs |
-2,923 |
|
Ba2+ |
2 |
Ba |
-2,900 |
|
Sr2+ |
2 |
Sr |
-2,890 |
|
Ca2+ |
2 |
Ca |
-2,870 |
|
Na+ |
1 |
Na |
-2,714 |
|
La3+ |
3 |
La |
-2,522 |
|
Mg2+ |
2 |
Mg |
-2,370 |
|
AlO2- + 2H2O |
3 |
Al + 4OH- |
-2,350 |
|
Be2+ |
2 |
Be |
-1,847 |
|
Al3+ |
3 |
Al |
-1,662 |
|
ZnO22-+2H2O |
2 |
Zn +4OH- |
-1,216 |
|
Mn2+ |
2 |
Mn |
-1,180 |
|
SO42-+ H2O |
2 |
SO32-+ 2OH- |
-0,930 |
|
2H2O |
2 |
H2 + 2OH- |
-0,828 |
|
Zn2+ |
2 |
Zn |
-0,763 |
|
Cr3+ |
3 |
Cr |
-0,744 |
|
Fe2+ |
2 |
Fe |
-0,440 |
|
Cd2+ |
2 |
Cd |
-0,403 |
|
Ti3+ |
1 |
Ti2+ |
-0,370 |
|
PbSO4 |
2 |
Pb+(SO4)2- |
-0,356 |
|
In3+ |
3 |
In |
-0,343 |
|
Ti+ |
1 |
Ti |
-0,336 |
|
CO2+ |
2 |
Co |
-0,277 |
|
Ni2+ |
2 |
Ni |
-0,250 |
|
Sn2+ |
2 |
Sn |
-0,136 |
|
(CrO4)2-+4H2O |
3 |
Cr(OH)3+5OH- |
-0,130 |
|
Pb2+ |
2 |
Pb |
-0,126 |
|
Fe3+ |
3 |
Fe |
-0,036 |
|
2H+ |
2 |
H2 |
0,000 |
|
(NO3)-+H2O |
2 |
(NO2)-+2OH- |
+0,010 |
|
S + 2H+ |
2 |
H2S |
+0,141 |
|
Sn4+ |
2 |
Sn2+ |
+0,150 |
|
Cu2+ |
1 |
Cu+ |
+0,153 |
|
(SO4)2-+ 4H+ |
2 |
H2SO3+H2O |
+0,170 |
|
AgCl |
1 |
Ag+Cl- |
+0,222 |
|
2(SO4)2-+ 10H+ |
8 |
(S2O3)2-+ 5H2O |
+0,290 |
|
(ClO3)- + H2O |
2 |
(ClO2)-+2OH- |
+0,330 |
|
Cu2+ |
2 |
Cu |
+0,337 |
|
[Fe(CN)6]3- |
1 |
[Fe(CN)6]4- |
+0,360 |
|
(SO4)2- +8H+ |
6 |
S+ 4H2O |
+0,360 |
|
(ClO4)-+ H2O |
2 |
(ClO3)-+ 2OH- |
+0,360 |
|
O2 +2 H2O |
4 |
4OH- |
+0,401 |
|
H2SO3 +4H+ |
4 |
S+3H2O |
+0,450 |
|
Cu+ |
1 |
Cu |
+0,521 |
|
I2 |
2 |
2I- |
+0,536 |
|
H3AsO4 +2H+ |
2 |
HAsO2+2H2O |
+0,559 |
|
(MnO4)- |
1 |
(MnO4)2- |
+0,564 |
|
(MnO4)-+ 2H2O |
3 |
MnO2+4OH- |
+0,588 |
|
(MnO4)-+ 2H2O |
2 |
MnO2+4OH- |
+0,600 |
|
(ClO2)-+ H2O |
2 |
(ClO)-+2OH- |
+0,660 |
|
O2+2H+ |
2 |
H2O2 |
+0,682 |
|
(BrO)-+ H2O |
2 |
Br -+2OH- |
+0,760 |
|
Fe3+ |
1 |
Fe2+ |
+0,771 |
|
(NO3)-+2H+ |
1 |
NO2+ H2O |
+0,790 |
|
Hg22+ |
2 |
2Hg |
+0,798 |
|
Ag+ |
1 |
Ag |
+0,799 |
|
O2+4H+(10-7м) |
4 |
2H2O |
+0,815 |
|
Hg2+ |
2 |
Hg |
+0,854 |
|
(ClO)-+ H2O |
2 |
Cl-+2OH- |
+0,890 |
|
(NO3)- + 3H+ |
2 |
HNO2+ H2O |
+0,940 |
|
(NO3)- + 4H+ |
3 |
NO+ 2H2O |
+0,960 |
|
HNO2+H+ |
1 |
NO+ H2O |
+1,000 |
|
Br2 |
2 |
2Br – |
+1,065 |
|
(IO3)-+6H+ |
6 |
I -+3H2O |
+1,090 |
|
2(IO3)-+12H+ |
10 |
I2 -+6H2O |
+1,195 |
|
(ClO4)-+2H+ |
2 |
(ClO3)-+ H2O |
+1,190 |
|
O2+4H+ |
4 |
2H2O |
+1,229 |
|
MnO2+4H+ |
2 |
Mn2++2H2O |
+1,230 |
|
Tl3+ |
3 |
Tl |
+1,125 |
|
HBrO+H+ |
2 |
Br - + H2O |
+1,330 |
|
(Cr2O7)2-+14H+ |
6 |
2Cr3++7 H2O |
+1,330 |
|
Cl2 |
2 |
2Cl- |
+1,359 |
|
(BrO3)-+6H+ |
6 |
Br - + 3H2O |
+1,440 |
|
(ClO3)-+6H+ |
6 |
Cl-+3H2O |
+1,450 |
|
PbO2+4H+ |
2 |
Pb2++3H2O |
+1,456 |
|
2(ClO3)-+12H+ |
10 |
Cl2 + 6H2O |
+1,470 |
|
Au3+ |
3 |
Au |
+1,500 |
|
(MnO4)-+ 8H+ |
5 |
Mn2+ + 4H2O |
+1,510 |
|
2(BrO3)-+ 12H+ |
10 |
Br2 + 6H2O |
+1,520 |
|
PbO2+4H++SO42- |
2 |
PbSO4 + 2H2O |
+1,685 |
|
(MnO4)-+ 4H+ |
3 |
MnO2+2H2O |
+1,695 |
|
H2O2+2H+ |
2 |
2H2O |
+1,776 |
|
CO3+ |
1 |
Co2- |
+1,810 |
|
F2 |
2 |
2F- |
+2,870 |
Константы нестойкости некоторых
комплексных ионов
|
Уравнение диссоциации комплексного иона |
Константа нестойкости, Кн |
|
[Ag(CN)2]-↔Ag+ + 2CN- |
1,0*10-21 |
|
[Ag(NH3)2] + ↔ Ag+ + 2NH3 |
5,89*10-8 |
|
[Ag(S2O3)2]3- ↔ Ag+ + 2S2O32- |
1,00*10-18 |
|
[AlF6]3- ↔ Al3+ + 6F- |
1,45*10-25 |
|
[Au(CN)2]+ ↔ Au++2CN- |
5,01*10-39 |
|
[Cd(CN)4]2- ↔ Cd2++ 4CN- |
7,66*10-18 |
|
[CdI4]2- ↔ Cd2+ + 4I- |
7,94*10-7 |
|
[Cd(NH3)4]2+ ↔Cd2+ + 4NH3 |
2,75*10-7 |
|
[Co(CNS4)]2- ↔ Co2+ + 4CNS- |
5,50*10-3 |
|
[Co(NH3)6]2+ ↔Co2+ + 6NH3 |
4,07*10-5 |
|
[Cu(CN)2]- ↔Cu+ + 2CN- |
1,00*10-24 |
|
[Cu(CN)4]3- ↔Cu+ + 4CN- |
5,13*10-31 |
|
[Cu(NH3)4]2+ ↔ Cu2+ +4NH3 |
9,33*10-13 |
|
[Fe(CN)6]4- ↔ Fe2+ + 6CN- |
1,00*10-24 |
|
[Fe(CN)6]3- ↔ Fe3+ + 6CN- |
1,00*10-31 |
|
[HgCl4]2- ↔ Hg2+ + HCl- |
6,03*10-16 |
|
[Hg(CN)4]2- ↔ Hg2+ + 4CN- |
3,02*10-42 |
|
[Hg(CNS)4]2- ↔ Hg2+ + 4CNS- |
1,29*10-30 |
|
[HgI4]2- ↔ Hg2+ + 4I |
1,38*10-30 |
|
[Ni(CN)4]2- ↔ Ni2+ + 4CN- |
1,00*10-22 |
|
[Ni(NH3)6]2+ ↔ Ni2++6NH3 |
9,77*10-9 |
|
[Zn(CN)4]2- ↔ Zn2+ + 4CN- |
1,00*10-16 |
|
[Zn(CNS)4]2- ↔ Zn2+ + 4CNS- |
5,00*10-2 |
|
[Zn(NH3)6]2+ ↔ Zn2++4NH3 |
2,00*10-9 |
|
[Zn(OH)4]2- ↔ Zn2+ + 4OH- |
7,08*10-16 |
Термодинамические константы некоторых веществ
|
Вещество |
|
|
|
|
Ag (к) |
0 |
0 |
42,69 |
|
AgBr (к) |
-99,16 |
-95,94 |
107,1 |
|
AgCl (к) |
-126,8 |
-109,7 |
96,07 |
|
AgI (к) |
-64,2 |
-66,3 |
114,2 |
|
AgF (к) |
-202,9 |
-184,9 |
83,7 |
|
AgNO3 (к) |
-120,7 |
-32,2 |
140,9 |
|
Ag2O (к) |
-30,56 |
-10,82 |
121,7 |
|
Ag2CO3 (к) |
-506,1 |
-437,1 |
167,4 |
|
Al (к) |
0 |
0 |
28,31 |
|
Al2O3 (к) |
-1675,0 |
1576,4 |
50,94 |
|
Al(OH)3 (к) |
-1275,7 |
1139,72 |
71,1 |
|
AlCl3 (к) |
-697,4 |
-636,8 |
167,0 |
|
Al2 (SO4) 3 (к) |
-3434,0 |
-3091,9 |
239,2 |
|
As (к) |
0 |
0 |
35,1 |
|
As2O3 (к) |
-656,8 |
-575,0 |
107,1 |
|
As2O5 (к) |
-918,0 |
-772,4 |
105,4 |
|
Au (к) |
0 |
0 |
47,65 |
|
AuF (к) |
-74,3 |
-58,6 |
96,4 |
|
AuF3 (к) |
-348,53 |
-297,48 |
114,2 |
|
Au(OH)3 (к) |
-418,4 |
-289,95 |
121,3 |
|
AuCl3 (к) |
-118,4 |
-48,53 |
146,4 |
|
B (к) |
0 |
0 |
5,87 |
|
B2O3 (к) |
-1264,0 |
-1184,0 |
53,85 |
|
B2H6 (г) |
31,4 |
82,8 |
232,9 |
|
Ba (к) |
0 |
0 |
64,9 |
|
BaO (к) |
-556,6 |
-528,4 |
70,3 |
|
Be (к) |
0 |
0 |
9,54 |
|
BeO (к) |
-598,7 |
-581,6 |
14,10 |
|
BeCO3 (к) |
-951,57 |
-944,75 |
199,4 |
|
Bi (к) |
0 |
0 |
56,9 |
|
BiCl3 (г) |
-270,7 |
-260,2 |
356,9 |
|
BiCl3 (к) |
-379,1 |
-318,9 |
189,5 |
|
Br2 (г) |
30,92 |
3,14 |
345,35 |
|
HBr (г) |
-36,23 |
-53,22 |
198,48 |
|
C (алмаз) |
1,897 |
2,866 |
2,38 |
|
C(графит) |
0 |
0 |
5,74 |
|
CO (г) |
-110,5 |
-137,27 |
197,4 |
|
CO2 (г) |
-393,51 |
-394,38 |
213,6 |
|
COCl2 (г) |
-223,0 |
-210,5 |
289,2 |
|
CS2(г) |
115,3 |
65,1 |
237,8 |
|
CS2 (ж) |
87,8 |
63,6 |
151,0 |
|
C2H2 (г) |
226,75 |
209,2 |
200,8 |
|
C2H4 (г) |
52,28 |
68,12 |
219,4 |
|
CH4 (г) |
-74,85 |
-50,79 |
186,19 |
|
C2H6 (г) |
-847,67 |
-32,89 |
229,5 |
|
C6H6 (г) |
49,04 |
124,50 |
173,2 |
|
CH3OH (ж) |
-238,7 |
-166,31 |
126,7 |
|
C2H5OH (ж) |
-227,6 |
-174,77 |
160,7 |
|
CH3COOH (ж) |
-484,9 |
-392,46 |
159,8 |
|
Ca (к) |
0 |
0 |
41,62 |
|
CaO (к) |
-635,1 |
-604,2 |
39,7 |
|
CaF2 (к) |
-1214,0 |
-1161,9 |
68,87 |
|
CaCl2 (к) |
-785,8 |
-750,2 |
113,8 |
|
CaC2 (к) |
-62,7 |
-67,8 |
70,3 |
|
Ca3N2 (к) |
-431,8 |
-368,6 |
104,6 |
|
Ca(OH)2 (к) |
-986,2 |
-896,76 |
83,4 |
|
CaSO4 (к) |
-1424,0 |
-1320,3 |
106,7 |
|
СaSiO3 (к) |
-1579,0 |
-1495,4 |
87,45 |
|
Ca3(PO4)2 (к) |
-4125,0 |
-3899,5 |
240,9 |
|
CaCO3 (к) |
-1206,0 |
-1128,8 |
92,9 |
|
Cl2 (г) |
0 |
0 |
223,0 |
|
HCl (г) |
-92,30 |
-95,27 |
186,7 |
|
HCl (ж) |
-167,5 |
-131,2 |
55,2 |
|
HClO (ж) |
-116,4 |
-80,0 |
129,7 |
|
Cr (к) |
0 |
0 |
23,76 |
|
Cr2O3 (к) |
-1141,0 |
-1046,84 |
81,1 |
|
Cr(CO)6 (к) |
-1075,62 |
-982,0 |
359,4 |
|
Cs (к) |
0 |
0 |
84,35 |
|
Cs2O (к) |
-317,6 |
-274,5 |
123,8 |
|
CsOH (к) |
-406,5 |
-355,2 |
77,8 |
|
Cu (к) |
0 |
0 |
33,3 |
|
Cu2O (к) |
-167,36 |
-146,36 |
93,93 |
|
CuO (к) |
-165,3 |
-127,19 |
42,64 |
|
Cu(OH)2 (к) |
-443,9 |
-356,90 |
79,50 |
|
CuF2 (к) |
-530,9 |
-485,3 |
84,5 |
|
CuCl2 (к) |
-205,9 |
-166,1 |
113,0 |
|
CuBr2 (к) |
-141,42 |
-126,78 |
142,34 |
|
CuI2 (к) |
-21,34 |
-23,85 |
159,0 |
|
Cu2S (к) |
-82,01 |
-86,19 |
119,24 |
|
CuS (к) |
-48,5 |
-48,95 |
66,5 |
|
CuSO4 (к) |
-771,1 |
-661,91 |
113,3 |
|
CuCO3(к) |
-594,96 |
-517398 |
87,9 |
|
Cu(NO3)2 (к) |
-307,11 |
-114,22 |
193,3 |
|
Fe(к) |
0 |
0 |
27,15 |
|
FeO (к) |
-263,68 |
-244,35 |
58,79 |
|
FeCl2 (к) |
-341,0 |
-302,08 |
119,66 |
|
Fe2O3 (к) |
-821,32 |
-740,99 |
89,96 |
|
Fe(OH)3 (к) |
-824,25 |
-694,54 |
96,23 |
|
FeCl3 (к) |
-405,0 |
-336,39 |
130,1 |
|
FeSO4 (к) |
-922,57 |
-829,69 |
107,51 |
|
FeCO3 (к) |
-744,75 |
-637,88 |
92,9 |
|
GeO (к) |
-305,4 |
-276,1 |
50,2 |
|
GeO2 (к) |
-539,74 |
-531,4 |
52,30 |
|
H2 (г) |
0 |
0 |
130,6 |
|
H2O (г) |
-241,84 |
-228,8 |
188,74 |
|
H2O (ж) |
-285,84 |
-237,5 |
69,96 |
|
H2O2 (ж) |
-187,36 |
-117,57 |
105,86 |
|
Hg (к) |
0 |
0 |
76,1 |
|
HgCl (к) |
-230,12 |
-185,77 |
144,35 |
|
Hg2Cl2 (к) |
-264,85 |
-210,66 |
195,81 |
|
I2 (к) |
0 |
0 |
116,73 |
|
I2 (г) |
62,24 |
19,4 |
260,58 |
|
HI (г) |
25,94 |
1,30 |
206,33 |
|
HIO (ж) |
-158,9 |
-98,7 |
24,32 |
|
K (к) |
0 |
0 |
64,35 |
|
K2O (к) |
-361,5 |
-193,3 |
87,0 |
|
K2O (к) |
-361,5 |
-193,3 |
87,0 |
|
KOH (к) |
-425,93 |
-374,47 |
59,41 |
|
KNO3 (к) |
-492,71 |
-393,13 |
132,93 |
|
KNO2 (к) |
-370,28 |
281,58 |
117,15 |
|
K2SO4 (к) |
-1433,44 |
-1316,37 |
175,73 |
|
KHSO4 (ж) |
-1158,1 |
-1043,49 |
187,89 |
|
KH (к) |
-56,9 |
-38,49 |
67,95 |
|
Li (к) |
0 |
0 |
28,03 |
|
Li2O (к) |
-595,8 |
-560,2 |
37,9 |
|
LiOH (к) |
-487,8 |
-443,1 |
42,81 |
|
Mg (к) |
0 |
0 |
32,55 |
|
MgO (к) |
-601,24 |
-569,6 |
26,94 |
|
Mg(OH)2 (к) |
-924,66 |
-833,7 |
63,14 |
|
MgCO3 (к) |
-1096,21 |
-1029,3 |
65,69 |
|
MnSO4 (к) |
-1063,74 |
-955,96 |
112,13 |
|
N2 (г) |
0 |
0 |
191,5 |
|
N2O(г) |
81,55 |
103,6 |
220,0 |
|
NO (г) |
90,37 |
86,69 |
210,62 |
|
NO2 (г) |
33,89 |
51,84 |
240,45 |
|
N2O4 (г) |
9,37 |
98,29 |
304,3 |
|
NH3 (г) |
-46,19 |
-16,64 |
192,5 |
|
HNO3 (ж) |
-173,0 |
-79,91 |
156,16 |
|
NH4Cl (к) |
-315,39 |
-343,64 |
94,56 |
|
NH4OH (ж) |
-366,69 |
-263,8 |
179,9 |
|
Na(к) |
0 |
0 |
51,42 |
|
Na2O (к) |
-430,6 |
-376,6 |
71,1 |
|
NaOH (к) |
-426,6 |
-377,0 |
64,18 |
|
NaCl (к) |
-410,9 |
-384,0 |
72,36 |
|
Na2CO3 (к) |
-1129,0 |
-1047,7 |
136,0 |
|
Na2SO4 (к) |
-1384,00 |
-1266,8 |
149,4 |
|
Na2SiO3 (к) |
-1518,0 |
-1426,7 |
113,8 |
|
O2 (г) |
0 |
0 |
205,03 |
|
P (красный) |
-18,41 |
-13,81 |
22,8 |
|
PCl3 (г) |
-277,0 |
-286,27 |
311,7 |
|
PCl5 (г) |
-369,45 |
-324,55 |
362,9 |
|
HPO3 (ж) |
-982,4 |
-902,91 |
150,6 |
|
H3PO4 (ж) |
-1271,94 |
-1147,25 |
200,83 |
|
Pb(к) |
0 |
0 |
64,9 |
|
PbO (к) |
-217,86 |
-188,49 |
67,4 |
|
PbO2 (к) |
-276,6 |
-218,99 |
76,44 |
|
PbCl2 (к) |
-359,2 |
-313,97 |
136,4 |
|
PbSO4 (к) |
-918,1 |
-811,24 |
147,28 |
|
PbS (к) |
-94,28 |
-92,68 |
91,20 |
|
Rb (к) |
0 |
0 |
76,2 |
|
Rb2O (к) |
-330,12 |
-290,79 |
109,6 |
|
RbOH (к) |
-413,8 |
-364,43 |
70,7 |
|
S (ромб) |
0 |
0 |
31,88 |
|
SO2 (г) |
-296,9 |
-300,37 |
248,1 |
|
SO3 (г) |
-395,2 |
-370,37 |
256,23 |
|
H2S (г) |
-20,15 |
-33,02 |
205,64 |
|
H2S (ж) |
-39,33 |
-27,36 |
122,2 |
|
H2SO4 (ж) |
-811,3 |
-742,0 |
156,9 |
|
H2Se (г) |
85,77 |
71,13 |
221,3 |
|
SiO2 (к) |
-859,3 |
-803,75 |
42,09 |
|
SnO(к) |
-286,0 |
-257,32 |
56,74 |
|
SnO2 (к) |
-580,8 |
-519,65 |
52,34 |
|
SrO (к) |
-590,4 |
-559,8 |
54,4 |
|
SrCO3 (к) |
-1221,3 |
-1137,6 |
97,1 |
|
H2Te (г) |
154,39 |
138,48 |
234,3 |
|
Zn (к) |
0 |
0 |
41,59 |
|
ZnO (к) |
-394,0 |
-318,19 |
43,5 |
|
ZnS (к) |
-201,0 |
-198,32 |
57,7 |
|
ZnSO4 (к) |
-378,2 |
-871,57 |
124,6 |
Содержание
Предисловие 3
1.Основные законы химии 5
1.1 Моль. Количество вещества эквивалента 5
(эквивалент) и молярная масса эквивалента
(эквивалентная масса) простых и сложных веществ.
Закон эквивалентов.
2.Строение атома 9
2.1 Строение атома
2.2 Химическая связь и строение молекул.
Конденсированное состояние вещества 16
3.Энергетика химических процессов
(термохимические расчеты) 19
3.1 Химическое сродство 24
4.Химическая кинетика и равновесие 29
5.Дисперсные системы 32
5.1 Способы выражения концентрации раствора 32
5.2 Свойства растворов 34
5.3 Ионно-молекулярные (ионные) реакции обмена 36
5.4 Гидролиз солей 38
6.Окислительно – восстановительные реакции 40
6.1 Электродные потенциалы и электродвижущие силы 43
6.2 Электролиз 47
6.3 Коррозия металлов 48
7.Комплексные соединения 49
8.Жесткость воды и методы ее устранения 50
9.Теория строений органических соединений 52
9.1 Теория А.М. Бутлерова 52
9.2 Углеродные цепи и изомерия 55
9.3 Электронные структуры органических соединений 56
10. Классификация органических соединений .
Типы реакций 60
10.1 Радикалы 60
10.2 Функциональные группы 61
10.3 Типы реакций органических соединений 63
11.Реакции полимеризации.
Образование высокомолекулярных соединений. 68
11.1 Полимеризация органических соединений 68
11.2 Полимеризация углеводородов с двойной связью 69
11.3 Сополимеризация. 74
11.4 Ионная полимеризация. 74
11.5 Пространственная изомерия органических
соединений(стереоизомерия) 76
12.Кристаллическое состояние 79
12.1 Основные понятия 79
12.2 Симметрия кристаллов. Система кристаллов. 82
12.3 Кристаллические решетки 85
13.Сплавы 90
13.1 Диаграммы состояния металлических систем 91
Задачи 104
Тесты 145
Приложения 179
Библиографический список
1. Артеменко, А.И.
Органическая химия: учебник для строит. специальностей вузов / А.И. Артеменко. – Изд. 5-е, испр.. – М.: Высш. шк., 2002. -559с.
2. Глинка, Н.Л.
Общая химия: [ учеб. пособие для вузов] / Н.Л. Глинка ; под ред. А.И. Ермакова. – Изд. 30-е., испр.. – М.: Интеграл – Пресс, 2004.-727с.
3. Глинка, Н.Л.
Общая химия / Н.Л. Глинка; под ред. А.И. Ермакова. – Изд. 30-е, испр..-М.: Интеграл – Пресс, 2006. – 727с.: ил.

 10–39
10–39 10–28
10–28 10–41
10–41 кДж/моль
кДж/моль кДж/моль
кДж/моль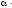 Al2O3
Al2O3 Al2O3
Al2O3
 ,
кДж/моль
,
кДж/моль ,
кДж/моль
,
кДж/моль ,
Дж/(моль*К)
,
Дж/(моль*К)